日外会誌. 124(4): 353-358, 2023
特集
外科的冠動脈血行再建術の現状と展望
8.虚血性心疾患に対する再生医療
|
大阪大学大学院医学系研究科 心臓血管外科 河村 拓史 , 宮川 繁 |
虚血性心疾患を背景とする重症心不全の中には,既存の治療方法では救命できない患者が存在する.現在の重症心不全に対する根本的な治療方法である心臓移植や補助人工心臓治療の限界を補佐するための新規治療方法の開発は急務と考えられ,種々の細胞移植による心筋再生療法はその中でも有望な治療方法の一つと考えられている.大阪大学心臓血管外科ではこれまで,細胞移植による心筋再生療法を,基礎研究から臨床応用まで一貫した開発を行ってきた.その結果,これまでに自己骨格筋筋芽細胞シート移植,他家iPS細胞由来心筋細胞移植,脂肪由来幹細胞スプレー法による移植が臨床応用まで到達した.本論文では,これらの細胞移植による心筋再生療法に関して,その開発の背景,現状に関して提示する.
キーワード
重症心不全, 心筋再生医療, 細胞移植
I.はじめに
虚血性心疾患は,動脈硬化による冠動脈狭窄から心筋の機能障害が引き起こされ生じる.治療方法については,発症予防,進行抑制などを目的とした薬物療法,冠動脈への血行再建,形態的異常に対する外科的治療介入などが考慮されるが,あらゆる既存の治療方法を行っても心不全の進行を来たす重症心不全に対しては,補助人工心臓,心臓移植などの心機能の代替療法が考慮される.
心臓移植については,わが国ではドナー不足により5年以上の待機期間が必要な状況となっており,その間植込み型左室補助人工心臓(LVAD)による治療を行う必要がある.しかしながら,長期間のLVAD治療により感染,脳血管合併症などの問題がよりクローズアップされる状況となっており,これらを補佐するような新たな治療方法の開発が急務となっている.
心不全心に対する機能改善を目標とした心筋再生医療の中で,細胞移植による治療はこれまでに数多くの基礎研究が行われ,臨床研究へと進んだ研究も多い.一番初めに報告された心不全への細胞移植治療は,フランスで行われた自己筋芽細胞を下腿から採取し,開胸下に心筋組織に注射で移植する臨床研究である1).その他の細胞種として,骨髄間葉系幹細胞2),ES細胞由来心筋細胞3)の心不全患者への移植の報告が散見される.しかしながら,臨床試験において心不全に対して有効性が見いだされ,製品化されたものは皆無と言わざるを得ない.当科ではこれまで,基礎研究から臨床応用までを一貫して行い,自己骨格筋筋芽細胞シート,iPS細胞由来心筋細胞シート,脂肪由来幹細胞スプレー移植の臨床応用を行ってきた.特に自己骨格筋筋芽細胞シートについては,早期承認制度を経てテルモ社より製造・販売される「ハートシート®」として保険収載されるに至った.本論文では,これまで当科で行ってきた産官学連携による細胞移植による心筋再生療法の開発について,それぞれその背景,現状を紹介する.
II.心筋再生療法のための細胞シート技術
心不全に対する細胞移植による心筋再生療法の究極的な目標は,心不全心で生着し心機能を発揮する心筋を細胞移植により補充することにあると考えられる.そのため,生体外において拍動,収縮する心筋組織体を作成する必要があると考えられてきた.東京女子医大の岡野教授らは,poly(N-isopropylacrylamide)(PNIPAAm)を塗布した培養皿を用いて細胞シートの作成を行った4).37℃の状態ではPNIPAAmは疎水性で細胞との接着性を有するが,21℃にすると親水性となり細胞との接着性を有しない.この性質を利用し,37℃で細胞を培養し,細胞が増殖し組織体となった時点で培養温度を21℃にして,細胞間接着,細胞と細胞外基質を保ったまま細胞を組織体として回収することが可能となる.またこの細胞組織体は,表面に接着蛋白を維持しており,生体臓器に移植した際に移植臓器との良好な接着能を有する.清水らはニワトリの心筋細胞を用いて,温度応答性培養皿を使用することで自律拍動能を有する心筋組織体を作成した.この組織体は電気生理学的に心筋組織と相同性が高く5),積層化したシートは,デスモゾーム,介在板,Connexin43 が形成され,組織的・電気的にも結合することを見出した.この細胞シート技術を用いて作成した新生仔心筋細胞シートは,ラット心筋梗塞心に生着することが証明され,移植した心筋細胞シートは移植心と電気的に同期して拍動し,心機能を向上させる可能性が示された6).
III.自己骨格筋筋芽細胞シート(ハートシート®)
細胞シート技術を用いた心筋組織移植による心筋再生療法の実現に向けて,開発当初は心筋細胞を用いることが困難であったこともあり,骨格筋を再生する能力を有する骨格筋筋芽細胞が用いられた.Memon らはラット虚血性心筋症モデルに筋芽細胞シートを移植し,左室リモデリング抑制と,心機能が改善することを示した7).また拡張型心筋症ハムスターに筋芽細胞シートを移植することで,心収縮機能は改善し,αサルコグリカンおよびβサルコグリカンをはじめとしたホスト心筋細胞骨格蛋白の維持,生存率の向上,および線維化の抑制が認められることが示された8).さらに前臨床研究として高頻度ベーシングによる拡張型心筋症イヌモデル9),虚血性心筋症ブタに対して筋芽細胞シートを移植し,左室リモデリング抑制,心収縮機能の改善効果を示してきた.
これらの前臨床試験の結果を受け,当科では最初の臨床応用として,左室補助人工心臓を装着した4例の拡張型心筋症患者に対して,筋芽細胞シート移植を行った.その結果,4例中2例において心機能の改善が認められ,左室補助人工心臓からの離脱が可能であった10).また左室補助人工心臓を装着していない心不全患者に対しても筋芽細胞シート移植を行い,一部の患者で左室リバースリモデリング,症状の改善が認められることを明らかにした11).また,治療効果が得られた患者群の解析から,筋芽細胞シートの効果が得られる可能性の高い患者群として,左室拡大が軽度で,腎機能の保たれた症例が候補として提示された12).一方で,虚血性心筋症に対する筋芽細胞シート移植治療は,企業治験として多施設臨床試験が行われ,経時的な心機能改善,症状の改善,運動耐用能の改善が報告された13).これらの結果を受け,自己骨格筋筋芽細胞シートは,虚血性心筋症に対する再生医療製品として早期承認を受け,世界初の心不全に対する再生医療製品「ハートシート®」として市販化された.現在レジストリー型市販後調査により,症例数を増加させた上で再度その安全性,有効性の検証が行われている.
IV.iPS細胞由来心筋細胞シート
筋芽細胞シート移植において治療効果が十分得られない患者群として,著明な線維化,心拡大が示されたことから,心筋細胞を多量に失ったことが示唆される高度心不全に対しては,心筋細胞の補充を行うことが必要と考えられた.近年体細胞より誘導されたiPS細胞が生理的・解剖学的に心臓を構成する心筋細胞と相同性の高い心筋細胞を誘導することも可能となり14),これらのiPS細胞由来心筋細胞を用いて作成された心筋細胞シートを大動物心不全モデルへ移植することで,治療効果が示された15)16).治療効果が得られるメカニズムとして,移植した iPS 細胞由来心筋細胞シートがレシピエント心においてポンプ機能を有する心筋として機能する可能性があることが示されると共に17),肝細胞増殖因子をはじめとしたサイトカイン分泌による血管新生効果からの血流の改善が機能回復をもたらした可能性も示されている15).
一方,iPS細胞を臨床応用する上で,自己細胞を用いた自家移植を行うことは,細胞製造コスト,安全性の担保の面から現実的ではなく,同種他家由来iPS細胞を用いた細胞移植が有望と考えられている.他家iPS細胞に対しては免疫拒絶反応が誘導されることが予測されるため,iPS細胞の抗原性を検討する必要があると考えられた.そこでわれわれは細胞移植において抗原となる可能性のある糖鎖に注目し,iPS 細胞に発現している N型糖鎖の発現を網羅的に解析した.その結果,マウス・ヒトiPS細胞いずれにおいても,未分化な状態のiPS細胞から心筋細胞への分化誘導を行うことで,発現する糖鎖は心筋細胞へ近づくことが示され,iPS細胞由来心筋細胞特有の糖鎖発現も認められた18)19).また,他家移植における免疫原性を減じる方法として, MHC ホモ iPS 細胞を用いたMHC一致移植が考えられるが,ヒトと同様のMHC遺伝子構造をもつカニクイザルを用いた検討により,MHC一致移植では拒絶反応を減じることができる可能性が示された20).その一方で,同様のカニクイザルを用いた虚血心筋症モデルへのiPS細胞由来心筋細胞移植において,MHC一致移植では細胞生着の延長が認められたが,MHC不一致移植と比べて心収縮能改善効果については有意な差が認められなかった21).これらの検討から,臨床応用の際にはHLA一致は必須ではなく,また治療効果が得られるメカニズムに関しても,必ずしも長期の細胞生着が必要という訳ではなく,一定期間の免疫抑制剤投与により治療効果が得られることが予測された.
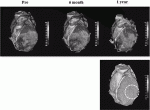
これらの前臨床試験を基に,われわれは2019年から虚血性心筋症に対するiPS細胞由来心筋細胞移植の医師主導治験(臨床研究実施計画番号 jRCT2053190081)を開始している.現在前半の3症例への移植,移植後1年間の観察期間が終了し,安全性が外部評価委員に承認され,後半5症例について多施設での移植試験が開始されている.最初の1症例について詳細な検討が行われ(図1),安全性の確認と,iPS細胞を移植した左心室での収縮能の改善が観察された(図2)ことから,治療効果への期待が寄せられている22).

V.脂肪幹細胞スプレー法
脂肪由来幹細胞については,これまでに虚血性心疾患に対する細胞移植における治療効果が示されてきた23).これまでに検討されてきた細胞投与方法として,静脈内投与,冠動脈投与,心筋注射などがあったが,いずれの方法も一定の治療効果を有するものの,投与経路による治療効果の違いが指摘されてきた24).われわれは,通常の心臓外科手術で用いるフィブリン糊に細胞を混注して噴霧する細胞スプレー法を独自に開発し,虚血性心筋症に対して治療効果が得られることを示した25).細胞スプレー法により投与された脂肪幹細胞は,虚血性心筋症心において,血管新生,血流改善から収縮能の改善をもたらすと共に,手術室で調整可能な方法として,汎用性の観点からも臨床応用へつながる方法と考えられた.
その後われわれは,開発した脂肪由来幹細胞スプレー法を,虚血性心筋症に対する冠動脈バイパス術と同時に行うことで,その安全性,有効性を検討する医師主導治験(臨床研究実施計画番号 jRCT2053190103)を2019年から開始し,6例(被験製品投与群:3例,対照製品投与群:3例)への投与,観察期間を終えている.今後,この方法の安全性,有効性に関して詳細な検討を加える予定となっている.
VI.おわりに
われわれ大阪大学心臓血管外科では,臨床現場で日々遭遇する,現行治療では救命できない患者に対して,様々な方向性から新規治療方法の開発を行ってきた.特に細胞移植に関しては,手術により細胞移植を行うことができる外科学講座として,新規治療方法の制度作りを行う政府や地方公共団体等,最終的に臨床現場に製品を届ける企業と連携し一貫した開発を行うことで,一定の成果を挙げることができたと考えている.
今後,われわれが開発してきた新規治療が真に普及する医療として受け入れられるためには,更なる開発を続けるとともに,これまでに行ってきた臨床応用から得られた知見を,基礎研究の手法で検討する,いわゆるリバース・トランスレーショナル・リサーチにも注力し,常に科学的根拠に基づいた医療を行っていくことが重要と考えられる.
利益相反:なし
文献
1) Menasché P, Alfieri O, Janssens S, et al.: The Myoblast Autologous Grafting in Ischemic Cardiomyopathy (MAGIC) trial: first randomized placebo-controlled study of myoblast transplantation. Circulation, 117(9): 1189-1200, 2008.
2) Patel AN, Henry TD, Quyyumi AA, et al.: Ixmyelocel-T for patients with ischaemic heart failure: a prospective randomised double-blind trial. Lancet, 387(10036): 2412-2421, 2016.
3) Menasché P, Vanneaux V, Hagège A, et al.: Transplantation of Human Embryonic Stem Cell-Derived Cardiovascular Progenitors for Severe Ischemic Left Ventricular Dysfunction. J Am Coll Cardiol, 71(4): 429-438, 2018.
4) Okano T, Yamada N, Sakai H, et al.: A novel recovery system for cultured cells using plasma-treated polystyrene dishes grafted with poly(N-isopropylacrylamide). J Biomed Mater Res, 27(10): 1243-1251, 1993.
5) Shimizu T, Yamato M, Kikuchi A, et al.: Two-dimensional manipulation of cardiac myocyte sheets utilizing temperature-responsive culture dishes augments the pulsatile amplitude. Tissue Eng, 7(2): 141-151, 2001.
6) Miyagawa S, Sawa Y, Sakakida S, et al.: Tissue cardiomyoplasty using bioengineered contractile cardiomyocyte sheets to repair damaged myocardium: their integration with recipient myocardium. Transplantation, 80(11): 1586-1595, 2005.
7) Memon IA, Sawa Y, Fukushima N, et al.: Repair of impaired myocardium by means of implantation of engineered autologous myoblast sheets. J Thorac Cardiovasc Surg, 130(5): 1333-1341. 2005.
8) Kondoh H, Sawa Y, Fukushima N, et al.: Reorganization of cytoskeletal proteins and prolonged life expectancy caused by hepatocyte growth factor in a hamster model of late-phase dilated cardiomyopathy. J Thorac Cardiovasc Surg, 130(2): 295-302, 2005.
9) Hata H, Matsumiya G, Miyagawa S, et al.: Grafted skeletal myoblast sheets attenuate myocardial remodeling in pacing-induced canine heart failure model. J Thorac Cardiovasc Surg, 132(4): 918-924, 2006.
10) Yoshikawa Y, Miyagawa S, Toda K, et al.: Myocardial regenerative therapy using a scaffold-free skeletal-muscle-derived cell sheet in patients with dilated cardiomyopathy even under a left ventricular assist device: a safety and feasibility study. Surg Today, 48(2): 200-210, 2018.
11) Miyagawa S, Domae K, Yoshikawa Y, et al.: Phase I Clinical Trial of Autologous Stem Cell-Sheet Transplantation Therapy for Treating Cardiomyopathy. J Am Heart Assoc, 6(4): e003918, 2017.
12) Kainuma S, Miyagawa S, Toda K, et al.: Long-term outcomes of autologous skeletal myoblast cell-sheet transplantation for end-stage ischemic cardiomyopathy. Mol Ther, 29(4): 1425-1438, 2021.
13) Sawa Y, Yoshikawa Y, Toda K, et al.: Safety and Efficacy of Autologous Skeletal Myoblast Sheets (TCD-51073) for the Treatment of Severe Chronic Heart Failure Due to Ischemic Heart Disease. Circ J, 79(5): 991-999, 2015.
14) Yu T, Miyagawa S, Miki K, et al.: In vivo differentiation of induced pluripotent stem cell-derived cardiomyocytes. Circ J, 77(5): 1297-1306, 2013.
15) Kawamura M, Miyagawa S, Miki K, et al.: Feasibility, safety, and therapeutic efficacy of human induced pluripotent stem cell-derived cardiomyocyte sheets in a porcine ischemic cardiomyopathy model. Circulation, 126(11 Suppl 1):S29-S37, 2012.
16) Ishida M, Miyagawa S, Saito A, et al.: Transplantation of Human-induced Pluripotent Stem Cell-derived Cardiomyocytes Is Superior to Somatic Stem Cell Therapy for Restoring Cardiac Function and Oxygen Consumption in a Porcine Model of Myocardial Infarction. Transplantation, 103(2): 291-298, 2019.
17) Higuchi T, Miyagawa S, Pearson JT, et al.: Functional and Electrical Integration of Induced Pluripotent Stem Cell-Derived Cardiomyocytes in a Myocardial Infarction Rat Heart. Cell Transplant, 24(12): 2479-2489, 2015.
18) Kawamura T, Miyagawa S, Fukushima S, et al.: N-glycans: phenotypic homology and structural differences between myocardial cells and induced pluripotent stem cell-derived cardiomyocytes. PloS one, 9(10):e111064, 2014.
19) Kawamura T, Miyagawa S, Fukushima S, et al.: Structural Changes in N-Glycans on Induced Pluripotent Stem Cells Differentiating Toward Cardiomyocytes. Stem Cells Transl Med, 4(11): 1258-1264. 2015.
20) Kawamura T, Miyagawa S, Fukushima S, et al.: Cardiomyocytes Derived from MHC-Homozygous Induced Pluripotent Stem Cells Exhibit Reduced Allogeneic Immunogenicity in MHC-Matched Non-human Primates. Stem Cell Reports, 6(3): 312-320, 2016.
21) Kashiyama N, Miyagawa S, Fukushima S, et al.: MHC-mismatched Allotransplantation of Induced Pluripotent Stem Cell-derived Cardiomyocyte Sheets to Improve Cardiac Function in a Primate Ischemic Cardiomyopathy Model. Transplantation, 103(8): 1582-1590, 2019.
22) Miyagawa S, Kainuma S, Kawamura T, et al.: Case report: Transplantation of human induced pluripotent stem cell-derived cardiomyocyte patches for ischemic cardiomyopathy. Front Cardiovasc Med, 9: 950829, 2022.
23) Bobi J, Solanes N, Fernández-Jiménez R, et al.: Intracoronary Administration of Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells Improves Myocardial Perfusion But Not Left Ventricle Function, in a Translational Model of Acute Myocardial Infarction. J Am Heart Assoc, 6(5):e005771, 2017.
24) Kanelidis AJ, Premer C, Lopez J, et al.: Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circ Res, 120(7): 1139-1150, 2017.
25) Mori D, Miyagawa S, Yajima S, et al.: Cell Spray Transplantation of Adipose-derived Mesenchymal Stem Cell Recovers Ischemic Cardiomyopathy in a Porcine Model. Transplantation, 102(12): 2012-2024, 2018.
PDFを閲覧するためには Adobe Reader が必要です。