日外会誌. 124(6): 492-499, 2023
特集
先天性嚢胞性肺疾患のup to date
5.外科治療1.新生児・乳幼児における肺区域切除術の適応と現況
|
大阪母子医療センター 小児外科 臼井 規朗 |
発症機序に基づいた新しい疾患概念で先天性嚢胞性肺疾患を分類し,疾患に応じて適応を定めれば,肺区域切除術は新生児や乳幼児に対しても有用と考えられる.本稿では,肺区域切除術が適応となる疾患や病態について考察し,適応疾患の概説に加えて肺区域切除の現況について記述する.
肺区域切除術が適応となる嚢胞性肺疾患は,病変の範囲と境界が明確で,正常気管支との間に交通を持たない気管支閉鎖症や比較的病変の小さな肺葉内肺分画症と考えられる.また,異なる肺葉に病変が複数存在する場合は,肺全摘を回避して肺実質を可及的に残すことを目的に肺区域切除術が選択される.年齢的には残存肺の代償性発育が望めない年長児にとって肺区域切除術は良い適応であるが,新生児でも過膨脹した病変を有する症例や,乳幼児における無症候性の先天性嚢胞性肺疾患では,区域切除術や部分切除術が適応となる.
気管支閉鎖症は胎児期に形成された気管支がなんらかの原因で区域・亜区域レベルで閉鎖して生じる形成異常であるが,従来CPAM2型と診断されてきた症例の多くは気管支閉鎖が原因であることが明らかになってきた.また,過剰な肺芽から発生した分画肺が正常肺と同一の胸膜内に存在する肺葉内肺分画症は,病変が小さければ区域切除でも切除できる.
現在,小児の先天性嚢胞性肺疾患の10〜25%に対しては,区域切除または部分切除が行われており,術後の気胸発症や病変の遺残・再発が課題であるものの,手術手技の安全性や実施可能性は確立されている.
キーワード
先天性嚢胞性肺疾患, 区域切除術, 肺葉切除術, 気管支閉鎖症, 肺分画症
I.はじめに
小児の先天性嚢胞性肺疾患に関する診療ガイドラインが2022年に策定された1)2).診療ガイドラインでは,肺切除術は乳児期に行うことが推奨されているものの,術式に関するクリニカル・クエスチョン(CQ)では,肺葉切除術と肺区域切除術のいずれを行うべきかについての結論が出されていない1)2).
本稿では,発症機序に基づいた新しい疾患概念を取り入れた嚢胞性肺疾患の分類(表1)1)3)を念頭に,小児の先天性嚢胞性肺疾患に対する肺区域切除術の適応と現況について,文献的考察に基づいて概説する.

II.診療ガイドライン
2022年に策定された先天性嚢胞性肺疾患診療ガイドラインでは「区域切除は有用か?」というCQ7が設けられている.このCQ7に対する推奨文は「先天性嚢胞性肺疾患に対する手術として,肺葉切除と区域肺切除のいずれを行うべきかに関しては,現時点でどちらか一方の推奨はできない」と記述されており,推奨度は「推奨なし」, エビデンスレベルは「D」である.解説文には,最終的にレビューに値する論文は5編4)
~
8)のみで,胸腔鏡でも解剖学的区域切除が可能であり,合併症も肺葉切除術と変わらないという益の評価4)5)と,肺葉切除術に比べて区域切除では,気胸,感染再発,病変遺残,病変再発が多いという害の評価6)
~
8)のが両方あったと記載されている.すなわち,肺区域切除術は手技的には実施可能であるが,病変の遺残や再発の点で懸念が残り,エビデンスレベルでも差がつけられなかったと結論づけている1).
しかし,CQ7に対するレビューの対象となった五つの論文4)
~
8)では,切除対象である病変をCCAMや先天性嚢胞性肺疾患,先天性肺形成異常などと,本来複数混在する疾患をひとまとめにして解析しており,発症機序に基づいた新しい疾患概念を取り入れた嚢胞性肺疾患の分類(表1)1)3)に従って,疾患別に適応や合併症が検討されているわけではない.また,小児の肺胞は2歳頃までに急激に増殖し,8歳ごろまで緩やかに増殖が持続すると考えられており9),年長児より乳幼児の方が肺切除後の残存肺に代償性の成長が期待できる5)10)が,五つの論文では対象の年齢が幅広く,手術時の年齢的要素が考慮されているわけではない.

III.肺区域切除術が適応となる疾患
発症機序に基づいた嚢胞性肺疾患の分類(表1)1)3)では,先天性の嚢胞性病変は気管支閉鎖症や乳児肺葉性肺気腫を含む気管支閉塞群,先天性肺気道奇形(CPAM),肺葉内肺分画症や肺葉外肺分画症を含む肺分画症群,気管支原性嚢胞や食道重複嚢胞などを含む前腸重複嚢胞群などに分類されている1)3).疾患毎に発症機序が異なるため,病変と肺区域や気管支樹との関係性も異なってくる.気管支閉塞群の疾患では,胎児期に気管支樹が形成されたのちに,多くは区域気管支や亜区域気管支に二次的な閉鎖や狭窄が生じる11)ため,病変の範囲は解剖学的な肺区域や亜区域に一致すると考えられる.過剰な副肺芽から発生すると考えられている肺分画症1)3)のうち,一つの肺葉の臓側胸膜内に存在する肺葉内肺分画症は,比較的狭い範囲の肺区域内に病変が留まる場合もある.これに対してCPAMの病変は,気管支閉塞群や肺分画症群の疾患に比べて病変が大きく,狭い区域内に留まらない場合が多い12)13).またCPAMの嚢胞は,多くの場合正常肺の気道系との交通が認められる12)13).したがって,術後の気胸の発症や病変の遺残を考慮すると,CPAMでは肺葉切除を行う事が望ましいと考えられる12)13).一方,気管支閉鎖症や比較的病変が小さい肺葉内肺分画症では,肺区域切除術や肺部分切除術が適応になると考えられる12)14).

IV.肺区域切除術が適応となる病態
CPAMなど病変の広がりが広範囲にわたる先天性嚢胞性肺疾患では,肺葉が分葉不全を呈する場合や,病変が複数肺葉に跨がる場合がある.また,気管支閉鎖症でも異なる肺葉に病変が複数存在する場合もある(図1).診療ガイドライン1)2)では「複数肺葉の罹患症例に対して肺全摘は推奨されるか?」というCQ8が設けられている.これに対する推奨文には「複数肺葉が罹患している場合においても,手術治療として肺全摘を可及的に避けることを提案する.」と記載されている.病変が複数肺葉に跨がっていて,主病変を肺葉切除術によって摘出した場合は,肺全摘になることを避けるために他の肺葉に存在する病変は区域切除あるいは部分切除に留め,できるだけ肺実質を温存することを優先させる.その場合,病変の取り残しを極力避ける一方で,一部の病変を意図的に遺残させざるを得ない場合もあると考えられる12).
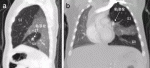
V.肺区域切除術が適応となる年齢
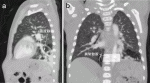
小児の肺は出生後も発育を続け,出生時に2,400万個程度であった肺胞数は,成人では3~6億個にまで増加するといわれている15).その増殖のペースは,2歳頃までは急激で,その後8歳ごろまで緩やかに持続すると考えられている9).このことから,新生児期や乳児期に肺切除術を行っても,残存した肺の実質はのちに代償性に成長することが期待できる5)10).一方,成人や年長児(図2)では,術後に残存肺の成長が期待できないため,呼吸機能を維持するためには肺実質を可能な限り残す肺区域切除や部分切除が望ましい.新生児期に手術を要する症例は,なんらかの呼吸器症状を発症していると考えられ,多くはCPAMあるいは血流の多い異常動脈を有する病変の大きな肺分画症である12).したがって,新生児期に肺区域切除術が適応になる症例は少ないと思われるが,例えば左肺上葉B1+2,B3の気管支閉鎖で,病変部が過膨脹を来しているような症例では左肺上区域(S1+2,3)切除術が適応になる.乳幼児期に手術対象となる先天性嚢胞性肺疾患の多くは,新生児期には無症状の気管支閉鎖症や肺葉内肺分画症であるため,肺区域切除術や部分切除術の適応を考慮してよい.
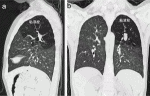
VI.気管支閉鎖症
気管支閉鎖症は,胎児期に形成された気管支がなんらかの原因16)によって区域気管支や亜区域気管支レベルで閉鎖して生じる形成異常である11).閉塞部より末梢の肺は気管支樹から孤立しているが,隣接した肺区域からKohn孔を通じた側副換気を受けるため含気を生じ,排出すべき気管支が閉塞していることによって気腫状に拡張する11).病変部の気管支内で産生された粘液は,中枢側の気管支盲端に集積されて粘液栓(mucus plug, mucoid impaction)を生じる.閉鎖する気管支のレベルは,多くの場合区域気管支や亜区域気管支であるが,稀に葉気管支(図3)14)や主気管支17)が閉鎖している場合もあり,この場合の病変部は側副換気を受けないため無気肺を呈する.
気管支閉鎖症の中には,末梢側の孤立した病変内に径20mm以下の比較的小さな嚢胞を多数伴う症例がある(図4).これらの嚢胞は胎児期から認められ,胎児期に生じた気管支閉塞による肺組織の二次的な変化と考えられる11).気管支閉鎖症の中に,なぜ嚢胞を伴わず気腫性病変のみの症例と,多数の嚢胞を伴う症例が存在するのかは明らかでないが,気道閉塞が生じた胎児期の肺の発生段階15)が異なっているためではないかと推測している.多数の嚢胞を伴う症例では,CPAM2型との異同が問題となるが,従来CPAM2型と診断されてきた症例の多くは,気管支閉鎖や炎症に伴う二次的な組織変化と考えられている11).
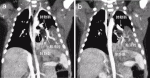
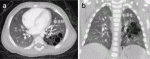
VII.肺葉内肺分画症
正常の肺芽とは異なる過剰な肺芽から発生し,正常気管支と直接交通しない気管支構造を持つ肺組織,すなわち分画肺を有する疾患を肺分画症という.分画肺には,体循環の動脈から分岐した弾性動脈からなる異常動脈を通じて血流が流入し,異常動脈流入部付近に偽肺門が形成されて,同部を起始部とした気管支樹が形成されている.肺葉内肺分画症は,分画肺が正常肺と同一の胸膜内に存在するものをいい,還流静脈の多くが肺静脈に流入している.また肺葉内肺分画症は,気管支閉鎖症と同様に隣接した肺区域から側副換気を受けて気腫状となり,しばしば病変内には大小多数の嚢胞が形成されている(図5).
肺葉内肺分画症の治療の基本は外科的切除である.区域切除術では切除が不完全に終わる可能性があるために,原則として肺葉切除術が行われる18)19)が,病変のサイズが比較的小さければ,病変の広がりと正常肺との境界を正確に把握したうえで区域切除術や部分切除術も行われている20).
VIII.肺区域切除術の現況
Wagenaarら10)は北米のデータベースを解析し,1997~2009年に行われた小児の嚢胞性肺疾患に対する手術1,383例のうち,肺区域切除が382例(27.6%)に対して行われていたことを報告したが,解析対象例の66%は1歳未満の症例であった10).また,Kulaylat ら21)はNSQIP-Pのデータを解析し,2012~2013年に行われた小児の嚢胞性肺疾患に対する手術258例のうち,207例(80.2%)が1歳未満で行われ,うち28例(10.9%)に肺区域切除が行われていたことを報告した21).Moriniら22)は欧州小児外科学会に所属する181人の会員に対して,2018年に小児のCPAMに対する治療に関するアンケート調査を実施した.回答者の75%は無症候性のCPAMに対しても手術を行うと回答し,58%が肺葉切除を,25%が肺区域切除を,17%が非定型的な肺切除を行うと回答している22).
肺区域切除術は成人の呼吸器外科領域では確立された手術手技である.しかし小児の場合,主たる対象疾患が先天性嚢胞性肺疾患であることに加え,血管を始めとして臓器自体が小さいために手術の難易度は高くなる.にも関わらず,手術手技としては安全に実施可能という意見が多数を占めた4)
~
6)23)24).報告では,切離に際してLigaSureTMや内視鏡手術用の自動縫合器が利用されていた4)5)23)24).Rothenbergら4)は,23例中22例に解剖学的区域切除を施行しているが,胸腔鏡下で拡大視野が得られるため,区域の解剖が同定し易くなり,より安全に剥離や切除が行えたと述べている.Johnsonら5)は,15例に対して胸腔鏡下に肺区域切除を行っているが,そのほとんどの症例で肉眼的,あるいは放射線画像上の境界に沿って,非解剖学的な境界で切離したと述べている.Bagrodiaら23)は,肺葉切除の26例と肺区域切除の19例を比較し,肺区域切除の方が入院期間が短かったと述べている.また,Fascetti-Leonら24)は,81例の手術中54例に対して非定型的な肺切除(50例)または解剖学的肺区域切除(4例)を行い,うち4例で術後の気胸を発症し,1例で病変の遺残を認めて再手術を要したが,合併症の発症頻度は従来の肺葉切除と差がなかったと述べている.
肺区域切除術後の合併症としては,気胸や病変の遺残・再発が問題となる.術後合併症の発症率は肺葉切除術と差がないとする報告がある4)5)23)24)一方で,区域切除術の方が合併症の発症率が高いとする報告7)8)もある.Khosaら7)は47例の手術のうち,42例に肺葉切除を行い,4例に肺区域切除を行ったが,肺区域切除の4例中3例で病変の遺残を生じて再発を来したと報告している7).
これらの研究は,いずれも対象疾患が先天性嚢胞性肺疾患としてひとまとめで解析されている.もし,発症機序に基づいた新しい疾患概念で先天性嚢胞性肺疾患を区別して,疾患毎に肺区域切除術の適応が考えられるようになれば,術後の気胸や病変遺残の発症頻度はさらに減少するのではないかと思われた.
IX.おわりに
先天性嚢胞性肺疾患診療ガイドラインでは肺区域切除が有用かどうかの結論は出ていないが,発症機序に基づいた新しい疾患概念で対象疾患を選別し,適切に適応を定めることで,今後新生児・乳幼児における先天性嚢胞性肺疾患に対する肺区域切除術の有用性が示されるものと期待している.
利益相反:なし
文献
1) 黒田 達夫,渕本 康史,野澤 久美子,他: 先天性嚢胞性肺疾患診療ガイドライン. 厚生労働科学研究費補助金難治性疾患政策研究事業「呼吸器系先天異常疾患の診療体制構築とデータベースおよび診療ガイドラインに基づいた医療水準向上に関する研究」令和四年度総括・分担研究報告書(研究代表者:臼井規朗),pp86-121, 2023.
2) 黒田 達夫,渕本 康史,野澤 久美子,他: 先天性嚢胞性肺疾患診療ガイドライン作成にあたって. 小児外科, 54: 112-115, 2022.
3) 松岡 健太郎: 分類と病理所見. 小児外科, 54: 120-124, 2022.
4) Rothenberg SS, Shipman K, Kay S, et al.: Thoracoscopic segmentectomy for congenital and acquired pulmonary disease: A case for lung-sparing surgery. J Laparoendosc Adv Surg Tech A, 24: 50-54, 2014.
5) Johnson SM, Grace N, Edwards MJ, et al.: Thoracoscopic segmentectomy for treatment of congenital lung malformations. J Pediatr Surg, 46: 2265-2269, 2011.
6) Kim HK, Choi YS, Kim K, et al.: Treatment of congenital cystic adenomatoid malformation: Should lobectomy always be performed? Ann Thorac Surg, 86: 249-253, 2008.
7) Khosa JK, Leong SL, Borzi PA: Congenital cystic adenomatoid malformation of the lung: Indications and timing of surgery. Pediatr Surg Int, 20: 505-508, 2004.
8) Lujan M, Bosque M, Mirapeix RM, et al.: Late-onset congenital cystic adenomatoid malformation of the lung. Embryology, clinical symptomatology, diagnostic procedures, therapeutic approach and clinical follow-up. Respiration, 69: 148-154, 2002.
9) Merkus PJ, ten Have-Opbroek AA, Quanjer PH: Human Lung Growth: A Review. Pediatr Pulmonol, 21: 383-397, 1996.
10) Wagenaar AE, Tashiro J, Satahoo SS, et al.: Resection of pediatric lung malformations: National trends in resource utilization & outcomes. J Pediatr Surg, 51: 1414-1420, 2016.
11) 高桑 恵美,中澤 温子: 気管支閉鎖症とCPAM2型の病理所見. 小児外科, 54: 125-128, 2022.
12) 臼井 規朗:新生児・乳児の嚢胞性肺疾患. 日周産期・新生児医会誌, 57: 409-421, 2021.
13) Usui N: Surgical treatment for and prognosis of congenital pulmonary airway malformation. Sago H, Okuyama H, Kanamori Y, eds. Congenital cystic lung disease. Singapore: Springer Nature, pp63-71, 2020.
14) Okuyama H: Surgical treatment for bronchial obstruction. Sago H, Okuyama H, Kanamori Y, eds. Congenital cystic lung disease. Singapore: Springer Nature, pp73-78, 2020.
15) 田中 水緒: 肺の発生と病理. 小児外科, 54: 116-119, 2022.
16) 下高原 昭廣,下島 直樹,廣部 誠一:気管支閉鎖症の発生機序が示唆された症例-気管支と肺動静脈の位置異常など-. 小児外科, 54: 129-133, 2022.
17) Zamora IJ, Sheikh F, Olutoye OO, et al.: Mainstem bronchial atresia: A lethal anomaly amenable to fetal surgical treatment. J Pediatr Surg, 49: 706-711, 2014.
18) Kanamori Y: Intralobar pulmonary sequestraaion. Sago H, Okuyama H, Kanamori Y, eds. Congenital cystic lung disease. Singapore: Springer Nature, pp79-86, 2020.
19) Liechty KW, Flake AW: Pulmonary vascular malformations. Semin in Pediatr Surg, 17: 9-16, 2008.
20) Yamanashi K, Okumura N, Nakazono C, et al.: Surgery for intralobar pulmonary sequestration using indocyanine green fluorescence navigation: A case report. Semin Thorac Cardiovasc Surg, 30: 122-124, 2018.
21) Kulaylat AN, Engbrecht BW, Hollenbeak CS, et al.: Comparing 30-day outcomes between thoracoscopic and open approaches for resection of pediatric congenital lung malformations: Evidence from NSQIP. J Pediatr Surg, 50: 1716-1721, 2015.
22) Morini F, Zani A, Conforti A, et al.: Current management of congenital pulmonary airway malformations: A “European Pediatric Surgeons’ Association” Survey. Eur J Pediatr Surg, 28: 1-5, 2018.
23) Bagrodia N, Cassel S, Liao J, et al.: Segmental resection for the treatment of congenital pulmonary malformations. J Pediatr Surg, 49: 905-909, 2014.
24) Fascetti-Leon F, Gobbi D, Pavia SV, et al.: Sparing-lung surgery for the treatment of congenital lung malformations. J Pediatr Surg, 48: 1476-1480, 2013.
PDFを閲覧するためには Adobe Reader が必要です。