日外会誌. 123(1): 80-82, 2022
定期学術集会特別企画記録
第121回日本外科学会定期学術集会
特別企画(7)「≪外科学再興特別企画≫癌に対する免疫治療New Era」
1.がん微小環境内のマクロファージ,好中球を癌の治療標的として解析する
|
1) 岡山大学大学院 消化器外科学 香川 俊輔1)2) , 吉本 匡志1) , 伊藤 雅典1) , 梶岡 裕樹1) , 坂本 修一1) , 桒田 和也1) , 吉田 龍一1) , 野間 和広1) , 楳田 祐三1) , 菊地 覚次1)2) , 黒田 新士1) , 矢野 修也1) , 重安 邦俊1)2) , 寺石 文則1)2) , 田澤 大1) , 藤原 俊義1) (2021年4月10日受付) |
キーワード
腫瘍微小環境, マクロファージ, 好中球, 胃癌, 膵癌
I.はじめに
固形がんを顕微鏡的視点から見るとがん細胞が多彩な細胞と共存している.その中でがん細胞は免疫細胞等の周囲の細胞と絶えず相互に作用し,その結果増殖したり,排除されたり,また浸潤,転移したりして動的な環境にあるとされる.われわれはがん微小環境に着目しがん細胞とマクロファージ,好中球との関係について解析することで,それらががん治療での標的になりうるか検討している.
II.腹膜播種と腫瘍関連マクロファージ
がん微小環境内のマクロファージは腫瘍関連マクロファージ(TAM)と称され,M2型マクロファージががん促進に作用することが明らかとなってきている.腹膜播種をきたす膵癌,胃癌の腹腔内での細胞成分を解析したところ,がん細胞と共存する場合にはM2様形質を示すマクロファージが多く存在していた.マクロファージと胃癌,膵癌細胞の共培養下ではがん細胞が上皮間葉移行を示し,浸潤能,遊走能が助長され,抗がん剤にも抵抗性を増すことが観察された1)2).さらにTAMからはIL-6が分泌されており,担癌患者の腹腔内でもIL-6が有意に高い濃度を示し,IL-6ががん細胞の悪性形質を増進することから,腹膜播種形成へのIL-6の関与が示唆された2).
III.癌由来の細胞外小胞体とマクロファージ分化
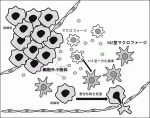
がんとの共存下でマクロファージがM2型優位に分化しているのは何故か.Exosomeと呼ばれる各種細胞から放出される細胞外小胞体が細胞間コミュニケーションを担っていることから,胃癌細胞からの細胞外小胞体のマクロファージ分化への関与について検討した.胃癌由来の細胞外小胞体をマクロファージに作用させると,M2型への分化が誘導されることが観察された.TAMが分化する過程の中で細胞外小胞体が作用していることががん微小環境形成の要因の一つと考えられた(図1)3).
IV.好中球によるNeutrophil extracellular trapsと癌転移
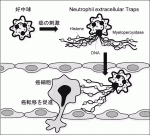
好中球はがん微小環境下で,自らの核酸を網状に細胞外に放出するNeutrophil extracellular traps(NET)という現象を起こし,NETががん転移を促進していることが近年明らかとなってきた.われわれの解析でも膵癌細胞の培養上清は好中球にNETを起こし,NETは膵癌細胞の悪性形質を高めた.外科侵襲を模した肝臓の阻血再灌流によってNETが誘導されるマウスモデルを用いたところ,NET形成下では膵癌細胞の脾臓注入による肝転移を著しく助長させることが観察された.一方でNET形成にHMGB1の関与があることから,それを抑制する作用をもつリコンビナントのthrombomodulinをマウスに投与したところ,同様のモデルにおいても肝転移が顕著に抑制された4).高度な外科侵襲下では好中球のNET形成により転移形成が促進される環境にあると推察されるが,未解明の部分も多く,さらなる機序の解明が求められている(図2).
V.おわりに
TAMによるがん細胞の悪性形質の助長には液性因子が関わっていることから,それらの抑制ががん治療に応用できる可能性が示唆された.また外科侵襲下ではNETが誘導され,腫瘍促進に作用すること,そこにはHMGB1の関与が確認され,抗HMGB1作用を有するthrombomodulinはNETs形成下での抗転移効果が観察された.がん微小環境におけるマクロファージや好中球の機能解明を通して,新たな免疫療法の開発に繋いでいきたい.
利益相反:なし
文献
1) Kuwada K, Kagawa S, Yoshida R, et al.: The epithelial-to-mesenchymal transition induced by tumor-associated macrophages confers chemoresistance in peritoneally disseminated pancreatic cancer. J Exp Clin Cancer Res, 37:307, 2018.
2) Sakamoto S, Kagawa S, Kuwada K, et al.: Intraperitoneal cancer-immune microenvironment promotes peritoneal dissemination of gastric cancer. Oncoimmunology, 8:e1671760, 2019.
3) Ito A, Kagawa S, Sakamoto S, et al.: Extracellular vesicles shed from gastric cancer mediate protumor macrophage differentiation. BMC Cancer, 21:102, 2021.
4) Kajioka H, Kagawa S, Ito A, et al.: Targeting neutrophil extracellular traps with thrombomodulin prevents pancreatic cancer metastasis. Cancer Lett, 497:1-13, 2021.
PDFを閲覧するためには Adobe Reader が必要です。