日外会誌. 121(4): 442-447, 2020
特集
食道癌診療の現況と展望
7.集学的治療
|
1) 浜松医科大学 外科学第二講座 菊池 寛利1) , 平松 良浩2) , 神谷 欣志1) , 竹内 裕也1) |
食道癌は予後不良な疾患であり,特に進行癌では手術単独による治療成績は十分でない.本邦における食道癌は扁平上皮癌(SCC)が多く,化学療法や放射線療法に対する感受性が高いこともあり,根治的化学放射線療法,術後補助化学療法や術前補助療法などの集学的治療の構築が特に重要である.cStageⅠ食道癌に対する治療の第一選択肢は手術であるが,JCOG0502試験の結果から,根治的化学放射線療法が標準治療の一つとなった.cStageⅡ~Ⅲ食道癌に対してはJCOG9907試験の結果から,術前補助化学療法+手術が治療の第一選択肢である.一方,可能な限り食道温存を希望するcStageⅡ~Ⅲ食道癌患者に対しては,JCOG0909試験の結果から,照射線量50.4Gyの根治的化学放射線療法と救済治療を組み合わせた戦略が治療選択肢の一つとなる.cStageⅣa食道SCCに対する治療方針は,performance statusが良好であれば化学放射線療法または化学療法(+救済手術)が選択される.今後免疫チェック阻害薬が食道癌に対する新たな治療法の一つとなることにより,食道癌に対する集学的治療が新たな段階を迎え,更なる治療成績の向上が期待される.
キーワード
食道切除術, 化学療法, 放射線療法, 免疫チェック阻害
I.はじめに
本邦における食道癌は約90%がSCCであるのに対し,北米や西欧では70%以上が下部食道や食道胃接合部に生じる腺癌である.一般的に腺癌に比べSCCの方が化学療法や放射線療法に対する感受性が高く,本邦と欧米では食道癌の治療方針に大きな違いがある.本項では,本邦で多いSCCを中心に,切除可能食道癌に対する根治的化学放射線療法,術後補助化学療法や術前補助療法,切除不能例や再発例に対する化学放射線療法などの集学的治療のエビデンスと診療ガイドラインに沿った標準治療および現在進行中の臨床試験,今後の展望などについて概説する.
II.Stage I食道癌に対する集学的治療
cStageⅠ食道癌に対しては,耐術能がある場合は手術が第一選択となる.一方,耐術能がない症例や手術拒否例などには根治的化学放射線療法または放射線療法が選択される1).
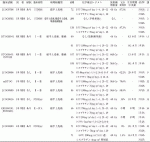
本邦で行われた,cStageⅠ(T1N0M0)食道癌に対する化学放射線療法同時併用療法(シスプラチン/5-FU[FP]+放射線60Gy)の有効性・安全性を検討した第Ⅱ相試験(JCOG9708)で,治療完遂率97.2%,完全奏効率87.5%(95%信頼区間[CI]:77.6~94.1),4年全生存率(OS)80.5%(95%CI:71.3~89.7),4年無増悪生存率(PFS)68.1%(95%CI:57.3~78.8)と良好な成績であった(表1)2).
JCOG9708試験の良好な結果を受けて,cStageⅠ(T1N0M0)食道癌に対する化学放射線療法同時併用療法(FP+放射線60Gy)の手術単独に対する生存における非劣性を検証する第Ⅲ相試験(JCOG0502)が行われた.本試験では,無作為化の同意が得られた症例を食道切除術(A群)と根治的化学放射線療法(B群)に無作為割り付けし,無作為化の同意が得られなかった症例は食道切除術(C群)と根治的化学放射線療法(D群)に研究者判断で登録を行ったが,残念ながら無作為化部分は症例集積不十分のため終了となり,主要評価項目である無作為化部分のOSは評価困難であった.副次評価項目である非無作為化部分の3年OS中央値は,C群:94.7%(95%CI:90.6~97.0),D群:93.1%(95%CI:87.9~96.1)で,5年OS中央値はC群:86.5%(95%CI:81.0~90.5),D群:85.5%(95%CI:78.9~90.1)であり,調整済みハザード比(HR)1.052(95%CI:0.674~1.640)と,手術単独に対する化学放射線療法の非劣性が示された(表1)3).また,化学放射線療法は安全に施行可能であり,完全奏効率は87.3%(95%CI:81.1~92.1)でJCOG9708試験と同等であった2)3).一方,化学放射線療法群の57例(35.8%)で後治療が施行されており,このうち21例に外科治療,16例に内視鏡的切除術が行われている3).JCOG0502試験の結果から,cStageⅠ食道癌に対する根治的化学放射線療法は標準治療の一つとなったが,救済手術を含めた集学的治療の構築が重要である.また,初回治療として手術と根治的化学放射線療法の選択をどの様に行うべきかなど,今後更なる検討が必要である.
一方,米国のN0-1 M0食道癌(SCCまたは腺癌)を対象として,放射線単独に対する化学放射線療法の優越性を検討したランダム化第Ⅲ相比較試験(RTOG85-01)において,5年OSは放射線療法単独の0%に対し化学放射線療法で26%(95%CI:15~37)と有意に良好(P<0.001)であったが(表1),Grade 3以上の有害事象が放射線療法単独にくらべて化学放射線療法で多かった4)5).耐術能のない高齢者や臓器機能低下症例などでは放射線療法単独が治療の選択肢となる1).
III.StageⅡ~Ⅲ食道癌に対する集学的治療
cStageⅡ~Ⅲ食道癌に対する治療の第一選択肢は術前補助化学療法+手術であるが,耐術能がない症例や手術拒否例などには根治的化学放射線療法または放射線療法が選択される.また,cStageⅠに対して手術を行った結果pStageⅡ~Ⅲと診断された場合や,cStageⅡ~Ⅲに術前治療なく手術を行い病理組織結果でリンパ節転移陽性であった場合には,術後補助化学療法を行うことが推奨される1).
1.手術+術後補助療法
胸部食道癌治癒切除後の手術単独に対する,手術+術後補助化学療法(FP 2コース)の優越性を検証したランダム化第Ⅲ相比較試験(JCOG9204)において,5年PFSが手術単独群の45%に対し,手術+術後補助化学療法群で55%と有意に良好であった(HR:0.73,95%CI:0.51~1.03,P=0.037)6).また,リンパ節転移陰性例では両群間に差を認めなかったのに対し,病理学的リンパ節転移陽性例においては,5年PFSが手術単独群の38%に対し,手術+術後補助化学療法群で52%と有意に良好であった(P=0.041).
2.術前補助療法+手術
JCOG9204試験により,特にリンパ節転移陽性例で術後補助化学療法によるPFS延長効果が示されたが,侵襲の大きな手術後における補助化学療法の完遂率の低さなどが問題であった.そこで,cStageⅡ~Ⅲ胸部食道癌に対する補助化学療法を,術前と術後のどちらに施行した方が有効かを検証する,ランダム化第Ⅲ相比較試験(JCOG9907)が行われた.PFSは両群間で有意差を認めなかったが,5年OSは術後補助化学療法群の43%(95%CI:34.6~50.5)に対し,術前補助化学療法群で55%(95%CI:46.7~62.5)と有意に良好であった(HR:0.73,95%CI:0.54~0.99,P=0.04).この結果により,本邦におけるcStageⅡ~Ⅲ胸部食道癌に対する標準治療は術前補助化学療法+手術となった1).
一方,食道SCCを対象として,現在の標準治療である術前FP療法に対する,放射線41.4Gyを併用する術前化学放射線療法およびドセタキセルを追加した3剤併用術前化学療法の優越性を検証するランダム化第Ⅲ相比較試験(JCOG1109,NExT試験)が現在進行中で,症例登録を終了している7).今後の解析結果によっては,化学放射線療法が標準的な術前補助療法となる可能性もある.
3.根治的化学放射線療法
cStageⅡ~Ⅲ食道SCCに対する現在の標準治療である術前補助化学療法+手術と,根治的化学放射線療法を比較したランダム化試験はこれまでにない.そこで,先述したJCOG9907試験における術前補助化学療法+手術群163症例と,根治的化学放射線療法(FP+放射線60Gy)の有効性を検証した第Ⅱ相試験(JCOG9906)における化学放射線療法群73症例のデータを用いて,術前補助化学療法+手術と根治的化学放射線療法を比較する研究(JCOG1406-A)が行われた8)
~
10).解析対象症例の背景因子は両群でほぼ同等であり,全体および全サブグループにおけるOSおよびPFSは,術前補助化学療法+手術群で有意に優れていた10).
米国で行われたcStageⅠ~Ⅲを対象とした臨床試験(RTOG94-05/INT0123)で,FP療法に併用する放射線照射量50.4Gyと64.8Gyが比較され,64.8Gy群で毒性が強かったが生存期間の延長を認めなかった(表1)11).RTOG94-05の50.4Gyレジメンに領域リンパ節への予防的照射を加えたmRTOGレジメンによる第Ⅱ相試験が本邦で行われ,完全奏効率70.6%,3年OS 63.8%と良好な結果が示され(表1),晩期毒性は60Gyを用いたJCOG9906試験よりも軽減された12).これらの結果を受け,mRTOGレジメンと同じ5-FU 1,000mg/m2 1~4,29~32日目とシスプラチン75mg/m2,1,29日目および放射線50.4Gy(1.8Gy/day,週5回)による根治的化学放射線療法に積極的な救済治療を行い,その有効性と安全性を検証する非ランダム化単群試験(JCOG0909)が行われ,完全奏効率58.5%,3年OS 74.2%,と良好な成績であり(表1),3年食道温存生存率も63.6%と比較的良好であった13).晩期毒性はGrade 3が9.6%,Grade 4以上0%とJCOG9906試験よりも明らかに軽微であり13),照射線量50.4Gyの根治的化学放射線療法と救済治療を組み合わせた戦略は,今後可能な限り食道温存を希望するcStageⅡ~Ⅲ食道SCC患者の治療選択肢の一つになり得ると考えられる.

IV.StageⅣ食道癌に対する集学的治療
cStageⅣa食道SCCに対する治療方針は,performance status(PS)良好であれば化学放射線療法または化学療法(+救済手術)が選択される.cStageⅣb食道癌に対しては,PS良好であれば化学療法が治療の中心となるが,通過障害がある場合は緩和的放射線療法も考慮される1).
cT4食道癌に対する化学放射線療法同時併用療法(FP+放射線60Gy)の有用性を検証した第Ⅱ相試験(JCOG9516)では,完全奏効率15%,2年OS 31.5%であった(表1)14).JCOG9516の標準レジメンと低用量FPによる化学放射線療法を比較したランダム化第Ⅲ相試験(JCOG0303)および同様のランダム化第Ⅱ相試験(KROSG0101/JROSG02)が行われたが,二つの比較試験において低用量FP療法のメリットは見いだせなかった(表1)15)16).このため,JCOG9516のシスプラチン70mg/m2,5-FU 700mg/m2が標準レジメンとして用いられることが多い.一方,切除不能局所進行食道癌に対する化学放射線療法後の遺残腫瘍に救済手術を行うことがあるが,術後合併症や手術関連死亡のリスクが高いことが問題である.現在,切除不能局所進行胸部食道SCCに対する根治的化学放射線療法(FP+放射線60Gy)と導入化学療法(ドセタキセル/シスプラチン/5-FU)後のコンバージョン手術を比較するランダム化第Ⅲ相試験(JCOG1510)が進行中である17).

V.術後再発食道癌に対する集学的治療
根治切除後の限局性再発に対する根治を目指した治療として,化学放射線療法が実臨床で広く行われており,有用性を示す報告も比較的多いが,化学療法単独などとの比較を行った前向き臨床試験はない.再発部位や予後,有害事象などを考慮し,十分な説明を行った上で適応を決定すべきである1).
VI.食道癌に対する免疫療法
切除不能進行・再発食道癌の予後は不良であり,治療の選択肢も少ない.このため新たな治療法の開発が長い間望まれ,特に近年では免疫チェック阻害薬の有効性に期待が持たれてきた.
二次治療におけるペンブロリズマブ単剤の化学療法に対する優越性を検証する第Ⅲ相試験(KEYNOTE-181試験)にて,主要評価項目の一つであるCombined Positive Score(CPS)≧10のPD-L1陽性例におけるOSの延長が示された18).
二次治療におけるニボルマブ単剤の化学療法(ドセタキセルまたはパクリタキセル単剤)に対する優越性を検証するオープンラベル無作為化第Ⅲ相試験(ATTRACTION-3試験)が行われ,主要評価項目であるOSの中央値は,化学療法群の8.4カ月に対しニボルマブ群で10.9カ月と有意に良好であった(HR:0.77,95% CI:0.62~0.96,P=0.019)19).また,OSのサブ解析において,PD-L1の発現にかかわらずニボルマブ群で良好な傾向を示し,探索的研究において,化学療法群と比較してニボルマブ群で治療開始後のQOL改善効果を認めた.これらの結果から,ニボルマブ単剤療法は,食道SCCにおける二次治療の標準的治療になると考えられる.
VII.おわりに
特に進行・再発食道癌の治療成績向上のためには,手術,化学療法,放射線療法などによる集学的治療が重要である.免疫チェック阻害薬が食道癌に対する治療法の一つとなることによって,食道癌に対する集学的治療が新たな段階を迎える.今後,予後不良とされる食道癌の治療成績が飛躍的に向上することを期待したい.
利益相反
奨学(奨励)寄附金:小野薬品工業株式会社
文献
1) 特定非営利活動法人日本食道学会編:食道癌診療ガイドライン2017年版.金原出版,東京,2017.
2) Kato H, Sato A, Fukuda H, et al.: A phase II trial of chemoradiotherapy for stage I esophageal squamous cell carcinoma:Japan Clinical Oncology Group Study (JCOG9708). Jpn J Clin Oncol, 39: 638-643, 2009.
3) Kato K, Igaki H, Ito Y, et al.: Parallel-group controlled trial of esophagectomy versus chemoradiotherapy in patients with clinical stage I esophageal carcinoma (JCOG0502). J Clin Oncol, 37: 7, 2019.
4) Herskovic A, Martz K, al-Sarraf M, et al.: Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus. N Engl J Med, 326: 1593-1598, 1992.
5) Cooper JS, Guo MD, Herskovic A, et al.: Chemoradiotherapy of locally advanced esophageal cancer:long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA, 281: 1623-1627, 1999.
6) Ando N, Izuka T, Ide H, et al.: Surgery plus chemotherapy compared with surgery alone for localized squamous cell carcinoma of the thoracic esophagus:a Japan Clinical Oncology Group Study--JCOG9204. J Clin Oncol, 21: 4592-4596, 2003.
7) Nakamura K, Kato K, Igaki H, et al.: Three-arm phase III trial comparing cisplatin plus 5-FU (CF) versus docetaxel, cisplatin plus 5-FU (DCF) versus radiotherapy with CF (CF-RT) as preoperative therapy for locally advanced esophageal cancer (JCOG1109, NExT study). Jpn J Clin Oncol, 43: 752-755, 2013.
8) Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol, 19: 68-74, 2012.
9) Kato K, Muro K, Minashi K, et al.: Phase II study of chemoradiotherapy with 5-fluorouracil and cisplatin for Stage II-III esophageal squamous cell carcinoma: JCOG trial (JCOG 9906). Int J Radiat Oncol Biol Phys, 81: 684-690, 2011.
10) Nomura M, Kato K, Ando N, et al.: Comparison between neoadjuvant chemotherapy followed by surgery and definitive chemoradiotherapy for overall survival in patients with clinical Stage II/III esophageal squamous cell carcinoma (JCOG1406-A). Jpn J Clin Oncol, 47: 480-486, 2017.
11) Minsky BD, Pajak TF, Ginsberg RJ, et al.: INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy. J Clin Oncol, 20: 1167-1174, 2002.
12) Kato K, Nakajima TE, Ito Y, et al.: Phase II study of concurrent chemoradiotherapy at the dose of 50.4 Gy with elective nodal irradiation for Stage II-III esophageal carcinoma. Jpn J Clin Oncol, 43: 608-615, 2013.
13) Ito Y, Takeuchi H, Ogawa G, et al.: A single-arm confirmatory study of definitive chemoradiotherapy (dCRT) including salvage treatment in patients (pts) with clinical (c) stage II/III esophageal carcinoma (EC) (JCOG0909). J Clin Oncol, 36: 4051, 2018.
14) Ishida K, Ando N, Yamamoto S, et al.: Phase II study of cisplatin and 5-fluorouracil with concurrent radiotherapy in advanced squamous cell carcinoma of the esophagus: a Japan Esophageal Oncology Group (JEOG)/Japan Clinical Oncology Group trial (JCOG9516). Jpn J Clin Oncol, 34: 615-619, 2004.
15) Shinoda M, Ando N, Kato K, et al.: Randomized study of low-dose versus standard-dose chemoradiotherapy for unresectable esophageal squamous cell carcinoma (JCOG0303). Cancer Sci, 106: 407-412, 2015.
16) Nishimura Y, Hiraoka M, Koide R, et al.: Long-term follow-up of a randomized Phase II study of cisplatin/5-FU concurrent chemoradiotherapy for esophageal cancer (KROSG0101/JROSG021). Jpn J Clin Oncol, 42: 807-812, 2012.
17) Terada M, Hara H, Daiko H, et al.: Phase III study of tri-modality combination therapy with induction docetaxel plus cisplatin and 5-fluorouracil versus definitive chemoradiotherapy for locally advanced unresectable squamous-cell carcinoma of the thoracic esophagus (JCOG1510:TRIANgLE). Jpn J Clin Oncol, 49: 1055-1060, 2019.
18) Shah MA, Adenis A, Enzinger PC, et al.: Pembrolizumab versus chemotherapy as second-line therapy for advanced esophageal cancer:Phase 3 KEYNOTE-181 study. J Clin Oncol, 37 suppl 15: 4010, 2019.
19) Kato K, Cho BC, Takahashi M, et al.: Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3):a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol, 20: 1506-1517, 2019.
PDFを閲覧するためには Adobe Reader が必要です。