日外会誌. 125(4): 348-357, 2024
特集
肺癌外科診療up to date
8.局所進行肺癌に対する内科治療後の手術,拡大手術
|
産業医科大学 第2外科(呼吸器・胸部外科) 田中 文啓 , 竹中 賢 |
局所進行肺癌には隣接臓器浸潤例や縦隔リンパ節転移等の多様な病態が含まれ,治療戦略も個々の症例に応じた治療選択が重要である.切除可能な進行非小細胞肺癌に対しては集学的治療が考慮されるが,1)手術先行で術後補助療法を考慮,2)術前導入療法後の手術,のいずれが良いのか,については議論が分かれる.また,術前導入療法として,化学療法または化学放射線療法のいずれが良いかについても明確ではない.近年,進行非小細胞肺癌に対する薬物療法の中心となったチロシンキナーゼ阻害剤等の標的薬剤や免疫チェックポイント阻害剤等が,周術期治療においても臨床試験で検討されつつある.このうち,術前導入療法として化学療法に抗PD-1/L1抗体を追加する効果が複数の臨床試験で示され,実臨床でも実施例が増加しつつある.また,初診時は切除不能と判断されても,内科治療後の再検討により切除(サルベージ手術)が考慮される例も増えつつある.特に,標的薬剤や免疫チェックポイント阻害剤が著効し,手術により良好な予後が期待される例の報告が増えつつある.このような内科治療後の手術は,拡大手術も含めて安全性については概ね大きな問題は無いようであるが,有効性については不明の部分も多い.本稿では局所進行肺癌に対する内科治療後の手術について,現状と将来展望につき概説する.
キーワード
肺癌, 術前導入療法, 免疫療法, 標的療法, サルベージ手術
I.はじめに
局所進行肺癌は,概ね臨床病期Ⅲ期肺癌に相当し,隣接臓器浸潤や縦隔リンパ節転移等の多様な病態が含まれる.治療戦略も,病態や病変の局在・拡がり等により異なり,個々の症例に応じた治療選択が重要である.小細胞肺癌で局所進展を認める場合には手術の対象となることは原則としてないが,非小細胞肺癌では手術を含む集学的治療により治癒が期待できる局所進行例も存在する.このため,臨床病期ⅢA期非小細胞肺癌の治療方針は「呼吸器外科医,内科医,放射線治療医を含めた集学的治療グループでの検討」が推奨されている(非小細胞肺癌CQ6:以下,CQは肺癌診療ガイドライン2023年版の非小細胞肺癌の項目による)1).
局所進行非小細胞肺癌のうち,「切除可能」と判断された症例に対しては,手術先行も考慮されるが,放射線化学療法等の術前導入療法後に手術が行われることも多い.また近年では,術前に化学療法に免疫チェックポイント阻害剤(抗PD-1/L1抗体)を併用した術前導入療法の有効性が複数の臨床試験で示され2)
~
6),プラチナ併用化学療法との併用による抗PD-1抗体ニボルマブに使用がわが国でも2023年3月に承認された.更に,チロシンキナーゼ阻害剤をはじめとする標的薬剤や免疫チェックポイント阻害剤等の新規薬剤の導入によって,初診時には切除不能と判断された症例についても,内科的治療の後に外科手術(サルベージ手術)7)の適応となる症例も増えつつある(図1).本稿では,このような局所進行非小細胞肺癌に対する内科治療後の手術について,現状と将来展望を概説する.

II.切除可能局所進行非小細胞肺癌に対する治療戦略
1)切除可能局所進行肺癌に対する治療戦略
局所進行癌には多彩な病態が含まれ,手術により完全切除が達成されかつ治癒が期待されるか否か,つまり「切除可能か否か」の判定は個々の症例ごとに決定される.局所進行例の中でも,縦隔リンパ節転移を認めない隣接臓器浸潤例は,完全切除が達成されれば比較的良好な術後成績が期待される.このため胸壁や心膜浸潤例(T3N0-1M0)には合併切除が推奨(CQ10, CQ11)され,大血管(大動脈や上大静脈)・左房・気管分岐部・横隔膜浸潤を認めるT4N0-1M0にも外科切除が提案されている(CQ8).
また,縦隔リンパ節転移(N2)を認めた場合も,肺葉切除により完全切除可能な臨床病期ⅢA期例では,術前の化学放射線療法後の手術が選択肢として提案されている(CQ26).縦隔リンパ節転移の有無は非小細胞肺癌の治療戦略や予後に大きな影響を与えるが,縦隔リンパ節転移の画像診断には限界があり,米国胸部疾患学会(ACCP)によるシステマティックレビュー8)によると,PET-CTによる縦隔リンパ節転移診断の感度・特異度はそれぞれ62%・90%であった.特に陽性的中率は63%にとどまり,4割弱の症例では病理学的には転移を認めないにも関わらず画像的に転移陽性(偽陽性)と診断された.またわが国で行われた前向き試験9)でのPET-CTによる縦隔リンパ節転移の正診率は75%にとどまり,特に特異度は69%(感度は83%)であった.またわが国で2004年に手術が施行された肺癌切除例の後方視的研究10)においては,術前に臨床病期ⅢA期N2(cN2)と診断された800例のうち,実際には病理学的に縦隔リンパ節に転移を認めなかった症例が326例(pN0, 271例; pN1, 75例)であり,43%において縦隔リンパ節転移が過大評価されていた.従って,臨床病期ⅢA期N2非小細胞肺癌のN2診断は,超音波内視鏡検査等によって組織学的に確認を行うことが推奨されている(CQ7, 24).
切除可能局所進行非小細胞肺癌に対しては,1)手術先行で,必要があれば術後補助療法を実施,2)術前導入療法を行った後に手術を実施,のいずれかの治療戦略がそれぞれの長所と短所を検討したうえで個々の症例に応じて選択される.術前導入療法としては,臨床病期ⅡB/ⅢA期非小細胞肺癌に対する術前プラチナ併用療法(CQ25),あるいは臨床病期ⅢA期(N2)に対する術前化学放射線療法(CQ26)が選択肢となるが,いずれも術前療法としての有効性を示す十分なエビデンスがなく弱い推奨(提案)にとどまっていた.われわれの施設では,隣接臓器浸潤(T3-4)を認めるN0/1症例には手術を先行することもあるが,局所進行例には原則として術前導入療法施行後に手術を行っており,術前療法としては局所制御に勝る化学放射線療法を採用していた.しかしながら術前導入療法として,プラチナ併用化学療法にニボルマブを併用することの優越性を示す第3相試験(CheckMate816試験)2)の結果を受け,2023年に改訂された肺癌診療ガイドラインでは,臨床病期Ⅱ-ⅢA期のEGFR遺伝子変異/ALK融合遺伝子陰性もしくは不明例に対して,術前にプラチナ製剤併用療法とニボルマブを併用した治療が提案された(CQ25).現状では術前の化学免疫療法は弱い推奨(提案)にとどまっているが,術前に加えて術後にも抗PD-1/L1抗体を用いた周術期療法の有効性を示す第3相試験の結果3)
~
6)が相次いで公表され,実臨床では術前導入化学免疫療法後の手術が急速に広がりつつある(表1).ただ,化学免疫療法の化学放射線療法に対する優越性は示されていないため,術前治療として化学免疫療法を用いるのか化学放射線療法を用いるのか,については今後の検討が必要である.
2)術前化学放射線療法後の手術
縦隔リンパ節転移を認めない隣接臓器浸潤例における術前導入化学放射線療法の意義は明確ではない.わが国で行われた胸壁浸潤例(T3N0-1M0)に対する術前導入放射線化学療法の効果を検討した第2相試験11)においては,51例中46例(92%)で胸壁合併による完全切除が達成された.5例で重篤な術後合併症を認め,1例は間質性肺炎の急性増悪で死亡した.3/5年生存率はそれぞれ77%/63%と比較的良好な予後が報告されているが,手術先行例との比較対照がないため術前導入化学放射線療法の優越性は不明である.肺尖部浸潤肺癌に対しては,術前化学放射線療法後の手術に関する二つの第2相試験12)
13)の結果が報告されており(表2),比較対照はないもののコンセンサスとして術前化学放射線療法が推奨されている(CQ46).
隣接臓器浸潤例に対する合併切除は,術前導入療法の有無にかかわらず浸潤臓器や部位および浸潤範囲等によりアプローチや難易度が大きく異なる.胸壁や横隔膜合併切除等では呼吸器外科のみで施行されるが,体外循環を必要とする心大血管合併切除や椎体合併切除等では関連各科専門医との術前の慎重な協議が必要となる.
縦隔リンパ節転移陽性例(N2)例に対しても術前導入療法の意義は明確ではない.病理学的に縦隔リンパ節転移が証明されたⅢA期N2症例を対象として行われたランダム化第3相試験14)においては,放射線化学療法後に手術を施行しても,手術を行わない群と比較して有意な生存延長を認めなかった(全生存期間中央値:23.6カ月対22.2カ月).ただ,肺葉切除が施行された例に限った探索的な解析では,手術施行群の方が予後良好であった(全生存期間中央値:33.6カ月対21.7カ月).当施設ではEBUS-TBNA等により病理学的に縦隔リンパ節転移が証明された臨床病期ⅢA期症例には原則として毒性が比較的軽微なカルボプラチンとパクリタキセルの分割投与との同時併用放射線療法を術前導入療法15)として行っていた.
術前導入化学放射線療法後に手術を施行する場合,組織の虚血により創傷治癒が遅延し特に気管支断端瘻孔の危険性が高くなる可能性がある.特に気管支-肺動脈瘻は致死的となるため,心膜脂肪組織で気管支断端を被覆しかつ気管支断端と肺動脈の間に介在させるようにしている.
3)術前標的療法後の手術
ドライバー変異陽性の非小細胞肺癌に対する術前の標的薬剤投与については,少数の第2相試験の結果のみが報告されているためその有効性は明確ではない.中国でEGFR遺伝子活性化変異を有する臨床病期ⅢA期N2症例を対象に行われた術前導入療法に関するランダム化第2相試験(EMERGING-CTONG 1103)15)においては,第2世代EGFR-TKIであるエルロチニブ投与群は化学療法群と比較して無増悪期間は延長を認めた(21.5カ月対11.4カ月)ものの,エルロチニブ投与群においても病理学的効果は十分ではなかった(病理学的完全奏功は両群とも無し).ただ,術前エルロチニブ群において,術後合併症を含めて特に問題となるような重篤な有害事象は認めず,チロシンキナーゼ阻害剤治療後の手術の安全性が示唆された.
4)術前免疫療法後の手術
術前導入療法としてプラチナ併用化学療法を対照とし,抗PD-1/L1抗体を追加する免疫化学療法の有効性を示す第3相試験の結果が相次いで公表された(表1)2)
~
6).これらの試験では,免疫化学療法が病理学的効果や無イベント生存率を有意に改善することが示されたばかりではなく,術前免疫化学療法の手術の安全性に影響を与えないことも示された.すなわち,重篤な有害事象や治療関連死亡は,抗PD-1/L1抗体の追加によっても増加することはなかった.術前導入療法としての免疫化学療法が検討され始めた当初は,抗PD-1/L1抗体後の手術難易度の上昇が懸念されたが,CheckMate816試験においては手術時間はむしろニボルマブ併用群で短く(中央値185分対214分),抗PD-1/L1抗体後の手術は技術的に特記すべき問題はなさそうである.同試験では,ニボルマブ併用群の方が全摘除術を回避できた症例が多く(肺全摘除症例:25例[17%]対34例[25%]),また開胸せずに胸腔鏡手術での切除例も多く(44例[30%]対29例[22%]),ニボルマブ併用によって腫瘍縮小が得られた結果として手術がむしろ容易となったことが示唆された2).

III.切除不能非小細胞肺癌に対するサルベージ手術
1)サルベージ手術とその分類
サルベージ手術7)
16)
17),とは,広義には,当初は手術の「適応なし」と判断されたものの,薬物療法や放射線治療など施行後に「適応あり」と判断され実施された手術を指す(表2).このうち狭義のサルベージ手術は,当初の治療方針を転換して実施される手術(Conversion手術)を指し,標的治療や免疫チェックポイント阻害剤等の高い有効性を示す薬剤が臨床実地に導入されたことにより実施される機会が増加しつつある.また広義のサルベージ手術には,内科的治療を尽くしても遺残した局所病変に対する手術や,内科治療にて一旦はすべての活動性病変が消失した後に発生した局所再発病巣に対する手術,あるいは副作用等のために内科的治療の継続が困難となったために行われる手術,等が含まれる(表3).
2)非小細胞肺癌に対するサルベージ手術
非小細胞肺癌に対するサルベージ手術の意義や適応については明確ではない.しかしながら,少数の遠隔転移病巣(オリゴ転移)を有するⅣ期非小細胞肺癌に対する手術等の局所治療の追加に関しては少数の前向き試験1)での良好な結果が報告されている(表4).米国で行われたランダム化第2相試験18)においては,3個以下の転移病巣を有する非小細胞肺癌患者に対して初回治療薬物療法を行った後に局所療法を加えた群の方が予後良好であった.これらの結果に基づいて,転移臓器・転移個数が限られている同時性オリゴ転移でかつ薬物療法により病勢が安定している場合,「局所療法の追加」を行うよう提案されている(CQ16).
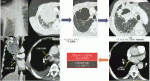
以上より,当初は「切除不能」と判断された進行例であっても,内科的治療が奏功した場合等にサルベージ手術を行うことによって良好な予後が期待できる例は存在すると推察される.ただ,非小細胞肺癌に対するサルベージ手術の妥当性や有効性は,前向き臨床試験が実施困難であることなどから,少数の後方視的観察研究の結果から推察するしかない.メモリアルスローンケタリングがんセンターの検討19)では,初回治療として非手術治療が施行された後に肺切除を受けた120例(当初の臨床病期はⅠ-Ⅱ期19例,Ⅲ期29例,Ⅳ期70例)の解析では,術後のグレード3以上の合併症発生率は5%と低く,術後30/90日死亡率はいずれも3%であった(無イベント生存期間中央値17カ月,3/5年無イベント生存率39%/29%;全生存期間中央値72カ月,3/5年生存率73%/61%).Ⅳ期症例についての探索的検討においては,手術施行例は手術非施行例よりも良好な予後(5年全生存率75%対25%)であった.わが国で非小細胞肺癌に対する放射線治療後に施行されたサルベージ手術(2010~2016年施行例156例)の多施設共同後ろ向き研究16)においては,術後3年時点での全生存率および無再発生存率はそれぞれ67.3%および49.8%であり,術後30日死亡率および30~90日死亡率はそれぞれ0%,1.9%と報告されている.また,EGFR遺伝子変異またはALK遺伝子再構成陽性例に対する標的薬剤(チロシンキナーゼ阻害剤)治療後に施行されたサルベージ手術(2010~2015年施行36例)の同様の後ろ向き研究17)においては,術後3年時点での全生存率および無再発生存率はそれぞれ75.1%および22.2%であり,術後30日死亡率および30~90日死亡率はいずれも0%であった.以上の結果は,放射線治療や標的薬剤後の手術は,概ね安全に施行しうることを示唆している.有効性に関しては,標的薬剤後のサルベージ手術においては術後3年時点での全生存率は75.1%と良好であるのに対して,無再発生存率は22.2%と低いのが特徴のようである.われわれの施設での狭義のサルベージ手術(Conversion手術)に関する後ろ向き解析7)においても,チロシンキナーゼ阻害剤後の予後は比較的良好(全生存期間中央値66カ月)ではあるものの,8例中5例に術後再発を認めている(表5).チロシンキナーゼ阻害剤は,投与により画像的縮小が得られても病理学的効果に乏しく(8例中5例はEf.1以下),治癒を期待するのは難しいのかもしれない.一方で,免疫チェックポイント阻害剤後のサルベージ手術症例8例のうち,観察期間は比較的短いものの術後再発を認めたのは1例のみであり,治癒が期待できるかもしれない.また,免疫チェックポイント阻害剤および化学療法後,左房内の残存腫瘍を人工心肺下に切除した1例(図2)を含め,手術関連死亡は認めなかった.いずれにしても,合併切除や気管支・肺動脈形成等を含めた手術にもかかわらず,手術関連死亡は認めず,標的薬剤や免疫チェックポイント阻害剤投与後のサルベージ手術は安全に施行可能である可能性が示唆される.




IV.おわりに
局所進行非小細胞肺癌に対する内科的治療後の手術の安全性は,これまでの臨床研究の結果からほぼ確認された.しかしながら手術適応や手術のタイミングについては,今後の更なる検討が必要である20).切除可能局所進行例に対しては,1)手術先行 → 術後補助療法,2)術前導入療法 → 手術,のいずれが良いか,また導入療法を施行する場合の化学療法・化学免疫療法・化学放射線療法の選択,については個々の症例ごとに集学的治療チームでの検討が必要である.また当初は切除不能と判断された症例に対してサルベージ手術を加えることの意義やそのタイミングは議論が分かれるところである.われわれの施設では,耐術能に加えて,1)手術により局所病変の完全切除が可能であること,2)肺全摘除術を回避できると期待されること,をサルベージ手術実施の規準としている.今後は,手術適応やタイミングの判断に有用なバイオマーカーの開発が必要であり,現時点で最も期待されるのは微小残存病変(minimal residual disease, MRD)の指標である腫瘍細胞由来の血液中循環DNA(ctDNA)である.ctDNAが陰性の場合は微小転移が存在しないことが示唆され,進行例であっても局所療法である手術によって治癒が期待される.実際に,大腸癌では手術後のctDNA陰性例には術後の補助化学療法なしでも良好な予後が期待されることが示され,現在その検証が行われている21).しかしながら非小細胞肺癌においては,ctDNAの検出感度が低いことが問題であり22),ctDNAの臨床使用にはその検出感度改善が課題とされている.
いずれにしても局所進行非小細胞肺癌に対する内科治療後の手術の機会は今後増加すると予測される.手術は集学的治療の一環であり,術後合併症の軽減や術後補助療法の追加等を考慮した場合,いかに肺全摘除術を回避するかが極めて重要となると考える.
利益相反
原稿料など:イーライリリー株式会社,アストラゼネカ株式会社,中外製薬株式会社,MSD株式会社,ブリストル・マイヤーズ スクイブ株式会社,小野薬品工業株式会社
研究費:日本ベーリンガーインゲルハイム株式会社,アストラゼネカ株式会社,中外製薬株式会社,MSD株式会社,ブリストル・マイヤーズ スクイブ株式会社,小野薬品工業株式会社
奨学(奨励)寄附金:大鵬薬品工業株式会社,中外製薬株式会社
文献
1) 肺癌診療ガイドライン.2023年3月19日. https://www.haigan.gr.jp/guideline/2023/
2) Forde PM , Spicer J , Lu S , et al.: Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med, 386: 1973-1985, 2022.
3) Cascone T , Awad MM , Spicer J , et al.: CheckMate 77T: Phase 3 study comparing neoadjuvant chemotherapy (chemo) plus nivolumab (NIVO) vs neoadjuvant chemo plus placebo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage Ⅱ–ⅢB non-small cell lung cancer (NSCLC). Ann Oncol, 34(S2): S1265, 2023.
4) Wakelee H , Liberman M , Kato T , et al.: Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N Engl J Med, 389: 491-503, 2023.
5) Heymach JV , Harpole D , Mitsudomi T , et al.: Perioperative durvalumab for resectable non-small-cell lung cancer. N Engl J Med, 389: 1672-1684, 2023.
6) Lu S , Zhang W , Wu L , et al.: Perioperative toripalimab plus chemotherapy for patients with resectable non-small cell lung cancer: The Neotorch randomized clinical trial. JAMA, 331: 201-211, 2024.
7) Takenaka M , Tanaka F , Kajiyama K , et al.: Outcomes and pathologic response of primary lung cancer treated with tyrosine kinase inhibitor/immune checkpoint inhibitor before salvage surgery. Surg Today, 2024 Mar 14. doi: 10.1007/s00595-024-02811-3. Epub ahead of print. PMID: 38483630.
8) Silvestri GA , Gonzalez AV , Jantz MA , et al.: Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest, 143(5 Suppl): e211S-e250S, 2013.
9) Kubota K , Murakami K , Inoue T , et al.: Additional value of FDG-PET to contrast enhanced-computed tomography (CT) for the diagnosis of mediastinal lymph node metastasis in non-small cell lung cancer: a Japanese multicenter clinical study. Ann Nucl Med, 25: 777-786, 2011.
10) Yoshino I , Yoshida S , Miyaoka E , et al.: Surgical outcome of stage ⅢA- cN2/pN2 non-small-cell lung cancer patients in Japanese lung cancer registry study in 2004. J Thorac Oncol, 7: 850-855, 2012.
11) Kawaguchi K , Yokoi K , Niwa H , et al.: A prospective, multi-institutional phase Ⅱ study of induction chemoradiotherapy followed by surgery in patients with non-small cell lung cancer involving the chest wall (CJLSG0801). Lung Cancer, 104: 79-84, 2017.
12) Rusch VW , Giroux DJ , Kraut MJ , et al.: Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: Long-term results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol, 25: 313-318, 2007.
13) Kunitoh H , Kato H , Tsuboi M , et al.: Phase Ⅱtrial of preoperative chemoradiotherapy followed by surgical resection in patients with superior sulcus non-small-cell lung cancers: Report of Japan Clinical Oncology Group trial 9806. J Clin Oncol, 26: 644-649, 2008.
14) Albain KS , Swann RS , Rusch VW , et al.: Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ non-small-cell lung cancer: a phase Ⅲ randomised controlled trial. Lancet, 374: 379-386, 2009.
15) Zhong WZ , Chen KN , Chen C , et al.: Erlotinib versus gemcitabine plus cisplatin as neoadjuvant treatment of stage ⅢA-N2 EGFR-mutant non-small-cell lung cancer (EMERGING-CTONG 1103): A randomized phase Ⅱ study. J Clin Oncol, 37: 2235-2245, 2019.
16) Shimizu K , Ohtaki Y , Suzuki K , et al.: Salvage surgery for non-small cell lung cancer after definitive radiotherapy. Ann Thorac Surg, 112: 862-873, 2021.
17) Ohtaki Y , Shimizu K , Suzuki H , et al.: Salvage surgery for non-small cell lung cancer after tyrosine kinase inhibitor treatment. Lung Cancer, 153: 108-116, 2021.
18) Gomez DR , Tang C , Zhang J , et al.: Local consolidative therapy vs. maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer: long-term results of a multi-institutional, phase Ⅱ, randomized study. J Clin Oncol, 20: 1558-1565, 2019.
19) Dunne EG , Fick CN , Tan KS , et al.: Lung resection after initial nonoperative treatment for non-small cell lung cancer. J Thorac Cardiovasc Surg, 2023 Nov 30:S0022-5223(23)01116-9.doi:10.1016/j.jtcvs.2023.11.040.Online ahead of print.
20) Takenaka M , Kuroda K , Tanaka F : Adjuvant and neo-adjuvant therapy for non-small cell lung cancer without EGFR mutations or ALK rearrangements. Int J Clin Oncol, 2024 Jan 28. doi: 10.1007/s10147-023-02459-y. Epub ahead of print. PMID: 38281195.
21) Kotani D , Oki E , Nakamura Y , et al.: Molecular residual disease and efficacy of adjuvant chemotherapy in patients with colorectal cancer. Nat Med, 29: 127-134, 2023.
22) Zhou C , Thakur MD , Srivastava MK , et al.: IMpower010: Biomarkers of disease-free survival (DFS) in a phase Ⅲ study of atezolizumab (atezo) vs best supportive care (BSC) after adjuvant chemotherapy in stage ⅠB-ⅢA NSCLC. Ann Oncol, 32(supplement 7): S1374 (Abstract #20), 2021.
PDFを閲覧するためには Adobe Reader が必要です。