日外会誌. 125(3): 229-236, 2024
特集
Acute Care Surgeon―その活躍の場―
6.Acute Care Surgeryにおける集中治療
|
1) 東千葉メディカルセンター 救命救急センター 橋田 知明1)2)3) , 小泉 和久4) , 小倉 皓一郎5) , 川口 留以3)6) , 中田 孝明3) |
Acute Care Surgeryとは,近年,米国外傷外科学会によって提唱された新たな概念で,外傷外科・救急外科・集中治療・surgical rescueを扱う新しい外科領域である.外傷だけでなく外科的治療を要する救急疾患が対象であり,その病態は多岐にわたり,重篤であることも多い.よってAcute Care Surgeonは,初療から手術,そしてその後の集中治療までをシームレスに行うことが期待されている.
そしてその中でも集中治療の重要性はますます高まっており,各種人工臓器補助を使用し全身管理を行い,早期の生理学的機能の回復に努めるとともに,容態変化に対して機を逸せずに積極的な介入を行っていく事が求められる.
このような横断的な役割を果たすAcute Care Surgeonは,今後わが国でもますます重要視されると思われる.
キーワード
damage control surgery, REBOA, ECPR, 腎代替療法
I.はじめに
Acute Care Surgery(ACS)とは, 2005年に米国外傷外科学会によって提唱された新たな概念で,外傷外科・救急外科・集中治療を扱う新しい外科領域であり1),近年ではsurgical rescueが四つ目として加わり,その役割は拡大している2).
重症外傷ではその初期蘇生時においてDamage Control Resuscitation(DCR)が提唱されているが3),ACSは,外傷以外にも外科的治療を要する救急疾患が対象であり,その病態は多岐にわたり,また重篤であることも多く,術後に多臓器不全に進展する例も少なくない.
しかし近年,外科の臓器別専門性の細分化や,ロボット手術に代表されるような専門技術の高度化により,生理学的に不安定な重症多発外傷や敗血性ショックを合併した急性腹症などの重症患者に対して初期診療から手術,そして周術期管理まで包括的に対応できる医師が減少している.
そこで,Acute Care Surgeonがその横断的な役割を果たすことが期待されている.Acute Care Surgeonが関わることで,初療から手術,そしてその後の集中治療までシームレスな治療が行われた,実際に筆者が診療に深く関わった症例を提示する.
II.重症外傷患者に対する,初療から止血術への戦略とその後の集中治療
症例1:30歳代,男性.夜間に,オートバイにて60km/hで直進中に,対向車線から右折した軽乗用車と衝突し,救急要請となった.救急隊現着時,患者は意識清明,橈骨動脈は触知良好であった.高リスク受傷機転と判断し,救命救急センターに搬送となった.
来院時,血圧85/53 mmHg,脈拍数128/分,呼吸数29/分,Glasgow Coma Scale(GCS) E4V5M6,SpO2はリザーバーマスク10L/分投与下で100%であった.体表には明らかな外出血は認めず,focused assessment with sonography for trauma(FAST)で腹腔内に液体貯留を認めた.
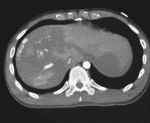
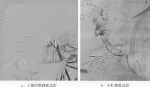
緊急輸血をオーダーしつつ,造影CTを施行したところ,外傷性肝損傷(Ⅲb型)と血管外漏出像を認めた(図1).緊急止血術が必要であり,Acute Care Surgeonが中心となり治療戦略を立てた.開腹止血術および血管塞栓術の併用による治療を行うため,ERよりハイブリッド手術室へ移動した.開腹時に著明な血圧低下,場合によっては心停止する可能性を想定し,開腹止血術の準備を進めている間に,大動脈遮断バルーン(Resuscitative endovascular occlusion of the aorta:REBOA)をaortic zone Ⅰに留置した.やはり麻酔導入時に血圧低下を認め,REBOAをインフレートし,開腹した.腹腔内には大量の血種があり可及的に除去した.肝S5,S8に大きな裂創を認め,肝門部遮断を行った後,REBOAをデフレートし,ガーゼで可及的にパッキングした.そして開腹したまま経カテーテル動脈塞栓術(transcatheter arterial embolization:TAE)を施行した.上腸間膜動脈造影にて,replaceしている右肝動脈は攣縮により途絶を認めた(図2a).腹腔動脈造影で,その右肝動脈末梢側に,中肝動脈を介しての血管外漏出像を認めたため,途絶している右肝動脈にマイクロカテーテルでアプローチすることで途絶部を通過し,ゼラチンスポンジで塞栓した(図2b).その後,REBOAを再度インフレートし,パッキングガーゼの位置調整を行い,止血を確認し一時的に閉腹し得た.総手術時間は2時間56分,出血量は5,575mlであった.手術中に,細胞外液3,000ml,赤血球濃厚液16U,新鮮凍結血漿22U,濃厚血小板20Uを投与した.術前を含めてREBOAのインフレート時間は計70分間であった.経口気管挿管,未覚醒のままICU入室となった.
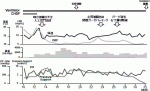
ICU入室後も循環不全と凝固障害を認め,大量輸血を継続した.大量輸血に伴う呼吸不全を認め,P/F比は一時期かなり増悪したが,血行動態をモニタリングしながら強度の陽圧管理を行い,酸素化を維持した.また循環不全から腎不全を認めたため,第2病日から持続的腎代替療法を施行し,厳密な体液バランス管理を行った.そして,広範囲肝損傷に伴う肝不全により徐々にT-Bil値の上昇と,凝固障害も相まってのPT値の低下があり,補充療法を中心とした支持療法を継続した.上記の集中治療を行い,徐々に循環動態は安定し,第5病日にパッキングガーゼを完全に除去し,閉腹し得た.第18病日,腹腔ドレーンの排液が血性となったため,造影CT検査を施行したところ,右肝動脈末梢側の仮性動脈瘤破裂を認め,緊急TAEを施行し,ゼラチンスポンジで塞栓した.この時,右肝動脈に動静脈シャントを認めたが,この時点で出血はなく,第23病日に待機的TAEを施行し,同部位をコイルで塞栓した.その後も集中治療を継続し,徐々に呼吸不全,循環不全,腎不全,肝不全から立ちあがり,第29病日に人工呼吸器から離脱,第39病日に腎代替療法から離脱し,第41病日にICUを退室した.その後もリハビリテーションを中心とした加療を継続し,第68病日に独歩退院した(図3).退院後のフォローアップCTでは,残肝は増大し,明らかな遺残膿瘍や胆汁漏は認めなかった.受傷後約半年で社会復帰し,遅発性合併症なく経過している.
本症例では治療戦略として,まずREBOA併用下にガーゼパッキングとTAEを組み合わせ止血術を施行し,その後に長期に集中治療管理と追加のTAEを経て,大きな合併症なく救命することができた.
重症肝損傷において,開腹によるガーゼパッキングだけでは動脈性出血の止血は難しく,TAE併用による止血が有用であること4),それにより24時間死亡率を有意に改善させること5)が報告されている.本症例でも,ガーゼパッキングのみでは有効な止血は得られず,術中TAEを併用することで止血を得た.また結果として開腹とTAEによる手術時間は3時間近くとなったが,手術中もAcute Care Surgeon の指示の下,REBOAのインフレートとデフレートを適宜行うことで循環動態を維持することができた.REBOAの長時間の使用により,遠位臓器の虚血リスクもあるが,完全遮断と部分遮断をうまく組み合わせることで,合併症を回避しつつ長時間の循環維持を達成することが可能である6).本症例でも計70分の遮断時間であったが,REBOA使用に起因する合併症は認めなかった.
そして,術後は,呼吸不全,循環不全,腎不全,肝不全に凝固障害も加わったいわゆる多臓器不全の状態であったが,Acute Care Surgeonが継続して集中治療を担い,早期に腎代替療法を導入し,全身管理を行った.よって,適切なタイミングでパッキングガーゼの除去や閉腹を行うことができ,早期から行ったリハビリテーションや,栄養療法も功を奏し,受傷後約半年で社会復帰することが可能となったと思われる.

III.重症な腹部救急患者に対する,damage control surgeryからの長期間の集中治療
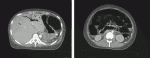
症例2:30歳代,女性.第2子の妊娠6週で産婦人科に通院中だった.来院2日前からの腹痛と嘔吐を来たし,産婦人科を受診したところ,産科的な異常は認めないものの,著明な高血糖とアシドーシスを認めた.精査加療目的に入院となったが,急速にショック状態となり,ICUに入室した.入室時,血圧84/43 mmHg,脈拍数130/分,呼吸数37/分,Glasgow Coma Scale E4V4M6,SpO2は測定不能,体温36.1℃であった.腹部は膨満し,腹膜刺激症状と筋性防御を認めた.採血所見にて,PH7.18,血糖値 1,346 mg/dL,総ケトン体 5,390 µmol/mLを認め,重度の糖尿病性ケトアシドーシスを呈していた.造影CTを施行したところ,広範な腸管虚血と門脈気腫を認め(図4),緊急開腹術を施行した.術中所見として,全小腸および上行結腸に至る広範囲の腸管壊死を認め,小腸亜全摘術および右半結腸切除術を施行し,open abdominal management(OAM)とし,経口気管挿管,未覚醒のままICU帰室となった.総手術時間は1時間36分であった.病理所見にて,腸間膜動静脈に明らかな閉塞性病変なく,非閉塞性腸管虚血(non-occlusive mesenteric ischemia:NOMI)と診断された.原因として,前回妊娠時に,尿糖を指摘されており,今回の妊娠を契機に耐糖能異常が増悪し糖尿病性ケトアシドーシスを発症し,高度脱水や電解質異常を呈し,NOMIを発症したと考えられた.
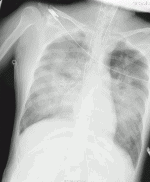
手術中から重篤なacute respiratory distress syndrome(ARDS)を呈しており,ICU帰室時,胸部レントゲン画像(図5)で著明な透過性低下を認め,酸素化はP/F比で35mmHg(人工呼吸器FiO2 1.0,APRV mode)であった.そこでV-V ECMOを導入する方針とし,送脱血管のカニュレーションを開始したが,呼吸不全とアシドーシスの進行により,心停止を来たした.そこでV-V ECMOではなく,体外循環式心肺蘇生(extracorporeal cardiopulmonary resuscitation:ECPR)としてV-A ECMOを導入する方針に切り替えた.
ECMO flowを維持するのに必要な血液量を維持するため,血行動態をモニタリングしながら晶質液輸液や輸血を慎重に投与した.また,代謝性アシドーシスの是正と厳密な体液バランス管理を要するため,持続的腎代替療法を開始した.そして,相対的副腎不全に対して,ヒドロコルチゾンの投与を行い,適切な抗菌薬治療を行った.
上記の治療にて,蘇生された自己の心機能は徐々に立ち上がり,第4病日に,V-A ECMOから離脱出来,呼吸不全は遷延していたためそのままV-V ECMOに移行した.第6病日に2nd look operationを行い,子宮と左卵巣壊死を認め,子宮全摘術と左卵巣切除を施行し,残っていた小腸結腸吻合術を行った.その後,徐々に呼吸状態も安定し,マイナスバランスでの体液管理も行えるようになり,第9病日に,V-V ECMOを離脱できた(図6)7).しかし,決して全身状態が良いとは言えない中で行った吻合であったため,第12病日に,縫合不全を認め,人工肛門造設術を行った.第24病日に,貧血の進行があり精査にて左被膜下出血を認め,開腹ガーゼパッキング術を行った.その2日後には同部位の止血を確認し,パッキングガーゼを除去した.またこの経過中に,V-A ECMO施行に伴い,下肢送血のためのバイパスを留置していたものの,全身のショック状態からも惹起された下肢虚血により右下腿コンパートメント症候群を呈し,早期に減張切開を置き,改善を待っていた.しかし残念ながら,徐々に壊死は進行し,救肢は困難であると判断し,第26病日に右下腿切断術を施行している.
上記の積極的な外科的処置と集中治療を行い,気管切開を経て,呼吸状態も改善を認め,第35病日には人工呼吸器を離脱できた(図7).その後はリハビリテーションを中心とした加療を継続し,第78病日にICU退室した.全身状態が安定したところで,第152病日に,待機的に十二指腸結腸吻合術を施行し,最終的には在宅IVH管理とし,第227病日に独歩で自宅退院となった.
重篤なNOMIは広範囲に腸管壊死を引き起こすため,救命には広範な腸管切除が必要となる.このような場合予後は極めて不良であり,その死亡率は約50~80%であり 8),門脈ガスがある場合は75%に達する 9).本症例では,広範な腸管壊死および門脈ガスが認められ,さらに重篤な代謝性アシドーシスやARDSを認めていた.
そこで,外傷だけでなく,腹部救急疾患においても,全身状態が極めて不良な場合,damage control surgery(DCS)が推奨されており10)
11) ,本症例では,初回の手術はAcute Care Surgeonの判断で,エネルギーデバイスを使用し,可及的な壊死腸管切除に止め,OAM管理とした.それでも,術中心停止は免れたものの,術後にICUで心停止した.しかしその状態でも,すでに壊死腸管切除というsource controlがされていたことで,判断に迷うことなく,迅速にECPRを施行出来た.DCSとECMOの迅速な導入がこの患者の蘇生につながったと考えられる.
またこの症例の,ICU入室時の重症度を示すAPACHE(acute physiology and chronic health evaluation)Ⅱ scoreは45であり,そこから推定される予測死亡率は92.0%であった.また臓器不全の重症度を示すSOFA(sequential organ failure assessment)scoreは15であり,その予測死亡率は95%以上であった.このように救命自体が非常に困難な症例であったが,Acute Care Surgeonを中心に,縫合不全や出血,下肢虚血などの容態変化に対して機を逸せずに外科的介入を行い,致命的になることを防ぎ,また複数回手術と集中治療管理を粘り強く続けたことで,各種人工臓器補助から離脱出来,最終的には残存腸管を吻合し得,在宅IVH管理として,自宅退院へ繋げることが出来た.

IV.考察
ACSにおけるDCSは,生理学的機能が破綻するのを回避すべく行われる治療戦略である.止血と汚染回避を目的とした蘇生のための簡略化手術,生理学的機能の回復を目指す集中治療,そして再建のための計画的再手術,の三つの段階で構成される.その中でも生理学的機能の回復はより重要視され,集中治療の重要性はますます高まっている.DCSにおいて患者が集中治療室に入室した際に,Acute Care Surgeonの役割は多岐にわたる.呼吸管理,循環管理,OAMを含む腹腔内圧管理,感染管理,栄養管理などの全身管理を行い,早期の生理学的機能の回復に努める.また,容態変化に対して機を逸せずに積極的な介入を行い,可能ならば早期に再建や機能回復のための再手術を行う.そしてさらに大事なのはその判断を行うことである.
また近年,集中治療後症候群(post intensive care syndrome:PICS)の概念が浸透してきている.ICUにおける急性期治療が成功しても,生存退室後に身体機能障害,認知機能障害,精神衛生障害を来たしたり12),退院後早期に死亡するなど13),退室後転帰が不良なことが問題となっている.実際に,前述の2症例とも,精神科介入などを行ったものの入院中は抑うつ状態を認めていた.しかし,PICSの予防として提唱されているABCDEFバンドル14)に基づきながら早期のリハビリテーションなどを行うことで,最終的に社会復帰に至った.ただ,手術を行い救命する,だけではなく,機能予後や最終的な転帰まで見据えた集中治療を行っていくこともAcute Care Surgeonの大事な役割である.
V.おわりに
ACSは,重症外傷だけでなく外科的治療を要する救急疾患が対象であり,その病態は重篤であることも多い.そのためACSにおける集中治療の役割は非常に重要である.よって,Acute Care Surgeonは,初療から手術,そして集中治療までシームレスに行うことが求められる.また,PICSにも着目していく事が必要である.そして,働き方改革が進む中で,横断的な役割を果たすAcute Care Surgeonは,今後わが国でもますますその役割が重要視されてくると思われる.
利益相反:なし
文献
1) Hoyt DB , Kim HD , Barrios C : Acute care surgery:a new training and practice model in the United States. World J Surg, 32: 1630-1635,2008.
2) Kutcher ME , Sperry JL , Rosengart MR , et al.: Surgical rescue : The next pillar of acute care surgery. J Trauma Acute Care Surg, 82: 280-286, 2017.
3) Ball CG :Damage control resuscitation:history,theory and technique.Can J Surg, 57: 55-60, 2014.
4) Matsushima K , Hogen R , Piccinini A , et al.: Adjunctive use of hepatic angioembolization following hemorrhage control laparotomy. J Trauma Acute Care Surg, 88: 636-643, 2020.
5) Hagiwara M , Iwata Y , Takahashi H , et al.: Severe liver injury with traumatic cardiac arrest successfully treated by damage control surgery and transcatheter arterial embolization in the hybrid operating room: a case report. Surg Case Rep, 7: 1-6, 2021.
6) Hashida T , Nanami H , Akiko H , et al.: Case report: Lifesaving hemostasis with resuscitative endovascular balloon occulusion of the aorta in a patient with cardiac arrest caused by upper gastrointestinal hemorrhage. Front Med, 8: 777421, 2021.
7) Ogura K , Oami T , Hattori N , et al.: A Case of Successful Extracorporeal Membrane Oxygenation Support for Cardiac Arrest Associated with Non-occlusive Mesenteric Ischemia. Emerg Med, 6: 1000322, 2016.
8) Yukaya T , Saeki H , Taketani K , et al.: Clinical outcomes and prognostic factors Dіer surgery for non-occlusive mesenteric ischemia: a multicenter study. J Gastrointest Surg, 18: 1642-1647, 2014.
9) Liebman PR , Patten MT , Manny J , et al.: Hepatic-portal venous gas in adults: etiology, pathophysiology and clinical significance. Ann Surg, 187: 281-287, 1978.
10) Rotondo MF , Schwab CW , McGonigal MD , et al.: ʻDamage control’:an approach for improved survival in exsanguinating penetrating abdominal injury. J Trauma, 35: 375-382, 1993.
11) Weber DG , Bendinelli C , Balogh ZJ : Damage control surgery for abdominal emergencies. Br J Surg, 101:e109-118, 2014.
12) Needham DM , Davidson J , Cohen H , et al.: Improving long-term outcomes after discharge from intensive care unit:Report from a stakeholders’ conference. Crit Care Med, 40(2): 502-509, 2012.
13) Brinkman S , de Jonge E , Abu-Hanna A : Mortality after hospital discharge in ICU patients. Crit Care Med, 41(5): 1229-1236, 2013.
14) Harvey MA , Davidson JE : Post intensive Care Syndrome: Right Care, Right Now...and Later. Crit Care Med, 44(2): 381-385, 2016.
PDFを閲覧するためには Adobe Reader が必要です。