日外会誌. 123(5): 409-415, 2022
特集
低侵襲膵切除術の進歩
6.腹腔鏡下膵体尾部切除術(RAMPS含む)
|
国立がん研究センター中央病院 肝胆膵外科 伴 大輔 , 奈良 聡 , 高本 健史 , 水井 崇浩 , 江崎 稔 , 島田 和明 |
腹腔鏡下膵体尾部切除(LDP)は良性・境界悪性病変だけでなく膵癌に対しても行われるようになってきた.2021年に本邦において,安全に低侵襲膵切除を行うための国際会議Precision anatomy for minimally invasive hepatobiliary pancreatic surgery : PAM-HBP Surgery Projectが行われた.拡大視効果によって明らかになってきた詳細な解剖と,腹腔鏡下特有のアプローチに焦点をあて,安全に低侵襲膵切除術を行うための知見について共有するコンセンサス会議であった.これまで大規模な後ろ向き観察研究によると,開腹手術と比較してLDPは手術出血量の低下,早期回復という点で優位であり,合併症,死亡率は同等であった.膵癌に対しても開腹手術と同等のR0切除率,リンパ節郭清が報告されており,予後としても開腹手術と同等であった.近年,米国のNational Cancer Databaseからプロペンシティスコアで患者背景,腫瘍因子をマッチングして解析を行い,LDPとロボット支援手術を含む低侵襲手術の方が良好な生存率を示しているという報告があるが,潜在的な選択バイアスを含んでいる可能性があり,今後のランダム化比較試験の結果をもとに慎重な評価が必要である.
キーワード
腹腔鏡下膵体尾部切除, LDP, MIDP, Lap-RAMPS
I.はじめに
腹腔鏡下膵体尾部切除(LDP)は1996年に初めて報告された.わが国では2012年にリンパ節郭清を伴わない膵体尾部切除が保険収載され,主として良性・境界悪性病変に対して普及が進んでいった.以後,2016年には膵癌に対しても適応拡大され,リンパ節郭清を伴うLDPも保険収載に加えられた.2020年にはロボット支援下膵体尾部切除も新たに保険適応に加わった.今後はロボット支援下手術が低侵襲手術の主役となると思われるが,現状ではLDPはすでに経験が蓄積され手技が定型化されているという利点もある.ロボット支援下手術については他稿に委ねるとして,本稿ではLDPの現状と得られているエビデンス,手術手技上のトピック,今後の課題について述べたい.
II.腹腔鏡下膵体尾部切除の現状
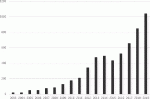
日本内視鏡外科学会のアンケート調査第15回集計結果報告によると,腹腔鏡下膵体尾部切除術は2012年に保険収載されて以来,2019年で約3倍に増加している(図1).現在の増加の傾向からすると,現状でまだプラトーに達しているわけではなく,今後はさらに普及,発展が見込まれる術式であると思われる.
近年,低侵襲膵切除術に焦点を当てた国際会議がいくつか開催されている.2016年,サンパウロで開かれたInternational Hepato-Pancreato-Biliary Association’s(IHPBA)10th World Congressにて,手術成績,コスト,Quality of life(QOL),教育システムなどについてエキスパートによるアンケートが行われた1).また2019年,マイアミにてSociety of Surgical Oncologyによる,the Miami International Evidence-Based Guidelines on Minimally Invasive Pancreas Resectionが開催された2).そして,2021年には本邦において,安全に低侵襲膵切除を行うための国際会議Precision anatomy for minimally invasive hepatobiliary pancreatic surgery : PAM-HBP Surgery Projectが行われた3).拡大視効果によって明らかになってきた詳細な解剖と,腹腔鏡下特有のアプローチに焦点をあてて,エキスパートによる安全に低侵襲膵切除術を行うための知見について共有するコンセンサス会議であった.いずれのコンセンサスにおいても,腹腔鏡下膵切除がより一般的になってきているが,技術的に難しいポイントを含んでいるため,腹腔鏡手術手技への習熟が求められる術式であるということが強調されている.
かつては良性,境界悪性病変にのみLDPが行われてきたが,膵癌に対するLDPにも適応拡大されている昨今では,自ずと適応基準も変化してきている.かつては腫瘍条件としてYonsei criteria(①膵内に限局,②左腎,副腎の筋膜に浸潤がない,③腹腔動脈幹から1~2cm離れている)がよく知られていたが,現在ではもうすこし適応拡大されているだろう.
III.膵癌に対する腹腔鏡下膵体尾部切除術
膵癌に対する根治的手術の基本原則は遺残なく切除することである.開腹膵体尾部切除の手術手技として,Radical antegrade modular pancreatosplenectomy(RAMPS)が提唱され,わが国でも標準的に普及している方法であると思われる.開腹手術で用いられているこれらの手術指針は,腹腔鏡手術にも適用可能であり,腹腔鏡視野では背側からの視野が良いため,わが国からも膵背側から剥離層を決定するアプローチを“caudo-dorsal artery first approach” や “ligament of Treitz approach”として有用性が報告されている4).
近年,学会,研究会,また論文等でも「Lap-RAMPS」という用語がよく使われている.本来はRAMPSの主眼は内側から外側への剥離アプローチであったと思うが,それについては言及されておらず,後方の剥離面がGerota筋膜の腹側に入るか背側に入るか,左副腎を合併切除するかどうかによってanterior/posterior RAMPSという用語を使い分けていることが多いようである.このように後方の剥離層のことだけで,RAMPSという言葉を使うべきかどうかについては,意見が分かれるかもしれない5).それを避けるために,PAM-HBPミーティングでは,シンプルに後壁面の剥離層をLine A/B/Cとすることが提唱された6).
Lap-RAMPSに関する報告は,上記の様な手技の定義に関わる問題や,体部/尾部での腫瘍の局在と適応の問題を含んでおり,これまでの報告では前提が明らかにされないままLap-RAMPSの有用性が述べられている傾向にある.ただし,腹腔鏡下での良好な視野のもと,とくに膵背側に関しては腫瘍マージンを確保できる層を選択して剥離できることは腹腔鏡下膵体尾部切除術の利点の一つだと思われる.
IV.腹腔鏡下膵体尾部切除のエビデンス
これまでLDPの手術成績を検討した報告は数多くFeasibilityや基本的な安全性については既に議論の余地がないところと思われる.開腹膵体尾部切除(ODP)とLDPの手術成績を比較した数編のシステマティックレビューではODPと比較してLDPは術後合併症において変わりがないが,出血量が少なく,術後在院日数が少ないと結論づけている7)
~
12).いくつかの報告では,手術時間はLDPの方がODPよりも長いとしているが,その他は同等であるという結果であった(表1).
膵体尾部癌に対するLDPとODPの治療成績として,いくつかの大規模な後ろ向き観察研究がある(表2).少し時間が経過した報告になるが,フランスのFrench healthcare databaseから膵癌に対する膵体尾部切除として,LDP(n=347)はODP(n=2,753)に対し,長期生存において良い成績を示し(MST:LDP 62.8 m [44.9~71.2] vs. ODP 36.7[33.3~39.3], p<0.0001),90日死亡もLDPの方が少ないという結果であった(LDP 2.6% vs. ODP 5.6%, p=0.0215)13).この報告では多変量解析においてLDPが独立した予後良好な因子となっている(HR 0.67 [0.53~0.84], p=0.0007).しかし,本研究の検討項目は術式に関するものが主で腫瘍因子は含まれていないため,当然ながら選択バイアスが排除されていない.ODPの方が他臓器合併切除を多く併施しており,進行症例の比率が高いことが予測される.この結果をもって膵癌に対してのLDPの優越性を論じることはできない.
欧州の後ろ向き観察,34施設の多施設共同試験(DIPLOMA試験)として,Propensity scoreを用いて選択バイアスを少なくして研究が行われた14).本研究ではLDP324例以外にロボット支援手術(RDP)16例を含んで,低侵襲膵体尾部切除(MIDP)としているが,ほぼLDPとして解釈してよいものと思われる.一般的な年齢,性別,BMI,PS,術前化学療法,腫瘍因子などをマッチして,MIDP(n=340)vs. ODP(n=340)を比較した.結果,R0切除率はMIDPの方が高い(MIDP 67% vs. ODP 58%, p=0.019).Gerota’s fascia切除率はMIDPの方が低く(MIDP 31% vs. ODP 60%, p<0.001),リンパ節切除個数もMIDPの方が少なかった(MIDP 14 [8~22] vs. ODP 22 [14~31], p<0.001).生存期間中央値は同等であった(MIDP 28 [95%CI 22~34] vs. ODP 31 [26~36], p=929).ほか,短期成績では出血量,在院日数ではMIDPが良好で,合併症,死亡率は同等であった.これらの結果から,治療として腫瘍学的な安全性はMIDPとODPで同等であるが,根治的手術が行われたかどうかについては,相反する結果と評価されている(Gerota’s fascia切除が根治的切除と評価するかは疑問があるが).また,低侵襲治療によって術後の補助化学療法(AC)をよりよく導入できるのではないかと期待したいところだが,本試験では術後からACまでの期間,AC導入率ともに両群で差を認めなかった.
米国のNational Cancer Database(NCDB)からMIDPが膵癌の予後を改善するという報告があった15).膵体尾部癌に対するODPとMIDPをPropensity score を用いて比較し,年齢,性別,全身状態,社会的状況,腫瘍因子など幅広く調整されている.MIDPの内訳としてLDPが660例,RDP145例とRDPが18%含まれているので,純粋なLDPの評価とは言えないがおよそ結果として反映されていると思われる.MIDPはODPに比べて予後を改善した(MST:MIDP 28.0 m vs. ODP 22.1, p=0.0067).切除リンパ節個数,R0切除率,AC導入率,AC導入までの期間などいずれも有意差を認めなかった.著者らはMIDPの低侵襲性が予後改善を導いている可能性があると考察しているが,MIDPのサブグループ解析の中でRDPの予後が良く,90日死亡率もLDPと比較してRDPが良い傾向にあること(MIDP 4.7% vs. ODP 0.9%, p=0.0767)も結果に影響しているのではないかと思われる.またlimitationとしても述べられているが,RDPを行っている術者はより専門的な外科医であること,TNM因子に反映されない腫瘍因子が選択バイアスに影響している可能性を含んでおり,本研究結果のみではMIDPの癌治療としての優越性を示すエビデンスとしては弱いと言わざるを得ない.やはりRCTを行わないと真実は明らかにならないだろう.


V.腹腔鏡下膵体尾部切除における膵断端処理
膵断端からの膵液瘻の発生が膵体尾部切除の短期合併症としては最大の問題であり,その閉鎖方法についてはこれまでも様々な方法が研究されてきた.腹腔鏡手術では自ずとステープラーによる膵切離にならざるを得ないが,脾静脈を一括して離断するか,個別処理するべきかについて,わが国で多施設共同前向きランダム化比較試験が行われた.結果,脾静脈一括処理(n=157)と個別処理(n=159)を比較して,膵液瘻発生率(ISGPS Grade B/C)は28.6% vs. 27.1%と差を認めず,一括処理の非劣性が示された16).腹腔鏡(n=174)だけでなく開腹(n=142)も含まれているが,LDPにおけるステープラーの切離方法についての指針となる重要な報告であった.ステープラーの種類として黒カートリッジが99%(302/306)に使用されており,膵切離後に漿膜が裂けた症例を4.0%に認めたこと,LDPの開腹移行が14%(24/172)であったことなど参考になるデータが含まれている.本研究では脾静脈を一括切除するDPであるため,門脈上の膵頸部での切離の症例が含まれていないことに結果の解釈として留意する必要がある.また,300例にも及ぶ前向き試験で手術関連死亡がなかったことはわが国で安全に手術が行われていることを示す特筆すべき結果であると思う.
吸収性不織布でステープラーが補強されたデバイスは製品化もされており,標準的なステープラーよりも膵液瘻を減らすことが期待されてきた.有効という研究もあれば,有意差がないとするものもあり結論が出ないのが現状である.もう少し高いエビデンスが欲しいところだが,これまで得られた知見では膵液瘻を減らす効果が期待できるというのが現状である17).
他,フィブリン糊などで膵断端に付加する方法,予防的な膵管ステント,漿膜パッチなどで閉鎖する方法,膵断端との腸の吻合など様々な工夫が行われてきているが,決定的な方法は確立されていない.詳細は本稿では割愛する.
VI.良性・境界悪性に対する腹腔鏡下脾温存膵体尾部切除術
膵体尾部の膵実質内に限局し,リンパ節郭清を必要としない良性境界悪性の腫瘍に対しては,脾臓温存膵体尾部切除が考慮される.脾動静脈を温存する木村式(KT)と脾動静脈は切除し脾臓血流は短胃動静脈,左胃大網動静脈で確保するWarshaw式(WT)がある.Lap-KTは膵実質を脾動静脈から剥離する必要があり技術的要求が高い.一方でLap-WTは脾動静脈を剥離する必要がなく,脾門部で一括処理が可能であるため一見容易に思えるが,温存すべき脾門の血流に配慮する必要がありこれを怠ると脾臓梗塞を来してしまう.Lap-KTとLap-WTを比較した研究ではLap-WTは手術時間の短縮と出血量の減少をもたらすが,脾臓梗塞や胃静脈瘤の発生リスクが高かった.また,開腹手術の検討ではあるが,KTはWTと比較して,感染性合併症や膵臓瘻の発生率が低かった.これらの結果から,腹腔鏡下手術においても術後合併症を軽減するために,WTよりKTを優先するべきである18).しかし,腫瘍因子,血管の形態によって,Lap-WTはLap-KTよりも安全である可能性もあり,棄却されるべき術式ではない.どちらを選択するかは症例毎に判断する必要がある.この点,ロボット支援手術は精緻な操作が可能で,出血量を低下させ,脾臓温存率を高め,入院期間の短縮や開腹移行率を低下させるという報告もある19).一方,腹腔鏡手術の開腹移行率はロボット支援手術と同等であり,ロボット支援手術の手術時間は腹腔鏡手術より長いという報告もある.腹腔鏡技術の成熟に伴い,ロボット支援手術の優位性が必ずしも臨床的に有意な差と言うには及ばない場合,ロボット支援手術をどのように評価するかは今後の課題である.
VII.おわりに
わが国からの報告として,膵臓内視鏡外科研究会のLDP前向き登録1,197例(2016年~2018年)によると,LDP施行例の34%は膵癌であった.術後合併症(Clavien-Dindo Ⅲa以上)は17%,90日死亡率は0.3%であり,欧米の報告から比較すると極めて安全に施行されている20).残念ながら,膵癌に対するLDPの成績についてわが国から質の高い研究成果は発信されていない.これまでの観察研究から,膵体尾部癌に対するLDPはODPに対して非劣性であることは推察されるが,それを検証したランダム化第Ⅲ相比較試験はなく,膵癌診療ガイドライン2019年版においてもLDPは標準治療と位置づけられていない.
現在,いくつかの国々で膵癌に対してLDP vs. ODPの生存率を主要評価項目とする大規模なランダム化比較試験が進行中である.また,わが国でも計画されている最中であるので,今後はそれらのエビデンスを元にLDPが膵体尾部癌の標準治療としてさらなる普及を期待したいところである.
利益相反:なし
文献
1) Vollmer CM, Asbun HJ, Barkun J, et al.: Proceedings of the first international state-of-the-art conference on minimally-invasive pancreatic resection (MIPR). HPB (Oxford), 19(3): 171-177, 2017.
2) Asbun HJ, Moekotte AL, Vissers FL, et al.: The Miami International Evidence-based Guidelines on Minimally Invasive Pancreas Resection. Ann Surg, 271(1): 1-14, 2020.
3) Nakamura M, Wakabayashi G, Tsuchida A, et al.: Precision anatomy for minimally invasive hepatobiliary pancreatic surgery:PAM-HBP Surgery Project. J Hepatobiliary Pancreat Sci, 29(1): 1-3, 2022.
4) Ome Y, Seyama Y, Doi M, et al.: Laparoscopic Distal Pancreatectomy for Left-Sided Pancreatic Cancer Using the “Caudo-Dorsal Artery First Approach”. Ann Surg Oncol, 26(13): 4464-4465, 2019.
5) Ban D, Garbarino GM, Ishikawa Y, et al.: Surgical approaches for minimally invasive distal pancreatectomy:A systematic review. J Hepatobiliary Pancreat Sci, 29(1): 151-160, 2022.
6) Ban D, Nishino H, Ohtsuka T, et al.: International Expert Consensus on Precision Anatomy for minimally invasive distal pancreatectomy:PAM-HBP Surgery Project. J Hepatobiliary Pancreat Sci, 29(1): 161-173, 2022.
7) Venkat R, Edil BH, Schulick RD, et al.: Laparoscopic distal pancreatectomy is associated with significantly less overall morbidity compared to the open technique:a systematic review and meta-analysis. Ann Surg, 255(6): 1048-1059, 2012.
8) Ricci C, Casadei R, Taffurelli G, et al.: Laparoscopic versus open distal pancreatectomy for ductal adenocarcinoma:a systematic review and meta-analysis. J Gastrointest Surg, 19(4): 770-781, 2015.
9) Yi X, Chen S, Wang W, et al.: A Systematic Review and Meta-Analysis of Laparoscopic and Open Distal Pancreatectomy of Nonductal Adenocarcinomatous Pancreatic Tumor (NDACPT) in the Pancreatic Body and Tail. Surg Laparosc Endosc Percutan Tech, 27(4): 206-219, 2017.
10) Gavriilidis P, Roberts KJ, Sutcliffe RP: Comparison of robotic vs laparoscopic vs open distal pancreatectomy. A systematic review and network meta-analysis. HPB (Oxford), 21(10): 1268-1276, 2019.
11) Yang DJ, Xiong JJ, Lu HM, et al.: The oncological safety in minimally invasive versus open distal pancreatectomy for pancreatic ductal adenocarcinoma:a systematic review and meta-analysis. Sci Rep, 9(1): 1159, 2019.
12) Korrel M, Vissers FL, van Hilst J, et al.: Minimally invasive versus open distal pancreatectomy:an individual patient data meta-analysis of two randomized controlled trials. HPB (Oxford), 23(3): 323-330, 2021.
13) Sulpice L, Farges O, Goutte N, et al.: Laparoscopic Distal Pancreatectomy for Pancreatic Ductal Adenocarcinoma:Time for a Randomized Controlled Trial? Results of an All-inclusive National Observational Study. Ann Surg, 262(5): 868-873 ; discussion 873-864, 2015.
14) van Hilst J, de Rooij T, Klompmaker S, et al.: Minimally Invasive versus Open Distal Pancreatectomy for Ductal Adenocarcinoma (DIPLOMA):A Pan-European Propensity Score Matched Study. Ann Surg, 269(1): 10-17, 2019.
15) Watson MD, Baimas-George MR, Thompson KJ, et al.: Improved oncologic outcomes for minimally invasive left pancreatectomy:Propensity-score matched analysis of the National Cancer Database. J Surg Oncol, 122(7): 1383-1392, 2020.
16) Yamada S, Fujii T, Sonohara F, et al.: Safety of Combined Division vs Separate Division of the Splenic Vein in Patients Undergoing Distal Pancreatectomy:A Noninferiority Randomized Clinical Trial. JAMA Surg, 156(5): 418-428, 2021.
17) Oweira H, Mazotta A, Mehrabi A, et al.: Using a Reinforced Stapler Decreases the Incidence of Postoperative Pancreatic Fistula After Distal Pancreatectomy:A Systematic Review and Meta-Analysis. World J Surg, 46(8): 1969-1979, 2022.
18) Nakata K, Shikata S, Ohtsuka T, et al.: Minimally invasive preservation versus splenectomy during distal pancreatectomy:a systematic review and meta-analysis. J Hepatobiliary Pancreat Sci, 25(11): 476-488, 2018.
19) Rompianesi G, Montalti R, Ambrosio L, et al.: Robotic versus Laparoscopic Surgery for Spleen-Preserving Distal Pancreatectomies:Systematic Review and Meta-Analysis. J Pers Med, 11(6): 552, 2021.
20) Ohtsuka T, Nagakawa Y, Toyama H, et al.: A multicenter prospective registration study on laparoscopic pancreatectomy in Japan:report on the assessment of 1,429 patients. J Hepatobiliary Pancreat Sci, 27(2): 47-55, 2020.
PDFを閲覧するためには Adobe Reader が必要です。