日外会誌. 121(6): 613-619, 2020
特集
ECMO,補助循環装置の進歩
8.植込型補助人工心臓
|
東北大学大学院医学系研究科 心臓血管外科分野 高橋 悟朗 , 秋山 正年 , 齋木 佳克 |
植込型補助人工心臓は,重症心不全で心臓移植待機患者に対する橋渡し的治療(Bridge to Transplant)と位置づけられている.血液ポンプが体内に植え込まれ,コントローラーと電力供給体への接続コード(ドライブライン)だけが体外に導出されている構成が一般的である.体外装置が比較的小型であり,かつ,日常的な管理が簡素化されているため在宅管理が可能となっている.血液ポンプの形式は遠心ポンプと軸流ポンプに大別される.遠心ポンプは比較的低い回転数で十分な血流量を駆出でき,また,生体工学的には脈圧を形成しやすい.一方,軸流ポンプは血液ポンプ構造を小型化しやすいが,回転数を高速化する必要があり,脈圧を形成しづらい.
心臓移植待機日数の延長に伴い,植込型補助人工心臓は長期管理が必要になってきている.植込型補助人工心臓の合併症は,体外設置型に比べれば少なくなったものの,少なからず報告されており,致死的なものとしては脳梗塞・脳出血,感染症,出血があげられる.長期的管理中には,右心不全,消化管出血,大動脈弁逆流,不整脈を発症することがある.
長期管理の成績向上のためには,個々の合併症に対しての適切な対応や,治療に対するモチベーションの維持が必要であるが,そのためにはチーム医療が重要となる.多職種カンファレンスを行いつつ,個々の合併症に対する対応や,患者および介護者への精神的安定を図りながら,長期予後の改善に努める必要がある.
キーワード
植込型補助人工心臓, 心臓移植, Bridge to Transplant, 在宅管理, チーム医療
I.はじめに
2011年に心臓移植待機患者に対する機械的補助循環装置として,植込型補助人工心臓(EVARHEARTおよびDuraHeart)が保険償還され,心臓移植待機患者の在宅管理が可能となった.その後,植込型補助人工心臓の種類が増え,また,改良,小型化が進むに従い,その汎用性は増してきている.しかし,本邦の心臓移植の待機期間は現在平均5年前後となっているため植込型補助人工心臓の長期管理を余儀なくされ,しかもデバイスに起因する合併症も少なからず経験されるため,これらの問題点を一つ一つ個別に対応し,長期管理の成績向上に努めている現状にある.
II.植込型補助人工心臓を用いた治療戦略
植込型補助人工心臓治療は,末期重症心不全に対する機械的補助循環治療の選択肢の一つであるが,心臓移植適応が認められた場合にのみ保険適応が認められているため,いわば心臓移植までの橋渡し的治療(Bridge to Transplant)となっている.
重症心不全に対する心臓移植治療を希望される患者は,まず,日本循環器学会心臓移植委員会の審査を経て日本臓器移植ネットワーク(JOTNW)に登録する必要がある.心臓移植の適応は,ガイドラインで推奨される標準治療を十分施行しているにもかかわらず重度の心不全が存在することが前提になる.さらに,表1の重症度分類に従うと,原則として強心薬の持続静注が必要なprofile 2または3が適応とされる1).より軽症のprofile 4~7については現時点では適応外である.
重症心不全の急性期または急性増悪期(pro-file 1)では,臓器障害を併発することが多く,その場合他の機械的補助循環装置を装着して一旦全身状態を改善させる必要がある.臓器障害が可逆的であることが示されれば心臓移植の適応と判断され,その場合,多くの患者においてIABPや体外設置型補助人工心臓に依存している状態となっているが,植込型補助人工心臓への切り替えを実施することができる.
例外として,強心薬の持続静注に依存しない症例でも,薬物治療抵抗性の心室不整脈発作に対してICDの適正作動を頻回に繰り返す場合には植込型補助人工心臓治療が適用されることがある(modifier A).
植込型補助人工心臓は左心補助にのみ保険償還されている.右心補助が必要な場合には,体外設置型補助人工心臓で補助することになる.しかし多くの場合,一酸化窒素(NO)ガス吸入療法や強心剤の適切な使用により右心系への機械的補助を回避できている.また,術前における軽度から中等度以上の三尖弁逆流例に対して,積極的に三尖弁形成術を併施することにより,右心系への不必要な容量負荷を低減し有効な肺循環を形成でき,右心不全回避に寄与していると考えられる.
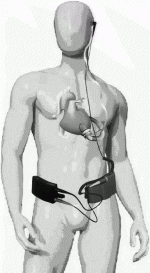
III.植込型補助人工心臓システムの構造
基本構造はすべての機種に共通している.左心室心尖部に装着されたインフローカフまたはソーイングリングに脱血管を挿入・固定して血液ポンプに接続される.この血液ポンプがポンプポケット(心尖部側の胸腔と腹腔の間を剥離したスペース),または,心嚢内に埋め込まれるため,植込型と称される.血液ポンプから送血管(人工血管)を通して主に上行大動脈へ送血される.血液ポンプに接続されたドライブラインは,皮下を通し体外へ導出され,コントローラーに接続される.コントローラーを介してポンプの流量調節やモニタリングを行い,また,AC電源やバッテリーに接続して電源供給を行っている.
IV.植込型補助人工心臓の機種
現在までに植込型補助人工心臓として保険償還された機種,および,保険償還が認められた年度を以下に示す.DuraHeart(2011年),EVAHEART(2011年),HeartMateⅡ(2012年),Jarvik2000(2014年),EVAHEART2(2017年),HeartWare®HVAD(2018年),HeartMate3(2019年).DuraHeartは2016年以降の新規植込みは中止となり,2019年に生産終了となった.Jarvik2000は2019年5月に一時的に製造販売中止となり現在に至っている.
V.現在使用されている植込型補助人工心臓
① EVAHEART2
本邦で開発された機種であり,2020年5月現在の植込み数は47例である.EVAHEARTからEVARHEART2へ改良された際に,血液ポンプはポンプ機能としての流体性能を維持したまま小型化された.重量262g,容量97.3mlの遠心ポンプであり,回転数は1,600~2,800rpmと比較的少ない(図1).圧―流量曲線から,左室―大動脈圧格差が低圧領域で極めて高い流量が得られており,最大流量は20L/min1である(図2).ただし,良好なポンプ流量を維持するためには血圧を70~80mmHgまで下げることが望ましい.また,フラットな曲線を描いており,収縮期と拡張期では流量が大きく変動しやすいため,脈圧を保ちやすい.血液ポンプ内の,回転軸の血液シール部分を冷却する独自の装置(クールシールユニット)を装備することで回転軸の摩擦熱を下げ,血栓形成を予防している.また,コントローラーには予備バッテリーが内蔵され安全性が高められている.
左心室心尖部脱血カニューレは,通常左心室内に挿入する筒状の形のものが一般的であったが,2019年に導入されたダブルカフチップレスカニューレでは左室内突出部がなくなった.そのため,左室内突出部周囲のwedge thrombus形成を防ぎ,血栓塞栓症の軽減が期待される.また,左室内の脱血管の位置異常によるサッキングを防ぐ効果があり,比較的左室の小さい症例にも適応しやすくなった.
② HeartWareⓇHVAD
HeartWareⓇHVAD(以下,HVAD)は,本邦での承認は2018年であったが,それまでに米国,ヨーロッパ他,47ヶ国において累計17,000例以上の使用実績がある.重量160g,外形50mm,容量50mlと小型ポンプのため血液ポンプは心嚢内に収まり,小柄な体格の患者にも適応が拡がっている(図3).磁気浮上型の遠心ポンプであり,インペラ(羽根車)が磁気および流体動圧浮上原理により軸部と非接触である低摩耗システムのため,血球成分へのダメージが低減されると期待されている.回転数は2,400~3,200rpmが推奨されており,小型ながら最大出力は10L/minである.ドライブラインは径4.5mmと他の機種に比べて細く,皮膚貫通部感染の軽減が期待される.コントローラーに予備バッテリーは内蔵されていない.
治験では脳出血の発症が多いことが危惧されたが,十分な降圧を図ることで回避できたとの報告がある2).
③ HeartMateⅡ
海外で最も普及した機種であり,本邦でも2013年に承認されて以降600例以上に植え込まれた.直径35mm,長さ7cm,重量400gの軸流ポンプであり,ローター(羽根車)を高速回転することで血液を送り出している.回転数は6,000~15,000rpmまで調節可能であるが,通常8,200~9,200rpmで運用することが多い.圧―流量曲線では,遠心ポンプと比較すると,曲線はやや急峻であり,ポンプ流量は3~10L/minとなっている(図2).他の機種に比べて回転数が多いため,駆動装置内の溶血や凝固因子の消費が問題となりやすい.
2019年に,小型化,軽量化された新しいシステムコントローラー(ポケット型)への変更が可能になり,新しいコントローラー内には予備バッテリーが装備されるようになった.また,パワーモジュールを介したAC電源以外に,長時間の電源供給ができるモバイル電源ユニットを使用できるようになった.
④ HeartMate3
HeartMateⅡの後継機であるが,軸流ポンプではなく,完全磁気浮上型の遠心ポンプである3)(図3).磁気浮上型ディスクのため軸受けがなく,ポンプ内の流路が広く設定されている.また,ポンプ回転数が350msの間に規定回転数から2,000rpm減速後,4,000rpm増加し再び規定回転数に戻る独自のアルゴリズムとなっていることから,血液停滞を防止しポンプ内部の血栓形成を防ぎ,かつ,脈圧を出すことで消化管出血を減少させることが期待されている.
HeartMateⅡとの比較試験で,ポンプ不具合に対する再手術率や血栓塞栓症の発症率が少なく,6カ月後以降の転帰は良好であったと報告されている4).
⑤ Jarvik2000
重量90g,直径26.4mm,容積25mlの軸流ポンプであり,成人用の補助心臓の中では最もサイズが小さい.最大流量は8.5L/minである.回転数設定は1~5を選択するが,通常2または3(回転数9,000~10,000rpm,流量2~5L/min)で運用することが多い.
2018年11月に,電源接続部として耳介後部コネクターを用いたPAモデルが保険医療として承認された(図4).これは,ドライブラインを後耳介部まで皮下を誘導し,先端のコネクターピンを頭蓋骨に固定したうえで皮膚を貫通させておき,そこでコントローラーへの接続ラインをつなげる構造となっている.皮膚貫通部を血流豊富な部位に強固に固定することで感染のリスクを軽減できる利点がある.
コントローラーに予備バッテリーは組み込まれておらず,また,AC電源へ接続ができないため,常時バッテリーに接続する必要がある.バッテリーの充電に関する異常が報告され,2019年9月以降販売停止となっている.



VI.植込型補助人工心臓の管理について
① 在宅管理
植込型補助人工心臓では体内の駆動装置と体外のコントローラーを結ぶドライブラインが皮膚を貫通し体外に導出されている唯一のコードとなっている.ドライブラインは直径4.5~7.8mmと細いため,皮膚貫通部の消毒は簡便であり,体外設置型に比べ,感染予防が容易である.消毒する訓練を,本人,家族が行い,装置の使用方法を理解できれば,在宅管理が可能となる.
在宅管理ではバッテリー管理が非常に重要となる.一部の機種を除いて安静時にはモニターに接続されたAC電源等で電力を継続的に供給できるが,歩行時にはバッテリーに切り替えて移動することになる.コントローラーに内蔵バッテリーがない場合,バッテリー2系統を同時に外せば駆動停止となり突然死の原因になるため,バッテリーの電池消耗に細心の注意を払う必要がある.
② 抗凝固療法および抗血小板療法
抗凝固療法はPT-INR2.0~3.0とかなり強力に管理する必要がある.抗血小板療法は機種により投与量に差はあるものの,すべての機種に必要とされている.
③ 植込型補助人工心臓の合併症
脳梗塞,脳出血の発症は致死的になりうる.脱水,感染,凝固コントロール異常等を契機に,補助人工心臓装置周囲(脱血管挿入部,血液ポンプ内)や,開放しなくなった大動脈弁周囲に血栓が形成され塞栓源となり脳梗塞を発症することがある.また,強力な抗凝固療法を行っているがゆえに,梗塞後出血を併発しやすい.
感染症の合併症で最も多いのはドライブライン皮膚貫通部の局所感染である.感染の制御が難しく,深部に波及した場合にはポンプポケット感染となりうる.デバイス交換を要し,敗血症等を併発すれば時には死に至ることが想定される.
慢性期においては消化管出血が問題になる.これは,抗凝固療法を強化していることに加え,脈圧の消失による消化管の動静脈奇形形成5),von Willbrand因子がポンプ内のshear stressにより分断されることで生じる二次性von Willbrand病6)に起因すると考えられている.
その他,右心不全,大動脈弁逆流,不整脈を発症することがある.
VII.チーム医療
植込型補助人工心臓により在宅管理が可能となったものの,近年の移植待機日数の延長に伴い,長期の在宅治療となることもあり,患者本人はもとより介護者(家族または同居人)のデバイス操作への習熟や植込型補助人工心臓治療への十分な理解と支援が重要となる.
患者および介護者への支援のためには,チーム医療が必要とされる.医師(心臓血管外科医,循環器内科医,精神科医等),看護師(人工心臓管理技術認定士を含む病棟,移植コーディネーター,リエゾン専門看護師,皮膚・排泄専門看護師等),人工心臓管理技術認定士を含む臨床工学技士,栄養士,理学療法士・作業療法士,薬剤師,臨床心理士,ソーシャルワーカー等多職種が関わる必要があり,多職種によるカンファレンスで,患者の状態や治療方針,問題点などケアにかかわるメディカルスタッフ間での情報共有がなされていることが重要である.すべてのスタッフが自分の役割を果たして,初めて患者のQOLは向上する.
VIII.おわりに
植込型補助人工心臓により心臓移植待機患者の在宅管理が可能になり,日常生活におけるQOLは,体外設置型補助循環装置に比べて飛躍的に改善された.しかし,長期管理を余儀なくされており,本邦での心臓移植件数のさらなる増加が望まれている.また,合併症をいかに制御できるかが長期成績を改善するために重要であるため,チップレスカニューレやPAモデルの導入等の合併症を防ぐための改善が今後さらに発展されることを期待したい.
最後に,悪性腫瘍の既往や高齢などが原因で移植適応基準に合致しない場合でも,恒久的な植込型補助人工心臓を装着することがあり,destination therapy(DT)とよばれている.DTは米国では積極的に行われており,近年わが国での導入が検討されている.近い将来,DT目的での植込型補助人工心臓装着患者が増加することになれば,より多くの医療従事者が先進的な医療機器である植込型補助人工心臓に習熟することが求められるようになると思われる.
利益相反:なし
文献
1) 日本循環器学会/日本心不全学会合同ガイドライン. 急性・慢性心不全診療ガイドライン(2017年改訂版).
2) Milano CA, Rogers JG, Tatooles AJ, et al.: ENDURANCE Investigators:HVAD:The ENDURANCE Supplemental Trial. JACC Heart Fail, 6: 792-802, 2018.
3) Mehra MR, Naka Y, Uriel N, et al.: A Fully Magnetically Levitated Circulatory Pump for Advanced Heart Failure. N Engl J Med, 376: 440-450, 2017.
4) Colombo PC, Mehra MR, Goldstein DJ, et al.: Comprehensive analysis of stroke in the Long-Term Cohort of the MOMENTUM 3 Study. Circulation, 139: 155-168, 2019.
5) Demirozu ZT, Radovancevic R, Hochman LF, et al.: Arteriovenous malformation and gastrointestinal bleeding in patients with the HeartMate II left ventricular assist device. J Heart Lung Transplant, 30(8): 849-853, 2011.
6) Suarez J, Patel CB, Felker GM, et al.: Mechanisms of bleeding and approach to patients with axial-flow left ventricular assist devices. Circ Heart Fail, 4(6): 779-784, 2011.
PDFを閲覧するためには Adobe Reader が必要です。