日外会誌. 121(2): 190-195, 2020
特集
臓器移植の現状と展望
7.小腸移植
|
大阪大学 小児成育外科 上野 豪久 |
短腸症や腸管運動障害などの腸管不全は,静脈栄養の発達により生命予後は著しく改善した.しかしながら,中枢ルートの喪失や,腸管不全関連肝障害(IFALD)によって生命の危機にさらされることも少なくない.その場合の治療として小腸移植が必要となるが,本邦では2018年末までに30例に過ぎず一般的な治療とは言えない.2018年に小腸移植は脳死,生体ともに保険適用となり,2019年には移植後でも身体障害者1級が継続できるようになり,経済的負担も取り除かれた.しかしながらまだ課題は多い.長期のグラフトの成績の改善のために,抗ドナー抗体などの臨床研究や,拒絶の制御などの基礎研究を行う必要がある.小腸移植は,腸管リハビリテーションプログラムの一環として,GLP-2などの薬物を使用した内科的治療,Serial Transverse Enteroplasty(STEP)などの外科的治療などとともに検討し,移植の時機を逸しないようにする.日本小腸移植研究会も2019年より日本腸管リハビリテーション・小腸移植研究会と名前を新たにし腸管不全に対する総合的な治療の一部という位置づけを明確にした.そして,年少児の場合には腸管不全に肝不全を伴う場合も多く,海外においては肝小腸同時移植,多臓器移植が実施されている.今後,本邦でも肝不全を伴った患者のために多臓器移植を実施できる体制をとる必要があるだろう.
キーワード
短腸症, 腸管運動障害, 腸管不全, カテーテル感染症, 腸管不全関連肝障害
I.はじめに
短腸症やヒルシュスプルング病類縁疾患に代表される腸管運動障害などの腸管不全に対しては,GLP-2などの薬物を使用した内科的治療,Serial Transverse Enteroplasty(STEP)などの外科的治療を行うが,最終的な治療として小腸移植がある.関係者の努力のおかげで一昨年脳死,生体小腸移植ともに保険適用となり,また昨年には小腸移植後でも身体障害者1級が継続できるようになった.2018年4月に保険適用となったのちに,2018年末までにすでに3例が実施された.本稿では小腸移植の現状と課題について紹介する.
II.海外での現状
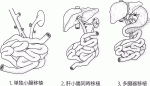
2019年7月にフランス パリで発表された国際小腸移植レジストリーによると,小腸移植は2019年6月までに全世界で4,103例が行われた1).小腸移植を実施した施設は世界で97施設に上る.小腸移植には大きく分けると1.単独小腸移植,2.肝小腸同時移植,3.多臓器移植の三つの術式がある2)3)(図1).術式別では単独小腸移植が1,842例,肝小腸同時移植が1,251例,多臓器移植が1,010例行われた.また,そのうち半数が小児例で2,096例であった.年間症例数は150例程度の移植が行われているが,その多くは北米とヨーロッパであり,日本を含めたアジア地区は小腸移植の空白地帯となっている.適応としては60%以上が短腸症であり,移植小腸の生着率は1年で70%台,5年で40%台程度であった.小腸移植の成績は近年改善がみられておらず短期的な成績は良好なものの,長期成績については満足できる水準とは言えない.
III.本邦の現状
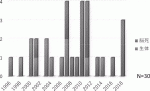
2018年12月末までに,本邦では27名に対して30例の移植が実施された4)(図2).ドナー別では脳死小腸移植が17例,生体小腸移植が13例であった.2018年4月に保険適用となったのち,立て続けに実施され,2018年は3例の脳死小腸移植が実施された.3例はすべて短腸症で,2歳以下の小児2例と,成人が1例であった.特に,小児2例については肝不全も伴っており,逐次的に肝移植も実施されていた.小腸移植後待機中に静脈栄養を行わなければならないこともあり,移植肝への影響を考えると肝小腸同時移植が望ましい.
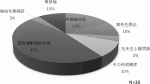
本邦での小腸移植は小児期の疾患に基づくものが多いが,19歳以上の成人症例が4割近くを占める.また,2歳以下の症例は少数にとどまっている.これは,依然として小児のドナーが極めて少ないことから,学童期,成人期まで待機した患者のみ移植を受けることができるのが原因と考える.4割が小腸の大量切除による短腸症であったが,海外に比べるとやや腸管運動機能障害によるものが多く全症例の半数を占めている.また,小腸移植患者の増加に伴い,移植後グラフト不全に伴う再移植も増加してきた(図3).グラフトの回盲弁は3分の1の患者が回盲弁付きのグラフトを使用しているが,国際的には60%程度となっている.
小腸移植の成績を(図4)みると,患者の1年生存率は89%,5年生存率は72%,10年生存率は54%となっている.グラフト生着率も1年生着率,5年生着率,10年生着率がそれぞれ82%,60%,41%と同様な成績を示している.短期成績についてはほかの臓器移植と遜色のない値まで近づいているが,患者生存率,グラフト生着率については10年の長期生存,生着が低下しており,海外と同様に短期成績は改善したものの長期成績は満足できない結果となっている.
18歳以下の小児症例と成人症例とで比較したところ,10年生存率が68%と36%,また10年グラフト生着率が58%と16%と小児のほうが長期成績は海外と同様に良いと考えられる.
導入免疫療法を行うことが小腸移植では一般的であるが,抗胸腺ガンマグロブリン(rATG)はほかの疾患に比較して良好な成績を保っている.このことからもrATGを用いた導入療法が妥当だと考えられる.
移植後1年以上経過した生存者13名のうちグラフトを摘出した2名を除いた,グラフト生着患者の小腸移植の効果は全員が部分的に経静脈栄養から離脱し,約70%が経静脈栄養から完全に離脱することが可能であった.常時補液を必要とする患者も約30%にとどまり,移植小腸が生着すれば腸管機能は維持されていることがわかった.
しかしながら今後の課題として,ヒルシュスプルング病類縁疾患などでは自己結腸が使用できない場合もあるため回腸瘻による排液過多を解決する必要がある.
小腸移植の効果には,生命予後の改善だけではなくQOLの改善も重要なものである.約6割の患者がストマからの離脱を達成しており,ストマ管理が不要になっている.小腸移植患者のQOLをPSで評価すると約9割の患者のPSが1以下であり,小腸移植後患者のQOLが極めて良好であることがわかる.

IV.今後の展望
小腸移植が保険診療となった今,今後の展望としては,現在ある課題を解決していくことにある.現在の課題としては小腸移植の長期成績を改善すること,適応となる患者を適切に移植施設に紹介すること,肝小腸移植,多臓器移植の体制を作ることであろう.
小腸移植を安全に実施していくためには国内では手に入らない,もしくは保険適用になっていないさまざまな薬剤が必要である.小腸移植の成績の向上には拒絶反応の制御が重要である.急性拒絶反応は現在でも半数近くの患者が経験する1)5).移植小腸は拒絶反応を起こしやすいことから導入免疫抑制療法が使用されている.これにはIL-2 レセプター抗体であるBasiliximab(シムレクトⓇ)や,抗胸腺抗体である抗胸腺ガンマグロブリン(サイモグロブリンⓇ)などがあげられる.短期成績は導入療法の改良によって大きく改善した6).しかしながら長期的には15%程度の患者に慢性拒絶が発生し移植腸管を失うことも少なくない7).また,近年は抗ドナー抗体が急性拒絶や慢性拒絶に関与していることがわかってきており,その制御が重要な課題となっている8)9).海外では抗体関連拒絶制御の観点からRituximab(リツキサンⓇ)も使用されている例もあるが国内ではまだ使用経験が少ない.現在,Rituximab術前投与の臨床研究が始まっており今後の成績改善が期待されている.また腎機能保護のために維持免疫抑制療法としてはSirolimus(ラパマイシンⓇ)やEverolimus(サーティカンⓇ)なども必要な薬剤である.感染症では,移植小腸がサイトメガロ腸炎を起こした場合には腸管機能が著しく落ちることがあることから,その予防や治療としての抗CMVグロブリン(CytogamⓇ)も必要とされる.もちろん,長期成績の改善のためには拒絶のメカニズムの解析も含めて基礎的な研究はまだまだ必要である.
小腸移植は難治性腸管不全の患者のうち中心静脈栄養で生命維持を行うことが困難,または著しく生活の質が落ちている患者が対象となる10)
~
13).また,小腸移植は腹部症状の改善や生活の質を改善していることが明らかになっている14).具体的には下記の通りである.
1.中心静脈栄養を行う中枢ルートがなくなることが予測されること.
2.肝障害を始め他の臓器に障害がもたらされて,それが進行していること.
3.生活の質が著しく落ちていること.
しかしながら,小腸移植のタイミングの評価は難しく,われわれも小腸移植のために紹介を受けた時にはすでに手遅れであることが多々ある.
脳死小腸移植の待機患者は2019年9月30日現在6名にとどまっている.しかしながら2011年度の厚生労働科学研究費による調査によると,小腸移植の潜在的待機患者は全国で200名弱と推計されており,小腸移植が必要な患者が適切に移植施設に紹介されることが必要であると考えられる.実際,小腸移植は単独の治療ではなくて,腸管不全に対する内科的,外科的治療も含めた腸管リハビリテーションの一環としてあるべきであり,早期に多職種を含めた腸管不全チームによって治療がなされるべきである.国際的にも2019年から腸管不全登録(Intestinal failure Registry)の構築が始まった.海外と同様に腸管不全患者の登録を行い病状の段階に応じて,内科的治療,外科的治療,小腸移植と適切な対応をとることが必要であろう.
IFALDは経静脈栄養の重要な合併症である.脂肪肝から肝機能上昇,黄疸をきたし,進行例においては肝線維化から肝硬変に至り生命を脅かすことになる.海外ではω―3系油脂を多く含んだオベガベンⓇなどの投与により一定の予防効果が得られているが,本邦では販売もしくは保険収載されていないことが問題となっている.そのため,肝小腸同時移植を必要とする患者が存在する.そのような場合,肝移植と小腸移植を合わせて行うため生体肝移植を先行して行い,その後に脳死小腸移植を行った異時性肝・小腸移植が実施されている.しかし,小腸移植後待機中に経静脈栄養を行わなければならないこともあり,移植肝への影響を考えると肝小腸同時移植が望ましい.2011年よりは肝臓と小腸を同時に登録し肝臓の提供を受けられれば優先的に小腸の提供を受けられることとなった.小腸移植の待機においては肝不全の有無が予後を規定するため,肝不全を伴う場合には肝小腸移植も海外では一般的に行われている.肝小腸同時移植においては肝臓の提供については通常肝移植に従って順位が決められるため,慢性肝障害であるIFALDでは加点を得ることができず脳死ドナーを待機することが困難である.脳死ドナーにおいては肝小腸同時移植待機の場合の予後を明らかにし,肝臓の臓器提供において加点されることが望ましい.
小さな乳幼児では手技的に実施することが困難であることから,十二指腸や膵臓も含んだ多臓器移植が海外では一般的に行われているが,本邦では認められていないことは小児領域では大きな問題となっている.ヒルシュスプルング病類縁疾患のような腸管運動障害の患者では部分多臓器移植が必要であるが,こちらも同様に現状では道が開かれていない.
小児の臓器提供も少しずつ増加してきたため,今までは渡航移植しか方法のなかったこのような患児に対して国内で小腸移植を行って救命することが可能になったため,今後は乳幼児の腸管不全を救命するために多臓器移植の実施に向けて動いていかなければならない.現在,小児からの臓器提供が可能になっているが,小児科とも協調していきながら乳幼児も含めた小児の臓器提供ができる環境を整えていく必要がある.
V.おわりに
関係者の努力のおかげで2018年4月に小腸移植は脳死,生体ともに保険適用となり,また2019年4月には小腸移植後でも身体障害者1級が継続できるようになった.その為,経済的な障害がなくなったことは腸管不全の患者にとって福音である.
しかしながら,年少児の場合には腸管不全に肝不全を伴う場合も多く,海外においては肝小腸同時移植,多臓器移植が実施されている.今後,本邦でも肝不全を伴った患者のために多臓器移植を実施できる体制をとる必要があるだろう.
国際的には国際小腸移植学会(Intestinal Rehabilitation and Transplant Association)が国際リハビリテーション・小腸移植学会(Intestinal Transplant Association)と小腸移植は腸管不全の治療の一部であるという位置づけになったことを見習い,本邦でも腸管不全の治療成績向上のために,本年度から日本腸管リハビリテーション・小腸移植研究会と名前を新たにし,小腸移植も含め腸管不全の治療全体の体制整備を目指すこととなった.また,小腸移植に限らず脳死臓器提供が増えてきて臓器移植が一般治療になった現在では,人材の育成が継続して小腸移植を実施していくためのカギとなるであろう.
利益相反:なし
文献
1) Grant D, Abu-Elmagd K, Mazariegos G, et al.: Intestinal transplant registry report:global activity and trends. Am J Transplant, 15(1): 210-219, 2015.
2) Ueno T, Fukuzawa M: Current status of intestinal transplantation. Surg Today, 40(12): 1112-1122, 2010.
3) Fishbein TM: Intestinal transplantation. N Engl J Med, 361(10): 998-1008, 2009.
4) 上野 豪久,松浦 俊治,奥山 宏臣,他:本邦小腸移植症例登録報告.移植,2019.in press.
5) Smith JM, Skeans MA, Horslen SP, et al.: OPTN/SRTR 2013 Annual Data Report:intestine. Am J Transplant, 15(Suppl 2): 1-16, 2015.
6) Trevizol AP, David AI, Dias ER, et al.: Intestinal and multivisceral transplantation immunosuppression protocols--literature review. Transplant Proc, 44(8): 2445-2448, 2012.
7) Abu-Elmagd KM, Costa G, Bond GJ, et al.: Five hundred intestinal and multivisceral transplantations at a single center:major advances with new challenges. Ann Surg, 250(4): 567-581, 2009.
8) Abu-Elmagd KM, Wu G, Costa G, et al.: Preformed and de novo donor specific antibodies in visceral transplantation:long-term outcome with special reference to the liver. Am J Transplant, 12(11): 3047-3060, 2012.
9) Cheng EY, Everly MJ, Kaneku H, et al.: Prevalence and Clinical Impact of Donor-Specific Alloantibody Among Intestinal Transplant Recipients. Transplantation, 101(4): 873-882, 2017.
10) Pironi L, Arends J, Bozzetti F, et al.: ESPEN guidelines on chronic intestinal failure in adults. Clin Nutr, 35(2): 247-307, 2016.
11) Harrison E, Allan P, Ramu A, et al.: Management of intestinal failure in inflammatory bowel disease:small intestinal transplantation or home parenteral nutrition? World J Gastroenterol, 20(12): 3153-3163, 2014.
12) Buchman AL, Scolapio J, Fryer J: AGA technical review on short bowel syndrome and intestinal transplantation. Gastroenterology, 124(4): 1111-1134, 2003.
13) Kaufman SS, Atkinson JB, Bianchi A, et al.: Indications for pediatric intestinal transplantation:a position paper of the American Society of Transplantation. Pediatr Transplant, 5(2): 80-87, 2001.
14) Pironi L, Baxter JP, Lauro A, et al.: Assessment of quality of life on home parenteral nutrition and after intestinal transplantation using treatment-specific questionnaires. Am J Transplant, 12(Suppl 4):S60-S66, 2012.
PDFを閲覧するためには Adobe Reader が必要です。