日外会誌. 121(2): 184-189, 2020
特集
臓器移植の現状と展望
6.膵・膵島移植
|
藤田医科大学 医学部移植・再生医学講座 伊藤 泰平 , 剣持 敬 , 會田 直弘 |
インスリン分泌能が著しく低下した1型糖尿病に対し,膵臓移植もしくは膵島移植の適応が検討される.膵臓移植は保険診療であるのに対し,膵島移植は先進医療Bとして多施設共同臨床試験を行っている.
2000年から2017年末まで施行された脳死膵臓移植は327例(うち心停止ドナー:3例)であり,術式の内訳は膵腎同時移植(SPK)が267例,腎移植後膵移植(PAK)が43例,および膵単独移植(PTA)が17例であった.移植後の1,3,5年患者生存率は96.4%,96.0,94.8であり,膵グラフト生着率は1,3,5年でそれぞれ86.3%,80.2,74.9と良好であった.
一方,膵島移植は2012年より先進医療Bとして多施設共同臨床研究が開始され,2013年からは脳死ドナーからの膵島移植も開始された.脳死ドナーから膵提供により,膵島分離成績は向上し,より多くの膵島移植が行われるようになった.膵島移植後の成績に関しては,臨床試験終了後報告される予定である.
膵臓移植の約80%はSPKであり,待機患者の生命予後改善の観点から,SPK待機患者では膵臓移植が優先されるべきである.一方,膵島移植が保険診療化された場合,現時点での成績と患者生命予後,治療の侵襲性を考慮し,腎不全を伴わない1型糖尿病患者には膵島移植が第一選択としても良いのではないかと考えられた.
キーワード
膵臓移植, 膵島移植, グラフト生着, 脳死臓器提供, allocation
I.はじめに
インスリン分泌能が著しく低下した1型糖尿病に対し,膵臓移植もしくは膵島移植の適応が検討される.膵臓移植は「臓器の移植に関する法律」,いわゆる臓器移植法の法整備下で保険診療化された医療であるのに対し,膵島移植は現時点では再生医療等安全性確保法の第1種に区分された医療で,保険収載を目指した先進医療Bとして多施設共同臨床試験を行っているのが状況である.膵臓移植と膵島移植の比較を表1にまとめた.膵臓移植は全身麻酔を要する開腹手術となり,比較的合併症も多く高侵襲な治療方法と言えるが,その80%以上が膵腎同時移植で,移植後の生命予後は飛躍的な改善が期待される1).一方,膵島移植は分離した膵島組織を経門脈的に肝内へ注入する組織移植で,局所麻酔のみで行うことが可能であるため低侵襲であるが,2000年初頭はその長期成績に問題があった2).
本稿では膵臓移植,膵島移植それぞれの現状を紹介するとともに,今後の両移植治療のallocationについても検討したい.

II.膵臓移植の現状
膵臓移植にはドナーの区分から生体・心停止・脳死膵臓移植の三つがあるが,生体膵臓移植は2004年以降国内で27例行われた後3),特に臓器移植法の改正から脳死臓器提供が増え,2014年以降は行われていない.一方,心停止膵臓移植は,2000年以前は国内の脳死臓器提供が進まない状況下で一部の施設で積極的に行われたが4),法整備後の2000年以降は3例施行されたのみである.本稿では2000年から2017年末まで施行された3例の心停止ドナーを含む脳死膵臓移植に関して現状を報告する.
日本膵・膵島移植研究会膵臓移植班は膵臓移植に関する年次報告を毎年行っている5).それによると2000年から2017年末まで施行された3例の心停止ドナーを含む脳死膵臓移植は327例であり,臓器提供事例499例の65.5%を占める.術式の内訳は膵腎同時移植(SPK)が267例,腎移植後膵移植(PAK)が43例,および膵単独移植(PTA)が17例であり,SPKが約80%を占める.ドナーは40歳以上のドナーが192例(58.7%)を占め,ドナーの死亡原因は脳血管障害が163例(50%)と最も多く,いわゆるマージナルドナーが多い.一方,レシピエントは移植前の糖尿病歴が平均28.1年,SPKにおける透析歴は平均7.22年で,非常に長い病悩期を有する.またレシピエントの平均待機期間は1,287日と法改正以降少しずつ短縮されつつあるが,依然として約3年半と長い.
このように,本邦はマージナルなドナーが多く,レシピエントの病悩期も長いが,膵臓移植後の成績は比較的良好である.移植後の1,3,5年患者生存率は96.4%,96.0,94.8であった.一方,膵グラフト生着率は1,3,5年でそれぞれ86.3%,80.2,74.9であり,SPKにおける腎グラフト生着率は,1,3,5年で,それぞれ94.1%,93.7,90.9であった(図1).しかしながら,これを術式別に膵グラフト生着率を見ると(図2),SPKでは1,3,5年でそれぞれ91.9%,89.4,87.0であるのに対して,PAKでは88.3%,67.8,56.7,PTAでは63.0%,42.0,31.5と,PAKとPTAの長期成績不良が本邦の課題である.


III.膵島移植の現状
2000年にカナダのアルバータ大学からのいわゆるエドモントンプロトコールによる膵島移植成績の報告6)は,臨床膵島移植を各国が進めるきっかけとなり,本邦も2004年に1例目の臨床膵島移植を行った7).しかしながら,エドモントンプロトコールによる膵島移植は長期成績では膵臓移植に大きく劣り8),代わりに抗ヒト胸腺細胞ウサギ免疫グロブリン製剤と抗TNF-α阻害剤を導入療法に使用したCITプロトコールが現在の主流となっている9)
~
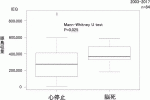
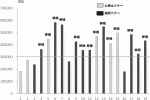
11).2016年に報告されたCITプロトコールによる多施設共同研究の結果12)では,Primary end point(HbA1c level<7.0%)の達成率が1年:87.5%,2年:71%と非常に有用であることが報告された.本邦でも2012年より先進医療Bとして同プロトコールを応用した多施設共同臨床研究が開始された.また以前の膵島移植は心停止ドナーからの膵提供がほとんどであったが,2013年からは膵臓移植に使用されない脳死ドナーからの膵提供を受け,膵島移植が行われるようになった13)14).脳死ドナーから膵提供により,膵島分離成績は向上し(図3),膵島移植条件(膵島収量≧レシピエント体重(kg)当たり5,000IEQ)を満たす頻度が増加,より多くの膵島移植が行われるようになった(図4).
なお,膵島移植後の成績に関しては,先進医療Bによる臨床試験中のため,本稿に結果を掲載することができない.試験終了後,成果を報告する予定である.
IV.膵・膵島移植の今後の展望
脳死臓器提供の増加から,本邦の膵臓移植数は増加した.しかし,依然として待機期間は長く,さらなる膵臓移植数の増加が望まれる.一方,以前と比べると高齢などのマージナルドナーからの膵臓移植は回避される傾向があり,それらの膵臓が膵島移植に用いられるようになってきた.今後,膵島移植の保険診療化も見越して,膵臓移植と膵島移植のallocationが一つの課題となる.
膵臓移植の約80%はSPKであり,待機患者の生命予後改善の観点から,SPK待機患者では膵臓移植が優先されるべきである.一方,PAK,PTAでは長期の膵グラフト生着率が著しく不良で,近年の諸外国の膵島移植成績はむしろそれらを上回る15).ただし,筆者ら16)の検討では,PAKに関しては抗ヒト胸腺細胞ウサギ免疫グロブリン製剤を導入時に使用することにより,SPK同様のグラフト生着率が期待できることが明らかとなった.従って,PAKに関しては患者が膵臓移植・膵島移植の治療を良く理解し,選択出来るようになることが望まれる.PTAに関しては,残念ながら抗ヒト胸腺細胞ウサギ免疫グロブリン製剤を使用しても,グラフト生着の改善は認められない.膵島移植が保険診療化された場合,現時点での成績と患者生命予後に与える影響,治療の侵襲性などを考慮し,腎不全を伴わない1型糖尿病患者には膵島移植が第一選択としても良いのではないかと思われる.
V.おわりに
本邦における膵臓移植,膵島移植の現状を述べるとともに,今後のallocationへの展望を述べた.膵臓移植,膵島移植ともに脳死臓器提供増加から得られた恩恵は非常に大きく,今後,益々の脳死臓器提供増加が望まれる.
この論文の内容の一部は,「膵臓移植に関する実施要綱」(第四版)に記載したものである.
利益相反:なし
文献
1) Gruessner RW, Sutherland DE, Gruessner AC:Mortality assessment for pancreas transplants. Am J Transplant, 4(12): 2018-2026, 2004.
2) Anazawa T, Saito T, Goto M, et al.: Long-term outcomes of clinical transplantation of pancreatic islets with uncontrolled donors after cardiac death: a multicenter experience in Japan. Transplant Proc, 46(6): 1980-1984, 2014.
3) Kenmochi T, Asano T, Maruyama M, et al.: Living donor pancreas transplantation in Japan. Journal of hepato-biliary-pancreatic sciences, 17(2): 101-107, 2010.
4) Tojimbara T, Teraoka S, Babazono T, et al.: Long-term outcome after combined pancreas and kidney transplantation from non-heart-beating cadaver donors. Transplant Proc, 30(7): 3793-3794, 1998.
5) 浅岡 忠史,伊藤 壽記,剣持 敬,他:本邦膵移植症例登録報告(2018).移植,53(2-3):139-147,2018.
6) Shapiro AM, Lakey JR, Ryan EA, et al.: Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med, 343(4): 230-238, 2000.
7) Saito T, Ise K, Sato Y, et al.: The start of an islet transplantation program in Japan. Transplant Proc, 37(8): 3424-3426, 2005.
8) Ryan EA, Paty BW, Senior PA, et al.: Five-year follow-up after clinical islet transplantation. Diabetes, 54(7): 2060-2069, 2005.
9) Bellin MD, Barton FB, Heitman A, et al.: Potent induction immunotherapy promotes long-term insulin independence after islet transplantation in type 1 diabetes. Am J Transplant, 12(6): 1576-1583, 2012.
10) Matsumoto S, Takita M, Chaussabel D, et al.:Improving efficacy of clinical islet transplantation with iodixanol-based islet purification, thymoglobulin induction, and blockage of IL-1beta and TNF-alpha. Cell Transplant, 20(10): 1641-1647, 2011.
11) O’Connell PJ, Holmes-Walker DJ, Goodman D, et al.: Multicenter Australian trial of islet transplantation: improving accessibility and outcomes. Am J Transplant, 13(7): 1850-1858, 2013.
12) Hering BJ, Clarke WR, Bridges ND, et al.: Phase 3 Trial of Transplantation of Human Islets in Type 1 Diabetes Complicated by Severe Hypoglycemia. Diabetes Care, 39(7): 1230-1240, 2016.
13) 伊藤 泰平,明石 優美,剣持 敬,他:膵島移植症例登録報告(2018).移植,53(2-3): 149-156,2018.
14) Ito T, Kenmochi T, Kurihara K, et al.: The Effects of Using Pancreases Obtained from Brain-Dead Donors for Clinical Islet Transplantation in Japan. Journal of Clinical Medicine, 8(9): 1430-1439, 2019.
15) Barton FB, Rickels MR, Alejandro R, et al.: Improvement in outcomes of clinical islet transplantation:1999-2010. Diabetes Care, 35(7): 1436-1445, 2012.
16) Ito T, Kenmochi T, Aida N, et al.: Effectiveness of Preceding Solo Kidney Transplantation for Type 1 Diabetes With End-Stage Renal Failure. Transplant Proc, 50(10): 3249-3254, 2018.
PDFを閲覧するためには Adobe Reader が必要です。