日外会誌. 124(5): 422-430, 2023
特集
外科医によるこれからの癌薬物療法―最新知識と安全で効果的な遂行のコツ―
7.肺癌における周術期薬物療法
|
1) 国立がん研究センター東病院 呼吸器内科 田中 悠1) , 善家 義貴1) , 後藤 功一1) , 坪井 正博2) |
非小細胞肺癌(NSCLC)の周術期薬物療法は殺細胞性抗がん剤を用いた術後補助化学療法が中心であった.近年,進行期NSCLCの治療に基づいて分子標的治療薬や免疫チェックポイント阻害薬を用いた周術期治療の開発が急速に進み,病理病期Ⅱ-Ⅲ期,EGFR遺伝子変異陽性NSCLCに対する術後補助療法としてオシメルチニブ,PD-L1陽性NSCLCに対する術後補助療法としてアテゾリズマブ,更に,病理病期ⅠB-Ⅲ期,切除可能NSCLCに対する術前のニボルマブ+プラチナ併用化学療法があらたに承認された.本稿では,目覚ましく進歩する周術期治療の現在のエビデンスと問題点について整理し,現在,われわれが取り組んでいる周術期の個別化医療の発展と新たなバイオマーカーの確立を目指した大規模前向き観察研究(LC-SCRUM-Advantage/MRD)について紹介する.
キーワード
非小細胞肺癌, 周術期治療, 分子標的薬, 免疫チェックポイント阻害薬, LC-SCRUM-Advantage/MRD
I.はじめに
非小細胞肺癌(NSCLC)に対する周術期の標準治療は,テガフール・ウラシル(UFT)もしくはシスプラチン(CDDP)併用化学療法を用いた術後補助化学療法である.近年,EGFR (Epidermal growth factor receptor) 遺伝子変異陽性NSCLCに対する術後補助療法としてオシメルチニブや,PD-L1 (Programmed cell Death Ligand-1) 陽性NSCLCに対する術後補助療法としてアテゾリズマブ,更に術前治療として,ニボルマブとプラチナ併用化学療法が本邦でも承認され,肺癌の周術期の治療開発は目覚ましい.本稿では,肺癌の周術期治療の変遷,近年承認された臨床試験のエビデンスと問題点とともに,今後の展望について述べる.
II.これまでの周術期薬物療法のエビデンス
肺癌術後補助化学療法の代表的なエビデンスとして,34の臨床試験のメタアナリシスにおいて,CDDP併用術後補助化学療法により,全生存期間(OS;Overall survival),5年生存割合が有意に改善することが示された(OS-HR0.86,P<0.01,60 vs. 64%)1).術後病理病期(p-stage)別の5年生存割合は,p-stageⅠ期(66.7 vs. 64.9%),Ⅱ期(42.8 vs. 54.4%),Ⅲ期(25.2 vs. 39.9%)であり,p-stage Ⅱ-Ⅲ期NSCLCにおいて,CDDP併用術後補助化学療法の有効性が確認された2).一方,腫瘍径>2cmのp-stage ⅠA/ⅠB/ⅡA期(TNM 第8版)を対象として,手術単独とUFTの術後補助化学療法を比較する六つの臨床試験のメタアナリシスでは,5年生存割合は82 vs. 88%(OS-HR 0.62, 95% CI 0.42-0.90, P=0.01)とUFT群が有意にOSを改善し,UFTの有効性が示された3).これらの結果から,腫瘍径>2cmのp-stage ⅠA/ⅠB/ⅡA期は,UFTの術後補助化学療法,p-stage Ⅱ-ⅢA期ではCDDP併用術後補助化学療法が標準治療である.
一方,術前導入療法では,15の術前導入療法の臨床試験のメタアナリシスにおいて,臨床病期(c-stage)Ⅰ-ⅢA期に対する手術単独と術前導入療法群の5年生存割合は40 vs. 45%と術前導入療法群のOS延長が示された(OS-HR 0.87,95% CI 0.78-0.96,P=0.007)4).しかし,術後補助化学療法のエビデンスが早期に確立されたことにより,術前導入療法の多くの第3相試験が早期中止となっており,エビデンスの質が高くないことに注意すべきである.術前導入療法と術後補助療法の直接比較はないが,10の術前導入療法と22の術後補助療法のランダム化比較試験のメタアナリシスでは,OSの差は認められなかった(OS-HR 0.99,95%CI 0.81-1.21, P=0.91)5).これらの結果から術前導入療法も治療選択肢の一つとして肺癌診療ガイドラインに記載されている.術前導入療法は術後補助療法と比較すると理論上以下のメリットがある.①腫瘍縮小により完全切除割合が上昇する,②治療コンプライアンスが向上する(術後補助化学療法は,手術の侵襲によるPS低下や合併症のため,治療を受けられない患者が一定数存在する),③手術検体を用いた術前導入療法の治療効果判定により,再発や予後予測ができる.一方デメリットとして,術前導入療法による毒性や治療関連死亡や病勢進行,手術ができない患者が存在し,根治治療の機会を逸する可能性があるため,治療適応を慎重に考える必要がある.
III.分子標的薬を用いた周術期治療
早期肺癌におけるEGFR遺伝子変異陽性の割合は,本邦では肺腺癌の21.3~57.3%と報告されており,病理学的分類にも基づく検討では,EGFR遺伝子変異陽性例はlepidic subtypeに多く,solid subtypeには少ないと報告されている6).p-stage Ⅱ-ⅢA期(本邦ではⅠB期は対象外)EGFR遺伝子変異陽性NSCLCに対して,術後にオシメルチニブの3年間投与の有効性を評価するADAURA試験では,中間解析において主要評価項目である無再発生存期間(DFS,disease-free survival)がオシメルチニブ群で有意に延長したため(DFS-HR 0.20,99.12%CI 0.14-0.30,P<0.001),2022年8月に本邦でも承認された7).
ADAURA試験の問題点として,本来は術後補助療法が必要ない患者にもオシメルチニブが投与されていることが挙げられる.ADAURA試験のp-stage Ⅱ-Ⅲ期のプラセボ群の4年DFS割合は29%であり,手術のみで根治する患者が約3割存在する.オシメルチニブが不要な患者群を特定できれば,本来必要ない有害事象のリスク(オシメルチニブ群の全てのGrade 3以上の有害事象発生割合は23.4%)を避けられる7).また,術後オシメルチニブのHrQoL(Health related quality of life)がプラセボ群と比較して差がないという報告があるが,オシメルチニブが不要な集団においては,通院や金銭的負担,薬剤による有害事象の観点から,オシメルチニブの投与によりQoLが低下することは明らかである8).ADAURA試験では,オシメルチニブ群のOSの改善がすでにプレスリリースされているため,術後のオシメルチニブ投与は今後標準治療として確立していくと予想される.本来は,必要な患者にのみオシメルチニブの術後補助療法を実施すべきであるが,無効な集団が特定できない現状では,リスクベネフィットをよく説明しながら,術後オシメルチニブの投与を検討していく必要があるが,真にオシメルチニブの術後補助療法が必要な患者を選定できるバイオマーカーの開発が急務である.
IV.免疫チェックポイント阻害薬(Immune checkpoint inhibitor;ICI)を用いた周術期治療
Ⅳ-1 ICIを用いた術後補助療法
p-stage ⅠB-Ⅲ期NSCLCに対して,CDDP併用術後補助化学療法後に抗PD-L1阻害薬であるアテゾリズマブを1年間追加投与する補助療法の有効性を評価するIMPOWER 010試験において,主要評価項目であるp-stage Ⅱ-Ⅲ期,かつPD-L1陽性の患者におけるDFS は,アテゾリズマブ群で有意な延長が示された(DFS-HR 0.66, 95% CI 0.50-0.88, P=0.0039)9).この結果から,p-stage Ⅱ-Ⅲ期のPD-L1陽性NSCLCに対してアテゾリズマブの術後補助療法が2022年5月に本邦でも承認された.
また,2023年4月時点では本邦未承認であるが,p-stageⅠB-Ⅲ期NSCLCに対して,術後に抗PD-1抗体であるペムブロリズマブの有効性を評価するPEARLS/KEYNOTE-091試験において,主要評価項目であるPD-L1発現を問わない患者のDFS中央値は,ペムブロリズマブ群53.6カ月,プラセボ群42.0カ月と術後ペムブロリズマブ群の有意な延長が報告されている(DFS-HR 0.76, 95%CI 0.63-0.91, P=0.0014).しかし,もう一つの主要評価項目であるPD-L1≧50%の患者では,DFS中央値は両群とも未到達であるが,両群の差は認めていない10).
ICIを用いた術後補助療法においても,真に治療が有効な患者の特定は重要である.IMPOWER010試験では,プラセボ群でも再発を認めない患者が一定数存在し(p-stage Ⅱ-Ⅲ期で,PD-L1発現問わないプラセボ群の3年DFS割合は49.4%),この患者群には術後アテゾリズマブの投与は不要であり,有害事象のリスクを回避すべきである(アテゾリズマブ群のGrade3以上の治療関連有害事象発生割合は11.2%).またPD-L1発現別の有効性の検討では,IMPOWER010試験のサブグループ解析において,PD-L1<1%や1~49%,>50%のDFSのHRがそれぞれ0.97(95%CI 0.72-1.31),0.87(95%CI 0.60-1.26),0.43(95%CI 0.27-0.68)であり,PD-L1<50%の患者集団は>50%の患者集団と比較するとアテゾリズマブの有効性は乏しかった9).更に,IMPOWER010試験のOSフォローアップデータがWCLC(World Conference on Lung Cancer)2022で報告されており,PD-L1>1%, p-stage Ⅱ-Ⅲ期 NSCLC対して,3年生存割合は82.1 vs. 78.9%(HR 0.71,95%CI 0.49-1.03),PD-L1>50% p-stageⅡ-Ⅲ期では3年生存割合が89.1 vs. 77.5%(HR 0.42, 95% CI 0.23-0.78)とPD-L1>50%でOSは良い傾向であった.
以上の結果より,PD-L1>1%,p-stage Ⅱ-Ⅲ期NSCLCにおいて,術後補助療法のアテゾリズマブが標準治療であるが,特にPD-L1>50%の患者に対して良い適応である.
Ⅳ-2 ICIを用いた術前療法
c-stageⅠB~ⅢA期NSCLCに対する術前ニボルマブ+プラチナ併用化学療法(3サイクル)の有効性を評価するCheckMate-861試験では,主要評価項目であるDFSと病理学的完全奏効割合(pCR, pathological complete response)は,術前プラチナ併用化学療法単独と比較して有意に良好な結果であった(2年DFS割合 63.8 vs. 45.3%,DFS-HR 0.63,95%CI=0.43-0.91,pCR 割合 2.2% vs. 24.0%)11).この結果からc-stage ⅠB~ⅢA期,切除可能NSCLCに対して,術前ニボルマブ+化学療法が2023年3月に本邦でも承認された.
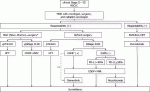
術前ニボルマブ+化学療法の問題点は,①手術が実施できない患者の存在,②バイオマーカーによる患者選択,③切除可能の定義が担当医や施設毎に異なることが挙げられる.①に関しては,CheckMate-816試験では術前ニボルマブ+プラチナ併用化学療法群の83.2%が手術を施行されているが,手術が実施されなかった理由の内訳は,病勢進行・有害事象・その他(患者拒否や切除不能など)の順であった11).ニボルマブ+化学療法群のORR(奏効割合;objective response rate)は53.6%であるが,他臓器浸潤や気管支スリーブ切除のリスクが高いなどの理由で病勢進行により切除困難になる可能性がある場合は,術前治療の効果を期待するよりも,手術先行が望ましい.②術前ニボルマブ+化学療法も同様にPD-L1発現がバイオマーカーとなる事が示唆されている.PD-L1<1%群のサブグループ解析では,術前ニボルマブ併用の有効性が乏しい可能性が示唆された(DFS-HR 0.85 95% CI 0.54-1.32).また,c-stage ⅠB -Ⅱ期(DFS-HR 0.87,95%CI 0.48-1.56)や扁平上皮癌(DFS-HR 0.77,95%CI=0.49-1.22)も同様に術前ニボルマブ併用の有効性が乏しい可能性がある.これらの結果から,術前の生検検体でPD-L1<1%や扁平上皮癌,c-stage ⅠB~Ⅱ期の患者では手術先行も選択肢である.③については,c-stage Ⅲ期NSCLC症例は,Single or multi N2やbulky N2が含まれており,他臓器浸潤T3~4もあるため,不均一な集団である.更に単純な肺葉切除術のみならず,気管支形成や血管形成,肺全摘が必要な患者も含まれており,様々な治療法の選択が必要であるため,切除可能性は外科医によって大きく異なる12).切除不能な場合は化学放射線療法後のデュルバルマブ(PD-L1阻害薬)地固め療法が現在の標準治療である.これらのことから,c-stage Ⅱ-Ⅲ期NSCLCにおいては,内科医・外科医・放射線治療医を含めたキャンサーボードを行い,最適な治療法を検討する事が重要であり,周術期の最適な治療を適宜検討することが重要である(図1).
V.小細胞肺癌(SCLC)に対する術後補助化学療法
多くのSCLC患者は進行した状態で発見され,手術適応となる患者が少ないため,術後補助療法に関する臨床試験の実施は困難であった.p-stage T1-2N0M0 SCLCの患者に対する後ろ向きコホート研究において,手術単独,手術と術後補助化学療法を比較したところ,多変量解析で術後補助化学療法が手術単独と比較して有意にOS延長を示された(OS-HR 0.78, 95% CI 0.63-0.95)13).近年,高悪性度神経内分泌肺癌の完全切除例に対するCDDP+イリノテカン(CPT-11)療法とCDDP+エトポシド(ETP)療法のランダム化比較試験(JCOG1205/1206試験)が実施され,3年RFS割合はCDDP+ETP群で65.4%,CDDP+CPT-11群で69.0%であり,CDDP+CPT-11の有効性は認めなかった.(RFS-HR 1.076, 95%CI 0.666-1.738,P=0.619)14).以上の結果より,完全切除SCLCの患者に対する標準治療はCDDP+ETPを用いた術後補助化学療法である.
VI.現在の周術期治療の課題,バイオマーカー
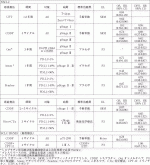
これまでに述べてきた過去の肺癌周術期薬物療法の試験を表1に示す.分子標的治療薬やICIを用いた周術期治療の課題として,真に有効な集団を特定するバイオマーカーの開発は急務である.近年,微小残存病変(MRD, minimal residual disease)の検出が周術期治療のバイオマーカーとして注目されている.MRDとは治療後または治療中に残存する微小残存病変のことである.白血病では,診断,治療効果や寛解・再発の判定,治療後のモニタリングにMRDの検出が用いられている.遺伝子解析技術の進歩により,固形癌患者のリキッドバイオプシーによるcirculating tumor DNA(ctDNA)解析などによって,治療後のMRDを高感度に検出することが可能となっている.P-stage Ⅰ-Ⅲ期のNSCLCの患者において,ctDNA解析にてMRDを検出することにより,画像所見よりも早期に再発を発見できることが報告され,高感度なMRDの検出が術後再発予測のバイオマーカーとして有用である可能性が示された.また,進行肺癌同様にドライバー遺伝子に基づく個別化医療を周術期薬物療法の開発に応用することも重要である.EGFR陽性NSCLCの患者を対象に術前オシメルチニブ±化学療法の有効性を評価するNeoADAURA試験やALK融合遺伝子陽性NSCLCの患者を対象に術後/術前アレクチニブの有効性を評価するALINA試験,ALNEO試験,RET融合遺伝子陽性NSCLCの患者を対象に術後セルペルカチニブの有効性を評価するLIBRETTO-431などが進行中である15)
~
17).一方で早期肺癌におけるEGFR以外のドライバー遺伝子に関する報告は少ない.現在,われわれは進行肺癌を対象に,2013年より実施している全国遺伝子スクリーニングネットワーク(LC-SCRUM-Asia)の基盤をもとに,2022年8月から早期肺癌における周術期個別化医療の確立を目指した遺伝子スクリーニング(LC-SCRUM-Advantage)を開始し,5年間で10,000例の登録を目指している.さらに,国内で開発されたリキッドバイオプシーに基づく最先端のMRD診断システムを用いた大規模前向き観察研究を行い,MRD診断の有用性を検証し,世界初の肺癌に対する新規MRD診断法の確立を目指すLC-SCRUM-MRDについても同時に実施し,早期肺癌に対する集学的治療のバイオマーカー探索について積極的に取り組んでいる(図2).現在開発中の集学的治療の試験を表2にまとめる.その他,pCRやDFSのような短期的な効果判定の指標が周術期薬物療法の代替エンドポイントとしての有用性評価,術後補助療法の治療期間の最適化なども重要な課題である18).


VII.おわりに
周術期薬物療法の変遷と近年承認された,ICI や分子標的薬を用いた術前,術後治療とその問題点を論じた.オシメルチニブやアテゾリズマブの術後補助療法,術前ニボルマブ併用化学療法が承認され,切除可能局所進行NSCLCの治療戦略は複雑化しており,内科医・外科医・放射線治療医を含めたキャンサーボードで十分に協議して治療方針を決定する必要がある.また,分子標的治療薬を用いた周術期の個別化医療の開発と,MRDなどの新規バイオマーカーを用いた術後補助療法が真に有効な患者集団の特定も急務の課題であり,われわれは,LC-SCRUM-Advantage/MRDを実施し,周術期における個別化医療の発展,バイオマーカー開発に貢献していく.
利益相反:なし
文献
1) Group NM-aC, Arriagada R, Auperin A, et al.: Adjuvant chemotherapy, with or without postoperative radiotherapy, in operable non-small-cell lung cancer:two meta-analyses of individual patient data. Lancet, 375 (9722): 1267-1277, 2010.
2) Douillard JY, Tribodet H, Aubert D, et al.: Adjuvant cisplatin and vinorelbine for completely resected non-small cell lung cancer:subgroup analysis of the Lung Adjuvant Cisplatin Evaluation. J Thorac Oncol, 5 (2): 220-228, 2010.
3) Hamada C, Tsuboi M, Ohta M, et al.: Effect of postoperative adjuvant chemotherapy with tegafur-uracil on survival in patients with stage ⅠA non-small cell lung cancer:an exploratory analysis from a meta-analysis of six randomized controlled trials. J Thorac Oncol, 4 (12): 1511-1516, 2009.
4) Group NM-aC: Preoperative chemotherapy for non-small-cell lung cancer:a systematic review and meta-analysis of individual participant data. Lancet, 383 (9928): 1561-1571, 2014.
5) Lim E, Harris G, Patel A, et al.: Preoperative versus postoperative chemotherapy in patients with resectable non-small cell lung cancer:systematic review and indirect comparison meta-analysis of randomized trials. J Thorac Oncol, 4 (11): 1380-1388, 2009.
6) Ito H, Date H, Shintani Y, et al.: The prognostic impact of lung adenocarcinoma predominance classification relating to pathological factors in lobectomy, the Japanese Joint Committee of Lung Cancer Registry Database in 2010. BMC Cancer, 22 (1): 875, 2022.
7) Herbst RS, Wu YL, John T, et al.: Adjuvant Osimertinib for Resected EGFR-Mutated Stage ⅠB-ⅢA Non-Small-Cell Lung Cancer:Updated Results From the Phase Ⅲ Randomized ADAURA Trial. J Clin Oncol, 41 (10): 1830-1840, 2023.
8) Majem M, Goldman JW, John T, et al.: Health-Related Quality of Life Outcomes in Patients with Resected Epidermal Growth Factor Receptor-Mutated Non-Small Cell Lung Cancer Who Received Adjuvant Osimertinib in the Phase Ⅲ ADAURA Trial. Clin Cancer Res, 28 (11): 2286-2296, 2022.
9) Felip E, Altorki N, Zhou C, et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage ⅠB-ⅢA non-small-cell lung cancer (IMpower010):a randomised, multicentre, open-label, phase 3 trial. Lancet, 398 (10308): 1344-1357, 2021.
10) O’Brien M, Paz-Ares L, Marreaud S, et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage ⅠB-ⅢA non-small-cell lung cancer (PEARLS/KEYNOTE-091):an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol, 23 (10): 1274-1286, 2022.
11) Forde PM, Spicer J, Lu S, et al.: Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med, 386 (21): 1973-1985, 2022.
12) Lee VH, Au JSK, Mu JW, et al.: Real-World Perspectives From Surgeons and Oncologists on Resectability Definition and Multidisciplinary Team Discussion of Stage III NSCLC in People’s Republic of China, Hong Kong, and Macau:A Physician Survey. JTO Clin Res Rep, 3 (5): 100308, 2022.
13) Yang CF, Chan DY, Speicher PJ, et al.: Role of Adjuvant Therapy in a Population-Based Cohort of Patients With Early-Stage Small-Cell Lung Cancer. J Clin Oncol, 34 (10): 1057-1064, 2016.
14) Kenmotsu H, Niho S, Tsuboi M, et al.: Randomized Phase Ⅲ Study of Irinotecan Plus Cisplatin Versus Etoposide Plus Cisplatin for Completely Resected High-Grade Neuroendocrine Carcinoma of the Lung:JCOG1205/1206. J Clin Oncol, 38 (36): 4292-4301, 2020.
15) Tsuboi M, Weder W, Escriu C, et al.: Neoadjuvant osimertinib with/without chemotherapy versus chemotherapy alone for EGFR-mutated resectable non-small-cell lung cancer:NeoADAURA. Future Oncol, 17 (31): 4045-4055, 2021.
16) Sentana-Lledo D, Viray H, Piper-Vallillo AJ, et al.: Complete pathologic response to short-course neoadjuvant alectinib in mediastinal node positive (N2) ALK rearranged lung cancer. Lung Cancer, 172: 124-126, 2022.
17) Tsuboi M, Goldman JW, Wu YL, et al.: LIBRETTO-432, a phase Ⅲ study of adjuvant selpercatinib or placebo in stage ⅠB-ⅢA RET fusion-positive non-small-cell lung cancer. Future Oncol, 18 (28): 3133-3141, 2022.
18) Uprety D, West HJ. Perioperative Therapy for Resectable Non-Small-Cell Lung Cancer:Weighing Options for the Present and Future. JCO Oncol Pract, OP2300014, 2023.
PDFを閲覧するためには Adobe Reader が必要です。