日外会誌. 124(3): 268-275, 2023
特集
がん診療における層別化医療の現状と今後の展望
7.大腸がんにおける層別化医療の現状と今後の展望
|
東京大学 腫瘍外科 江本 成伸 , 石原 聡一郎 |
大腸がん治療における,precision medicineは近年発展が著しい.薬物療法を行う患者においては,RAS/BRAF遺伝子変異や,マイクロサテライト不安定性(MSI)の検査は必須となり,それぞれの結果によって治療薬,治療戦略が層別化されている.極めて予後不良とされてきたBRAF変異陽性例に対しても,BRAF阻害薬併用療法の有効性が示された.また,本邦では2021年8月にMSI-highの切除不能大腸がん初回治療例に対してpembrolizumabの適応が拡大され,pembrolizumab がMSI-high大腸がんの1次標準治療となったことは特筆すべきである.2019年7月からは包括的がんゲノムプロファイリング検査(CGP検査)が保険適応となり,がんゲノム医療の検査体制も急速に整えられつつある.大腸がん治療におけるCGP検査は,検査体制の煩雑さや治療薬に結びつく症例の割合の少なさなどの課題があり,今後の研究による発展が期待される.血液中のctDNAなどをターゲットとしたリキッドバイオプシーも,研究が進んでいる.2021年8月より,組織検体の得られない症例などに対してリキッドバイオプシーによるCGP検査が保険適応となった.2020年より,切除可能な大腸がんを対象とした大規模なレジストリーであるCIRCULATE-Japanが開始され,リキッドバイオプシーを用いた再発早期発見,補助化学療法の層別化を検討する臨床試験が進行中であり,結果が待たれる.治療の層別化をはかり,個々の患者において最適な治療を提供することが,予後の改善に直結しており,precision medicineの今後の益々の発展が期待される.
キーワード
大腸がん, precision medicine, ゲノム医療, 包括的がんゲノムプロファイリング検査, リキッドバイオプシー
I.はじめに
大腸がん診療における「層別化医療」は,様々な観点から論じることができるが,近年のがん診療において,世界的に進められている,precision medicineに向けた取り組みが最もホットなトピックであろう.本邦では2019年7月よりがん関連遺伝子パネル検査が保険収載され,「がんゲノム医療」が実装された.それ以前より大腸がん領域では,薬物療法レジメンの選択において,遺伝子解析は欠かせないものとなっていたが,今後も診断・治療・予後予測など診療の中のあらゆる場面において,層別化が進んでいくことが予想される.われわれ外科医も最新の知識を整理して診療にあたる必要がある.本稿では,大腸がんにおけるprecision medicineについて概説する.
II.大腸がんにおける遺伝子変異による治療の層別化
1. RAS/BRAF・原発巣部位
RAS(KRAS/NRAS)遺伝子変異は切除不能大腸がん患者の約50%に認められ,変異を有する患者に対して抗EGFR抗体薬の効果が期待できないことが報告されている.本邦では,2015年4月にRAS(KRAS/NRAS)遺伝子検査が保険償還されている.また,抗EGFR抗体薬併用の有無を比較した六つの大規模臨床試験のデータの統合解析において,原発巣占拠部位が左側(下行結腸~直腸)の患者に対しては,一次治療における抗EGFR抗体薬の効果が高いが,右側(盲腸~横行結腸)の患者に対しては,効果が乏しいことが報告されている1).従って,薬物療法の実施が可能な患者においては,一次治療前にRAS(KRAS/NRAS)遺伝子検査を行うことが推奨されている.
BRAF
V600E遺伝子変異は本邦において切除不能大腸がん患者の4.5~6.7%にみられ,極めて予後不良とされる2).RAS遺伝子変異とBRAF
V600E遺伝子変異は相互排他的であることがわかっている.BRAF
V600E遺伝子変異陽性症例に対しての一次治療として,FOLFOXIRI+bevacizumabとFOLFIRI+bevacizumabを比較した第Ⅲ相TRIBE試験においては,FOLFOXIRI+bevacizumabの有効性が期待できる結果であったが3),五つの比較試験のメタアナリシスにおいて,FOLFOXIRI+bevacizumabはdoublet+bevacizumabと比較して生存期間延長効果を示せなかった4).BRAF
V600E変異陽性の切除不能大腸がん二次治療例および三次治療例におけるencorafenib+cetuximab,encorafenib+binimetinib+cetuximabの有効性と安全性を,FOLFIRI+cetuximabまたはirinotecan+cetuximabと比較したBEACON CRC試験が行われ,BRAF阻害医薬併用療法の有効性が示された5).BRAF
V600E遺伝子検査も一次治療開始前に行うことが推奨される.2018年8月にRAS, BRAF遺伝子変異を同時に測定できる体外診断薬(RASKET-Bキット)が保険承認され,切除不能大腸がん患者において必須の検査となっている.
2. MSI
ゲノム上に存在する1~数塩基の繰り返し配列のことをマイクロサテライト領域といい,DNA複製時に生じる誤った塩基対合が正常細胞と異なる反復回数を示す現象のことを,マイクロサテライト不安定性(microsatellite instability: MSI)という.DNA複製時に誤った塩基対合を修復する機構がミスマッチ修復機構(mismatch repair: MMR)であり,MMR遺伝子が欠損している(deficient MMR: dMMR)場合に,MSI-highが出現する.MMR機能欠損は,主にMMR遺伝子の生殖細胞系列変異を原因とするLynch症候群に認められる大腸がんや,MLH1遺伝子の後天的な異常メチル化を原因とする散発性大腸がんに認められる.本邦の切除不能大腸がんの約4%にMSI-highが認められる6).KEYNOTE-177試験は,MSI-high/dMMR切除不能大腸がん初回治療例を対象に抗PD-1抗体薬のpembrolizumabと標準治療(doublet±bevacizumab/cetuximab)を比較した第Ⅲ相試験であり,主要評価項目の一つである無増悪生存期間(Progression Free Survival: PFS)はpembrolizumab群で有意に延長した(pembrolizumab vs. 標準治療; PFS 16.5カ月 vs. 8.2カ月; HR 0.60; 95%CI 0.45-0.80; P=0.0002) 7).本邦では2021年8月にMSI-highの切除不能大腸がん初回治療例に対してpembrolizumabの適応が拡大され,現在,MSI-high大腸がんの1次標準治療となっている.薬物療法の適応となる切除不能大腸がんでは治療開始前にMSI検査を実施しておくことが望ましい.
CheckMate-142試験ではMSI-high/dMMR切除不能大腸がん既治療例に対する,抗PD-1抗体薬のnivolumab,および抗CTLA-4抗体薬のipilimumabとnivolumabの併用療法について奏効割合がそれぞれ36%, 55%, 1年PFSが44%, 71%と良好な成績が示された8)9).以上の結果より,本邦のガイドラインでも,二次治療以降でのnivolumabまたは,ipilimumab+nivolumabが推奨されている.
本年,The New England Journal of MedicineにdMMRを有するステージⅡ/Ⅲ直腸がん患者に対する,抗PD-1抗体薬であるdostarlimabの第Ⅱ相試験で,中間解析時点で投与された12人の患者のcCR率が100%であったと報告された10).続報が注目される.本邦からは,直腸がんに対する術前化学放射線療法における,consolidationに,nivolumabを用いた臨床試験(VOLTAGE試験)が行われ,Microsatellite stable (MSS), MSI-highの患者それぞれで,pCR率29%, 60%と報告された11).MSIは,治療の発展が極めて有望なターゲットである.
III.包括的がんゲノムプロファイリング検査
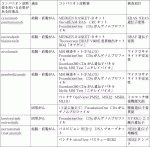
包括的がんゲノムプロファイリング(comprehensive genomic profiling; CGP)検査は,次世代シークエンサー(next generation sequencer; NGS)を用いたゲノム解析にて網羅的にがん細胞の遺伝子変化を確認し,その結果を踏まえた適切な薬剤を専門家チームが検討し治療につなげることを目的とする.保険診療下で検査が可能な施設は,「がんゲノム医療中核拠点病院」(全国12施設),「がんゲノム医療拠点病院」(33施設),「がんゲノム医療連携病院」(188施設)に限定される(2022年9月現在).中核拠点病院と拠点病院におけるエキスパートパネルの開催が義務づけられており,CGP検査の結果が多職種によって検討される.また,国により,「がんゲノム情報管理センター(C-CAT)」が設置され,ゲノム解析を行った結果得られる配列情報,診療情報の集約・保管が行われている.CGP検査は2019年7月より保険適用となり,現在は「OncoGuideTMNCCオンコパネルシステム」,「FoundationOneⓇCDxがんゲノムプロファイル」「FoundationOneⓇRLiquid CDxがんゲノムプロファイル」の三つが保険適用下で実施可能である.
OncoGuideTMNCCオンコパネルシステムは,がん関連114遺伝子の遺伝子変異,12遺伝子の遺伝子融合および腫瘍遺伝子変異量(tumor mutation burden; TMB)が検査可能である.腫瘍組織のDNAと正常コントロールとして非腫瘍細胞(末梢血)由来DNAを用いることで稀な遺伝子多型が除外でき,体細胞遺伝子変異と生殖細胞系列遺伝子変異変化も区別できる.FoundationOneⓇCDxがんゲノムプロファイルはがんの組織検体を,FoundationOneⓇLiquid CDxがんゲノムプロファイルは血液検体を用いた,CGPである.いずれも,324遺伝子の遺伝子変異と36遺伝子の遺伝子融合,MSI,TMBが測定できる.組織検体量が十分確保できない場合や,組織検体を確保できても腫瘍含有割合が不足する場合,さらに,組織検体の経年劣化,分子標的治療により腫瘍ゲノムプロファイリングが変化していることが見込まれる場合などで,血液検体によるCGP検査が実施される.
FoundationOneⓇCDxがんゲノムプロファイルとFoundationOneⓇLiquid CDxがんゲノムプロファイルでは,いくつかの遺伝子変異に対してコンパニオン診断機能が厚生労働省より承認されており,これらの検査結果を基に,治療薬の投与が可能となる.一方でOncoGuideTMNCCオンコパネルシステムは,コンパニオン診断機能が認められていない(表1).ただし,コンパニオン診断機能がない場合でも,エキスパートパネルおよび主治医が添付文書・ガイドライン・文献等を踏まえ,医薬品投与が適切であると判断した場合には,あらためてコンパニオン検査を行うこと無く薬剤投与が可能である(「遺伝子パネル検査によるコンパニオン診断システムの標準化に向けた検討」(永井班)提言).なお,CGP検査で見つかる変異の多くは,RAS, BRAF, MSIであり,新たな変異が見つかることが少ないのが現状である(表2).
1. NTRK融合遺伝子
大腸がんでは頻度が1%以下である12).ROS1/TRK阻害薬であるentrectinibとTRK選択的阻害薬であるlarotrectinibがNTRK融合遺伝子をもつがんに保険適用され,FoundationOneⓇCDxがんゲノムプロファイルとFoundationOneⓇLiquid CDxがんゲノムプロファイルがコンパニオン診断薬として承認されている.NTRK融合遺伝子陽性例には,entrectinib/larotrectinib療法が既に保険診療として実施可能である.
2. ERBB2遺伝子増幅
大腸がんの1.6~5.2%にERBB2遺伝子増幅を認めるHER2陽性大腸がんが存在することが知られている.NCCNガイドラインではERBB2遺伝子増幅を認める大腸がんに対して,2次治療以降で抗HER2療法が推奨されている.ERBB2遺伝子増幅を認める大腸がんに対するtrastuzumab+pertuzumab療法は単群前向き試験で有効性が示されており,本邦でも2022年3月に承認された13).
3. Tumor Mutational Burden
腫瘍におけるTMBが高くなるにつれ,免疫チェックポイント阻害薬が良好な効果を認めることが報告されている14).海外では,KEYNOTE-158試験15)の結果に基づき,TMB-high(10 muts/Mb以上)に対するpembrolizumabが承認されており,本邦でも2022年2月に,pembrolizumabの効能・効果に「がん化学療法後に増悪したTMB-highを有する進行・再発の固形がん」が追加された.FoundationOneⓇCDxがんゲノムプロファイルが実施された22,590例の大腸がんの検討16)では,MSI-high 5.3%,TMB-high約11.5%と報告されている.MSI-high大腸がんは,その大部分がTMB-highであることから,Non MSI-highかつTMB-highは約6%を占めることになる.しかしながら,TMB-highの大腸がんを対象としたpembrolizumab療法の前向き試験(TAPUR試験)17)では,奏効率,病勢制御率はそれぞれ11%,28%と報告され,続いて行われたipilimumab+nivolumab療法の前向き試験(同じくTAPUR試験)18)においても奏効率,病勢制御率ともに10%と治療効果は限定的であった.以上より,TMB-high大腸がんのうちNon MSI-highの患者に対するpembrolizumabの有効性は明らかでなく,NCCNガイドライン(version 1.2022)では大腸がん実地診療におけるTMB検査は推奨されていない.
4. CGP検査の実施時期,問題点
CGP検査は,「標準治療が終了となった患者かつ,本検査施行後に化学療法の適応となる可能性が高いと主治医が判断した者」が適応とされている.一方で,後方ラインであるregorafenibやFTD/TPIはPFS中央値が2カ月程度であり,これらが終了してからCGP検査を実施した場合,結果が報告されるまでに病勢が進行し,有望な治療が見つかったとしても実際には受けられない可能性がある.以上より,大腸癌治療ガイドラインには,「一次治療開始後から後方治療移行時までの適切な時期に実施することが望ましい」と記載されている.検査のタイミングを前倒しした場合のactionableな遺伝子異常(がん薬物療法の治療標的となりうる遺伝子異常)に対応する分子標的薬による治療を受ける患者の割合を検討する前向き観察研究が開始されている(UMIN000040743).現行の本邦におけるがんゲノム医療においては,actionable遺伝子異常が検出される割合は40~60%と報告されているが,遺伝子情報に基づく治療が実施された症例はがん腫全体で3.7~11%程度と限定されており,この低さが最大の問題である19)20).大腸癌治療ガイドラインにおいては,CGP検査は弱い推奨となっているが,治療標的となりうる遺伝子異常の研究,さらなる治療薬の開発とともに,CGP検査手続きの効率化,病院の赤字リスクが回避される仕組み,治験へのアクセスの改善などが望まれる.

IV.リキッドバイオプシー
血液や尿,胸腹水中のcirculating tumor cell (CTC), cell-free tumor DNA (ctDNA), エクソソームなどを用いた検査をリキッドバイオプシーと総称する.リキッドバイオプシーは,腫瘍組織が得られない患者や残検体がない患者においてもゲノム検査を実施できることや,侵襲性が低いこと,検査結果の返却までの期間が短いこと,繰り返し検査を実施できることなどの利点があり,期待されている.組織検体が得られないケースなどに対し,2021年8月より保険適応となった.ctDNAは結晶中の半減期が腫瘍マーカーと比較して極めて短く,がんの残存がなければ血中からすみやかに消失する.この特性を利用して,根治的治療後の微小残存腫瘍の検出のために診断技術が開発されている.切除可能大腸がん患者において,治癒切除後30日時点でのctDNA陽性であった患者の再発率はctDNA陰性の患者と比較して有意に高かった(HR 7.1 (95%CI:2.2-22.0, P<0.001))21).大腸がん治癒切除後のctDNAが再発の予測因子として,補助化学療法の層別化が今後はかられることが,期待される.
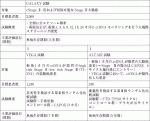
本邦では,国立がん研究センター東病院を中心に行われている産学連携全国がんゲノムスクリーニング事業「SCRUM-Japan」の中で,2017年よりStage Ⅳ消化器がん患者の血液中のctDNAを用いたゲノム解析を行うスクリーニング研究(GOZILA study)が進行中である.消化器がんにおけるactionable遺伝子検出率や遺伝子解析成功率は組織とリキッドでほぼ同等であり,解析結果までの期間が組織と比較して有意に短い(14日vs. 4日, P<0.0001)という結果が報告された22).2020年より,切除可能な大腸がんを対象としたCIRCULATE-Japanが開始された.StageⅡからⅣの切除可能大腸がん2,500例を対象に,術後2年間,リキッドバイオプシーを用いた再発のモニタリング検査を施行し,再発の早期発見を模索するGALAXY試験,術後1カ月時点でがん遺伝子の異常が検出されないStageⅡ/Ⅲ大腸がん1,240名を対象とし,術後補助化学療法群と,経過観察群を比較する第3相試験(VEGA試験),治癒切除後にctDNA陽性となった患者を対象に,FTD/TPI投与と無治療経過観察を比較する第3相試験(ALTAIR試験)が開始されており,結果が注目される(表3)23).
V.おわりに
大腸がんにおける,遺伝子異常をもとにした層別化医療について,概説した.日進月歩の領域であり,課題も多いが,今後の発展が期待される.臨床の現場では常に最新の知見を整理し,診療に適用していくことが重要である.
利益相反:なし
文献
1) Arnold D, Lueza B, Douillard JY, et al.: Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials. Ann Oncol, 28(8): 1713-1729, 2017.
2) Nakanishi R, Harada J, Tuul M, et al.: Prognostic relevance of KRAS and BRAF mutations in Japanese patients with colorectal cancer. Int J Clin Oncol, 18(6): 1042-1048, 2013.
3) Cremolini C, Loupakis F, Antoniotti C, et al.: FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol, 16(13): 1306-1315, 2015.
4) Cremolini C, Antoniotti C, Stein A, et al.: Individual Patient Data Meta-Analysis of FOLFOXIRI Plus Bevacizumab Versus Doublets Plus Bevacizumab as Initial Therapy of Unresectable Metastatic Colorectal Cancer. J Clin Oncol, 20:JCO2001225, 2020.
5) Kopetz S, Grothey A, Yaeger R, et al.: Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med, 381(17): 1632-1643, 2019.
6) Akagi K, Oki E, Taniguchi H, et al.: Real-world data on microsatellite instability status in various unresectable or metastatic solid tumors. Cancer Sci, 112(3): 1105-1113, 2021.
7) Andre T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med, 383(23): 2207-2218, 2020.
8) Overman MJ, McDermott R, Leach JL, et al.: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol, 18(9): 1182-1191, 2017.
9) Overman MJ, Lonardi S, Wong KYM, et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol, 36(8): 773-779, 2018.
10) Cercek A, Lumish M, Sinopoli J, et al.: PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med, 386(25): 2363-2376, 2022.
11) Bando H, Tsukada Y, Inamori K, et al.: Preoperative Chemoradiotherapy plus Nivolumab before Surgery in Patients with Microsatellite Stable and Microsatellite Instability-High Locally Advanced Rectal Cancer. Clin Cancer Res, 28(6): 1136-1146, 2022.
12) Cocco E, Scaltriti M, Drilon A: NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol, 15(12): 731-747, 2018.
13) Nakamura Y, Okamoto W, Kato T, et al.: Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer: a phase 2 trial. Nat Med, 27(11): 1899-1903, 2021.
14) Cristescu R, Mogg R, Ayers M, et al.: Pan-tumor genomic biomarkers for PD-1 checkpoint blockade-based immunotherapy. Science, 362(6411):eaar 3593, 2018.
15) Marabelle A, Fakih M, Lopez J, et al.: Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol, 21(10): 1353-1365, 2020.
16) Yoshino T, Tukachinsky H, Lee JK, et al.: Genomic immunotherapy (IO) biomarkers detected on comprehensive genomic profiling (CGP) of tissue and circulating tumor DNA (ctDNA). J Clin Oncol, 39(15_suppl): 2541, 2021.
17) Meiri E, Garrett-Mayer E, Halabi S, et al.: Pembrolizumab (P) in patients (Pts) with colorectal cancer (CRC) with high tumor mutational burden (HTMB): Results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. J Clin Oncol, 38(4_suppl): 133, 2020.
18) Vaccaro GM, Rothe M, Mangat PK, et al.: Nivolumab plus ipilimumab (N+I) in patients (pts) with colorectal cancer (CRC) with high tumor mutational burden (hTMB): Results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol, 40(4_suppl): 107, 2022.
19) Hayashi H, Tanishima S, Fujii K, et al.: Clinical impact of a cancer genomic profiling test using an in-house comprehensive targeted sequencing system. Cancer Sci, 111(10): 3926-3937, 2020.
20) Sunami K, Naito Y, Aimono E, et al.: The initial assessment of expert panel performance in core hospitals for cancer genomic medicine in Japan. Int J Clin Oncol, 26(3): 443-449, 2021.
21) Reinert T, Henriksen TV, Christensen E, et al.: Analysis of Plasma Cell-Free DNA by Ultradeep Sequencing in Patients With Stages I to III Colorectal Cancer. JAMA Oncol, 5(8): 1124-1131, 2019.
22) Nakamura Y, Taniguchi H, Ikeda M, et al.: Clinical utility of circulating tumor DNA sequencing in advanced gastrointestinal cancer: SCRUM-Japan GI-SCREEN and GOZILA studies. Nat Med, 26(12): 1859-1864, 2020.
23) Taniguchi H, Nakamura Y, Kotani D, et al.: CIRCULATE-Japan: Circulating tumor DNA-guided adaptive platform trials to refine adjuvant therapy for colorectal cancer. Cancer Sci, 112(7): 2915-2920, 2021.
PDFを閲覧するためには Adobe Reader が必要です。