日外会誌. 124(3): 261-267, 2023
特集
がん診療における層別化医療の現状と今後の展望
6.肝胆膵がんにおける層別化医療への今後の展望
|
大阪大学大学院 消化器外科学 山田 大作 , 小林 省吾 , 佐々木 一樹 , 岩上 佳史 , 富丸 慶人 , 野田 剛広 , 高橋 秀典 , 土岐 祐一郎 , 江口 英利 |
肝胆膵領域の癌はいずれも予後が悪く,手術以外の治療法に関してさらなる改善が望まれている.現在は同じ癌種の症例群において統計的に最も効果が高い治療法を標準治療とし,画一的な治療を行っているが,より最適な治療選択のためのガイドツールの開発が必要である.近年,ゲノム解析など分子生物学的な解析が進み,患者の遺伝背景や各症例の癌に認められる遺伝子異常などをもとに患者を層別化し,適した治療を選択する層別化治療が始まりつつある.肝胆膵領域癌でも遺伝子変異の研究が進んでおり,遺伝子変異に対応する新たな分子標的薬が数多く開発されている.本稿では肝胆膵領域癌において比較的頻度の多い遺伝子変異と対応する分子標的薬や臨床試験について紹介し,肝胆膵領域癌治療層別化治療への,そして個別化医療への今後の展望について概説する.
キーワード
肝細胞癌, 胆道癌, 膵癌, 層別化治療
I.はじめに
肝胆膵領域の癌は,肝細胞癌,胆道癌(肝内胆管癌,肝門部領域癌,胆嚢癌,遠位胆管癌,十二指腸乳頭部癌),膵癌(浸潤性膵管癌)が含まれており,そのいずれも予後が悪く,診断後5年生存率のワースト1~3位を占めている.肝胆膵領域癌では,根治を目的とした治療は手術治療が主軸となる.手術治療では,術前画像などをもとに各症例に合わせて必要十分な範囲の切除を施行しており,本邦における手術治療は一種の個別化治療の域まで到達している.しかし一方で,手術以外の治療法を考慮する際には,手術術式を決める際の術前画像のような,各症例に対して最適な治療法を検討するためのガイドツールは存在せず,同じ癌種の症例群において統計的に最も効果が高い治療法を最初の治療選択(First line)として定め,症例に合わせて治療を行うのではなく画一的な治療を行うのが通常であった.近年,ゲノム解析など分子生物学的な解析が進み,患者の遺伝背景や癌に認められる遺伝子異常などをもとに患者を層別化することが可能となり,層別化された症例に適した治療を選択する層別化治療が始まりつつある.肝胆膵領域癌の患者に対する現在の標準治療では層別化治療を行う段階には至っていないが,肝胆膵領域癌でも遺伝子変異の研究が進み,新たな分子標的薬が数多く開発され,多くの臨床試験が進行中である.
本邦では,標準治療が終了した症例ではがんゲノム医療が保険適応となり,施設規定はあるものの2019年6月から遺伝子パネル検査を保険診療として受けることが可能となった.このため上記の標準治療が終了した症例では遺伝子変異に基づいた層別化治療を提案できる可能性がある.各肝胆膵領域癌において比較的頻度の多い遺伝子変異と対応する分子標的薬や臨床試験の成績などについて紹介する(表1).
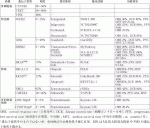
II.肝細胞癌の遺伝子変異と治療への展望
① βカテニン(CTNNB1)遺伝子変異は肝細胞癌に約30~50%で認められる遺伝子の点突然変異でありWnt/βカテニン経路の異常をきたす1).Wnt/βカテニン経路は器官形成や組織幹細胞のホメオスタシスを保つなどに寄与しているが,肝細胞癌細胞においてはMYCの活性化などを介して増殖に関与している.Wnt/βカテニン経路阻害薬については既存薬やいくつかの分子標的薬が開発途中である.一方でWnt/βカテニン経路の賦活化が肝細胞癌の微小環境における免疫細胞の組織障害性活動を抑制することが示されており2),CTNNB1変異を有する症例に対する免疫療法介入は大きな効果を示すことが期待される.このようにCTNNB1変異は現行治療の効果予測に有効なバイオマーカーとなるのかもしれない.
② TERT(Telomerase Reverse Transcriptase)遺伝子変異は肝細胞癌に頻度50~60%で認められる遺伝子変異であり,テロメアの調節するテロメラーゼを活性化させ,腫瘍細胞の不死化(不老化)に寄与する3).対応する分子標的薬の開発は困難であり有用な報告はないが,一方でリキッドバイオプシーとしてその発現を評価することで進行肝細胞癌のバイオマーカーおよび予後指標となり得ることが示されており4),新規治療ガイドツールとなる可能性がある.今後の開発が待たれる.
③ TP53遺伝子変異は肝細胞癌に約40%で認められる遺伝子変異である1)
3).TP53はDNA障害など細胞の異常に対応しており,TP53の変異は多くの癌腫で発癌に関わるため,野生型はがん抑制遺伝子として働いているものと考えられている.このため,TP53遺伝子変異に対する標的治療薬が開発されれば多くの癌腫において治療効果を発揮する可能性があり,期待が持たれているが,現在のところ利用可能な分子標的薬は未だ開発されていない5).一方,Sinnらは膵癌術後補助療法としてゲムシタビンを使用した臨床試験CONKO-001における切除サンプルを用いた検討にて,TP53変異のある膵癌ではゲムシタビンの感受性が高い可能性を指摘している6).TP53変異の有無は,ひとまず細胞傷害性抗癌剤治療の指標となるのかもしれない.
III.胆道癌の遺伝子変異と層別化治療への展望
① FGFR2融合遺伝子は胆道癌の5~15%に認められ,その殆どが肝内胆管癌で認められる1)
7)
8). FGFR2融合遺伝子から産生されるFGFR融合蛋白はリガンド非依存的にチロシンキナーゼを活性化し,FGFR経路を賦活化して下流経路を活性化させており, MAPK経路やPI3K-AKT経路,さらにSTAT経路などが活性化され,抗アポトーシス作用や細胞分裂を促進する.FGFRには1~5のサブユニットがあり,多くのFGFR阻害薬(ペミガチニブ:FGFR1~3を阻害,インフィグラチニブ:FGFR1~5を阻害,フチバチニブ:FGFR1~4を阻害)が開発され,第Ⅱ相試験にてその治療効果が示された(表1)8)
9).臨床試験では標準治療終了後のFGFR融合遺伝子のある症例に対し,単剤で治療効果を示した7).現在はFirst lineとしてGC療法と比較する国際的第Ⅲ相試験がそれぞれの薬剤で進行中である7).本邦でも2021年6月から標準治療終了後の症例でペミガチニブの保険使用が可能となった.今後,更に踏み込んで既存の抗癌剤との併用による相乗効果の有無などの検討についても結果を期待したい.
② IDH1(Isocitrate dehydrogenase 1)遺伝子変異は胆管癌の7~20%に認められる遺伝子変異であるが,その殆どは肝内胆管癌と言われている1)
7)
8).IDH1/2蛋白は本来正常のエネルギー代謝に関わり,NADP+を補酵素にイソクエン酸からα-ケトグルタル酸(αKG)を産生する.しかし変異型IDH1/2蛋白はαKGの産生能を失う一方でNADPHを補酵素にαKG依存性にD-2-ヒドロキシグルタル酸(D2HG)を産生する.このためαKG依存性ジオキシゲナーゼが阻害されることで,関連する酵素群の活性化に影響を与え,低酸素応答やエピジェネティクス制御を撹乱し,腫瘍へ影響を及ぼしている.近年,IDH1遺伝子変異蛋白を標的とした阻害薬(イボシデニブ)が開発され,胆道癌に対する第Ⅲ相試験が行われ,治療効果が証明された(ClarIDHy試験,表1)10). IDH1変異型蛋白阻害薬はその作用機序から腫瘍へ幅広い影響を与える可能性がある一方で,既存の細胞傷害性抗癌剤の作用点とは異なるため,今後First lineでの治療としてはどうか,既存の治療薬との併用はどうか,などのさらなる治療応用と発展が期待される1)
7).また,興味深いことにIDH1遺伝子変異はFGFR融合遺伝子を示す症例とは重複しないことが多いと報告されている11)
12).この報告通りであれば両者の遺伝子異常頻度を総計すると相当数の胆道癌患者がどちらかの治療を受けられる可能性がある.残念ながら,前述のペミガチニブと違い,現在のところイボシデニブは未だ本邦での保険承認が得られていないが,選択肢の少なかった胆道癌治療にFirst lineから層別化治療を行える日も近いと思われる.
③ ERBB2遺伝子異常(増幅(コピー数異常)や変異)は肝内胆管癌で3%,肝外胆管癌で11%,胆嚢癌で16%の頻度で同定される7)
8).ERBB2遺伝子異常がある癌細胞ではHER2受容体を過剰発現させ,リガンドの感受性を高めることで下流経路(MAPK経路,PI3K-AKT経路など)を活性化している.トラスツズマブ,ペルツズマブやT-DM1(Trastuzumab-emtansine:トラスツズマブとチュブリン阻害剤をリンカー結合させた薬剤)などおもにHER2陽性乳癌に用いられていた分子標的薬を用いて第Ⅱ相試験が行われ,良好な結果が示されている13)
14).今後のさらなる結果の蓄積に期待される.
④ BRAFの遺伝子変異は多くの癌腫で認められる遺伝子変異であり,なかでもv600Eの変異は悪性黒色腫や大腸癌などでよく認められ,研究が進んでいる.胆道癌では5%未満に認められるとされるが,肝内胆管癌に比較的多い7)
8).BRAFv600Eの変異は,リガンドによる賦活化に依らずMAPK経路が異常に活性化している状態を引き起こすため,MAPK経路の主要蛋白であるBRAFとMEKを阻害することで治療効果を示すことが知られており,BRAFv600E変異のある胆道癌に対してもダブラフェニブ(BRAF阻害薬)+トラメチニブ(MEK阻害薬)を使用した臨床試験が行われた(表1)15).治療効果に期待できる報告が寄せられており,今後の発展が期待される.
このように,胆道癌におけるゲノム治療については,肝内胆管癌の遺伝子変異を対象としているものが多く,その他の癌については,遺伝子変異の症例頻度が高いものが少ないこともあって開発が進んでおらず,今後の課題となっている.

IV.膵癌(浸潤性膵管癌)の遺伝子変異と治療の展望
① BRCA1/2遺伝子変異は膵癌の約6%で認められる16)
17). BRCA遺伝子変異はHRD(homologus recombination repair deficiency:DNA相同組み換え修復異常)を引き起こし,癌化の原因となるDNA損傷の蓄積をきたしている.BRCA1/2遺伝子変異を伴って癌化した細胞では,プラチナ製剤によって起きるDNA鎖間架橋の修復が進まないため治療効果が高くなると予想される.さらに1本鎖切断を修復するPARPを阻害することでさらに治療効果を高めることが期待される.実際,BRCA1/2遺伝子変異のある症例にはプラチナ製剤が非常に有効であり18),PARP阻害薬は休薬後に用いることでプラチナ製剤による治療効果を遷延させる効果を第3相試験にて示され(POLO試験,表1)19),PARP阻害剤のオラパリブが本邦でも保険収載されている.膵癌では比較的稀な遺伝子変異ではあるが,BRCA1/2遺伝子変異が認められた際には積極的にこれらの薬剤を選択することが推奨される.
② KRAS変異は膵癌の約90%の症例で認められ,最も頻度の多い遺伝子変異である16)
17).この遺伝子変異に対して,KRAS変異そのものもしくはRAS経路に代表される下流経路を標的とした治療が研究されている.KRAS変異のうちG12C変異は膵癌の1.7%で認められる変異であり20),KRAS変異の中では比較的稀である.分子標的薬アダグラシブやソトラシブなどはこの変異に不可逆的かつ選択的に結合し下流経路の賦活化を阻害し,第1/2相試験では効果を示した(表1)20)
21).その他の変異についてはG12D変異(50%),G12V(30%),G12R(10%)などがあり,現在は様々な薬剤が試されている段階である.KRAS変異の下流経路として,MAPK経路が注目されMEK阻害薬の臨床試験が行われたが,十分な効果を示さなかった22).しかしMEK阻害剤やさらに下流のERK阻害剤はオートファジーの賦活と関与し,免疫チェックポイント阻害剤の効果を増強する可能性が示されたため23)
24),分子標的薬にオートファジー阻害薬,さらに免疫チェックポイント阻害薬との併用につき臨床試験が行われており,新たな知見が得られる可能性があり,今後の発展が期待される.
③ NRG1融合タンパクは膵癌の0.5%に認められる,稀なゲノム異常であるが,KRAS野生型の若年膵癌患者に比較的多いと言われている16)
17).NRG1はEGFファミリーの一つであり,膵癌ではCDH1やATP181,VTCN1と融合タンパクを形成し細胞膜表面で発現する.融合蛋白は周囲のHER2,HER3,HER4の受容体にEGF様リガンドを介して賦活化させEGFR経路を活性化させる.NRG1融合遺伝子を持つ膵癌に対してHER2/HER3抗体であるzenocutuzumabが用いられ,有望な治療成績が報告されている(表1)25).
④ CDKN2Aの遺伝子異常(欠損/変異)は10~65%の膵癌に認められ,CDK4/6を増加させて細胞増殖を引き起こす16)
17).しかしCDKN2Aの遺伝子異常をもつ膵癌患者に対してCDK4/6阻害剤単独治療は効果を示さなかった(表1)26).細胞傷害性抗癌剤の薬理作用を考慮し,CDK4/6阻害剤は抗癌剤投与後に連続して投与することで効果を示す可能性が示されており27),今後既存薬剤との併用について,その投与方法から検討することに期待される.

V.免疫チェックポイント阻害薬
近年は免疫チェックポイント阻害薬の発展が目覚ましい.本邦で現在保険収載が得られている免疫チェックポイント阻害薬はPD-1阻害薬であるニボルマブ,ペムブロリズマブ,CTLA-4阻害薬であるイピリムマブ,PD-L1阻害薬であるデュルマブマブ,アテゾリズマブ,アベルマブがある.
このうち標準治療終了後の肝胆膵領域癌に対して,MSI-High(高頻度マイクロサテライト不安定性),TMB-High(高い腫瘍遺伝子変異量)であればペムブロリズマブの使用が可能である.また,肝細胞癌ではアテゾリズマブが切除不能肝細胞癌の第1選択薬の一つとなっている.
アテゾリズマブ+ベバシズマブ療法はソラフェニブ治療とのランダム化比較試験にて予後延長効果が示され(IMbrave150試験)28),本邦でも2020年9月から保険収載となった.この試験では組み入れ時に作用点であるPD-L1やVEGFの評価はしていないが,癌組織中PD-L1発現がニボルマブの効果に関与することや29),血液サンプルから得られる血中循環腫瘍DNAの解析で,APOBEC遺伝子変異(DNA変異導入機能をもちDNA修復経路異常からマイクロサテライト不安定性に関連)がある症例では免疫チェックポイント阻害剤の治療効果があることが示されており30),今後より効果の高い患者層に対して層別化治療となっていくかもしれない.
胆膵領域癌において免疫チェックポイント阻害薬は現在のところは適応が限られているが,肝臓癌のように多剤との併用によって治療効果が改善し,胆膵領域癌でもFirst lineとなる可能性はある.現在様々な臨床試験が行われており,今後の結果に期待される.
VI.おわりに
肝胆膵領域癌の層別化治療への可能性として,標的となりうる遺伝子変異と期待される治療薬について概説した.
新規薬剤の開発も盛んであり,遺伝子変異に対する層別化治療が日常診療となる日も近いと感じられる.
利益相反:なし
文献
1) Zhuravleva E , O’Rourke CJ , Andersen JB : Mutational signatures and processes in hepatobiliary cancers. Nat Rev Gastroenterol Hepatol, 19(6): 367-382, 2022.
2) Sia D , Jiao Y , Martinez-Quetglas I , et al.: Identification of an immune-specific class of hepatocellular carcinoma, based on molecular features. Gastroenterology, 153(3): 812-826, 2017.
3) Shibata T , Arai Y , Totoki Y : Molecular genomic landscapes of hepatobiliary cancer. Cancer Sci, 109(5): 1282-1291, 2018.
4) Oversoe SK , Clement MS , Pedersen MH , et al.: Tert promoter mutated circulating tumor DNA as a biomarker for prognosis in hepatocellular carcinoma. Scand J Gastroenterol, 55(12): 1433-1440, 2020.
5) Levine AJ : Targeting the p53 protein for cancer therapies: The translational impact of p53 research. Cancer Res, 82(3): 362-364, 2022.
6) Sinn M , Sinn BV , Treue D , et al.: tp53 mutations predict sensitivity to adjuvant gemcitabine in patients with pancreatic ductal adenocarcinoma: Next-generation sequencing results from the conko-001 trial. Clin Cancer Res, 26(14): 3732-3739, 2020.
7) Brindley PJ , Bachini M , Ilyas SI , et al.: Cholangiocarcinoma. Nat Rev Dis Primers, 7(1): 65, 2021.
8) Takeda T , Sasaki T , Fukuda K , et al.: Risk factors for gemcitabine plus nab-paclitaxel-induced interstitial lung disease in pancreatic cancer patients. Int J Clin Oncol, 26(3): 543-551, 2021.
9) Abou-Alfa GK , Sahai V , Hollebecque A , et al.: Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: A multicentre, open-label, phase 2 study. Lancet Oncol, 21(5): 671-684, 2020.
10) Abou-Alfa GK , Macarulla T , Javle MM , et al.: Ivosidenib in idh1-mutant, chemotherapy-refractory cholangiocarcinoma (claridhy): A multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol, 21(6): 796-807, 2020.
11) Hollebecque A , Silverman I , Owens S , et al.: 720p - comprehensive genomic profiling and clinical outcomes in patients (pts) with fibroblast growth factor receptor rearrangement-positive (fgfr2+) cholangiocarcinoma (cca) treated with pemigatinib in the fight-202 trial. Ann Oncol, 30: v276, 2019.
12) Farshidfar F , Zheng S , Gingras MC , et al.: Integrative genomic analysis of cholangiocarcinoma identifies distinct idh-mutant molecular profiles. Cell Rep, 18(11): 2780-2794, 2017.
13) Jhaveri KL , Wang XV , Makker V , et al.: Ado-trastuzumab emtansine (t-dm1) in patients with her2-amplified tumors excluding breast and gastric/gastroesophageal junction (gej) adenocarcinomas: Results from the nci-match trial (eay131) subprotocol q. Ann Oncol, 30(11): 1821-1830, 2019.
14) Hainsworth JD , Meric-Bernstam F , Swanton C , et al.: Targeted therapy for advanced solid tumors on the basis of molecular profiles: Results from mypathway, an open-label, phase iia multiple basket study. J Clin Oncol, 36(6): 536-542, 2018.
15) Subbiah V , Lassen U , Élez E , et al.: Dabrafenib plus trametinib in patients with brafv600e-mutated biliary tract cancer (roar): A phase 2, open-label, single-arm, multicentre basket trial. Lancet Oncol, 21(9): 1234-1243, 2020.
16) Connor AA , Gallinger S : Pancreatic cancer evolution and heterogeneity: Integrating omics and clinical data. Nat Rev Cancer, 22(3): 131-142, 2022.
17) Chakrabarti S , Kamgar M , Mahipal A : Systemic therapy of metastatic pancreatic adenocarcinoma: Current status, challenges, and opportunities. Cancers (Basel), 14(11):2588, 2022.
18) Rebelatto TF , Falavigna M , Pozzari M , et al.: Should platinum-based chemotherapy be preferred for germline breast cancer genes (brca) 1 and 2-mutated pancreatic ductal adenocarcinoma (pdac) patients? A systematic review and meta-analysis. Cancer Treat Rev, 80: 101895, 2019.
19) Golan T , Hammel P , Reni M , et al.: Maintenance olaparib for germline brca-mutated metastatic pancreatic cancer. N Engl J Med, 381(4): 317-327, 2019.
20) Luo J : Kras mutation in pancreatic cancer. Semin Oncol, 48(1): 10-18, 2021.
21) Ou SI , Janne PA , Leal TA , et al.: First-in-human phase i/ib dose-finding study of adagrasib (mrtx849) in patients with advanced kras(g12c) solid tumors (krystal-1). J Clin Oncol, 40(23): 2530-2538, 2022.
22) Infante JR , Somer BG , Park JO , et al.: A randomised, double-blind, placebo-controlled trial of trametinib, an oral mek inhibitor, in combination with gemcitabine for patients with untreated metastatic adenocarcinoma of the pancreas. Eur J Cancer, 50(12): 2072-2081, 2014.
23) Loi S , Dushyanthen S , Beavis PA , et al.: Ras/mapk activation is associated with reduced tumor-infiltrating lymphocytes in triple-negative breast cancer: Therapeutic cooperation between mek and pd-1/pd-l1 immune checkpoint inhibitors. Clin Cancer Res, 22(6): 1499-1509, 2016.
24) Henry KE , Mack KN , Nagle VL , et al.: Erk inhibition improves anti–pd-l1 immune checkpoint blockade in preclinical pancreatic ductal adenocarcinoma. Mol Cancer Ther, 20(10): 2026-2034, 2021.
25) Schram AM , Odintsov I , Espinosa-Cotton M , et al.: Zenocutuzumab, a her2xher3 bispecific antibody, is effective therapy for tumors driven by nrg1 gene rearrangements. Cancer Discov, 12(5): 1233-1247, 2022.
26) Al Baghdadi T , Halabi S , Garrett-Mayer E , et al.: Palbociclib in patients with pancreatic and biliary cancer with cdkn2a alterations: Results from the targeted agent and profiling utilization registry study. JCO Precis Oncol, 3: 1-8, 2019.
27) Salvador-Barbero B , Álvarez-Fernández M , Zapatero-Solana E , et al.: Cdk4/6 inhibitors impair recovery from cytotoxic chemotherapy in pancreatic adenocarcinoma. Cancer Cell, 37(3): 340-353.e346, 2020.
28) Finn RS , Qin S , Ikeda M , et al.: Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med, 382(20): 1894-1905, 2020.
29) Yau T , Park JW , Finn RS , et al.: Nivolumab versus sorafenib in advanced hepatocellular carcinoma (checkmate 459): A randomised, multicentre, open-label, phase 3 trial. Lancet Oncol, 23(1): 77-90, 2022.
30) Litchfield K , Reading JL , Puttick C , et al.: Meta-analysis of tumor- and t cell-intrinsic mechanisms of sensitization to checkpoint inhibition. Cell, 184(3): 596-614.e514, 2021.
PDFを閲覧するためには Adobe Reader が必要です。