日外会誌. 124(2): 157-162, 2023
特集
糖代謝異常と外科医療
2.癌診療と糖尿病
|
北海道大学 消化器外科I 大平 将史 , 武冨 紹信 |
世界的に糖尿病人口は増加の一途を辿っており,日本では現在約1,000万人の糖尿病患者がいると推定されている.糖尿病患者には細小血管症に代表される様々な合併症のリスクが付随するが,それ以外にも糖尿病がない人と比較して各種癌の発癌リスクや発癌後の死亡率が有意に高いことも知られている.そのメカニズムとしては高血糖に起因する酸化ストレスや高インスリン血症に起因するPI3K/Akt経路など,そして肥満と関連する数多くの分子メカニズムが関与している可能性が報告されている.また,糖尿病と癌の関連性は一方通行ではなく,癌による糖尿病の発症リスクの上昇も報告されており,糖尿病と癌は非常に複雑なメカニズムを介して相互に関連していると考えられる.その他にも近年はメトホルミンに代表される糖尿病治療薬に抗癌作用がある可能性が報告されており現在数多くの臨床試験が進行しているが,現状ではその効果を強く支持する結果は得られていない.日常診療においてはこの非常に複雑な癌と糖尿病の関連性を常に念頭において患者の診療にあたり,将来的にはその複雑性の解明に向けて新たな基礎研究・臨床研究を進めていく必要がある.
キーワード
癌診療, 糖尿病, 高インスリン血症, 肥満
I.はじめに
International Diabetes Federationの報告によると,2021年には世界人口の10.5%が糖尿病に罹患しており,2045年までには12.2%まで増加すると見積もられている1).国内外の報告によると糖尿病患者は,糖尿病がない人と比較して癌を発生するリスクが10〜20%程度高いことが知られている2).また,近年はメトホルミンに代表される糖尿病治療薬に抗癌作用があることが報告されており,現在,数多くの臨床試験が進行している.糖尿病は癌の発生・進展と密接な関係があることはこれまでの基礎研究・臨床研究の結果から強く示唆されており,本章ではその糖尿病と癌の関連性についての概要を解説する.
II.糖尿病と癌
世界的に糖尿病人口は増加の一途を辿っており,本邦も例外ではない.日本では,現在約1,000万人の糖尿病患者がいると推定されており,年々増加傾向にある(図1).糖尿病には大きく分けて1型糖尿病と2型糖尿病があるが,1型糖尿病は自己免疫による膵β細胞の破壊に起因するインスリンの絶対的欠乏が原因であり,2型糖尿病は各種生活習慣や遺伝的素因によるインスリン作用の相対的不足が原因で高血糖状態となる.糖尿病はその高血糖のみが問題となるのではなく,その他の様々な合併症が付随するため,それが患者の健康や生命を脅かす要因となる.糖尿病の合併症としては,糖尿病網膜症・糖尿病腎症・糖尿病神経障害の細小血管症がよく知られているが,それ以外にも癌の発生・進展の危険因子であるということも様々な文献により報告されている(表1)2)3).単純な比較は困難であるが,本邦において糖尿病患者の死因に占める悪性新生物の割合は38.3%であり,日本全体の死因に占める悪性新生物の割合である29.5%を大きく上回っていることからもその関連性が想定される4).


III.糖尿病と癌進展
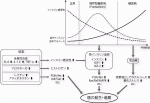
糖尿病が発癌や癌進展に寄与するメカニズムとしては,様々な可能性が考えられている(図2)5).
まずは糖尿病の代表的な症状である高血糖である.癌細胞は十分な酸素の存在下でも酸化的リン酸化よりも解糖系にATPの産生を依存しているとされるワールブルグ効果がよく知られており,癌細胞はグルコースを大量に消費している6).このことから,高血糖は癌細胞へエネルギー源の供給を増やすことで癌の進展に寄与していると考えるのが自然である.また,グルコースが終末糖化産物(Advanced Glycation End Products, AGEs)に代謝される過程で生じる活性酸素による酸化ストレスが細胞のDNAに損傷を与えることによって,発癌を促進するメカニズムも考えられている7).血中グルコース濃度の指標となるHbA1cと様々な癌の関連性を検討したメタアナリシスの結果では,HbA1cの上昇は乳癌・結腸直腸癌・胃癌・膵癌・肝癌のリスク上昇に関連すると報告されている8).また,1型糖尿病患者においては高インスリン血症の影響を排除した高血糖の影響をみることができるが,1型糖尿病患者では肝癌・膵癌・腎癌・子宮内膜癌・卵巣癌の発癌が増えるという報告もあり9),臨床的にも高血糖と癌の関連性は疑われる.
次に高インスリン血症の影響であるが,これは1型糖尿病には当てはまらず2型糖尿病に関連する病態である.2型糖尿病では血糖の上昇が血中インスリンレベルの上昇で代償されるPrediabetesと呼ばれる状態があり,糖尿病の診断よりも最大で18年先行するとも言われている10).糖尿病患者は診断から最初の1カ月の間に乳癌・子宮内膜癌・結腸直腸癌がみつかることが多いことから11),発癌までの時間を考慮すると高血糖ではなくPrediabetes phaseの高インスリン血症が発癌に関与している可能性が高いと考えられる.
インスリンはインスリン受容体に作用し,PI3K /Akt経路を介してGlut4を細胞膜へ移行させ,細胞内へのグルコースの取り込みを促進する.インスリンによるPI3K/Akt経路の活性化はmTORの活性化やβ-cateninの核内移行を促進するため,それらのシグナルが細胞増殖や血管新生を促進し,癌の進展に寄与していると考えられる.また,インスリンは肝臓におけるインスリン様成長因子1(Insulin-like growth factor-1,IGF-1)の産生を増加させ,かつIGF-1・IGF-2に結合するIGF- binding proteins(IGFBPs)を低下させることで,受容体に結合可能なIGF-1・IGF-2の量を増加させるため12),それが癌細胞増殖に寄与している可能性も考えられている.
糖尿病に高頻度で合併する肥満も癌においては重要なリスクファクターである.肥満状態の脂肪組織からはIL-6,IL-1βやTNF-αなどの炎症性サイトカインの産生が増加することにより全身性の炎症を引き起こし,それがインスリン抵抗性や癌の進展に寄与していると考えられている13).その他にも,脂肪組織でのアロマターゼ発現量の増加が血中の活性型エストロゲンの量を増加させ,それが乳癌の進展に寄与している14).
また,近年糖尿病が癌の発生を促進する新たな知見として細胞競合が関与していることを示す報告がなされた.癌の原因となる変異細胞は通常では細胞競合で正常細胞により排除され発癌が抑制されているが,糖尿病での高インスリン血症の状態では排除されるべき変異細胞の生存に有利な環境を与えて増殖能を亢進することで発癌に寄与しているというものである15).
IV.糖尿病治療薬の抗癌作用
抗癌作用があると報告されている糖尿病治療薬の代表がビグアナイド系血糖降下剤であるメトホルミンである.メトホルミンはAMPキナーゼ(AMPK)を活性化させ,肝臓での糖新生を抑制することで血糖値を低下させるが,癌細胞においてはその活性化したAMPKはPI3K/Akt経路の下流にあるmTORを抑制することが知られており,それが癌の抑制につながっている可能性が考えられている16).
2005年にメトホルミンの抗癌作用の可能性が報告されてから17),数多くの基礎実験や臨床試験が行われてきた.しかしここ数年の臨床試験の結果では,その効果を否定するものが多い.乳癌患者に対するメトホルミンの癌抑制効果を検証したPhaseⅢの大規模な臨床試験(MA.32)の結果が2022年に報告されたが,プラセボに対するメトホルミンの効果は有意では無いということが判明した18).また,非小細胞肺癌に対する放射線化学療法とメトホルミンの併用療法に関する臨床試験(OCOG-ALMERA)では,メトホルミン併用群において有意に生存率が低いという結果が出ている19).それ以外にもHCCに対する肝切除後の生存率にもメトホルミンは影響しないことが報告されている20).乳癌以外の臨床試験は小規模もしくは後方視的な臨床試験であることや,卵巣癌におけるPhaseⅡの臨床試験ではメトホルミンに癌幹細胞を減少させる効果があったことなどを考えると21),乳癌以外でもより大規模な前向きの臨床試験の結果が待たれる.しかし,これまでの臨床試験の結果を踏まえるとメトホルミンに対する過剰な期待は禁物であると考えられる.
メトホルミン以外にもロシグリタゾンやピオグリタゾンなどのチアゾリジン誘導体にも抗癌作用がある可能性が報告されている.チアゾリジン誘導体はPPARγのアゴニストとして働き,インスリン抵抗性の改善や肝臓での糖新生を抑制する作用があるが,肺癌や乳癌,大腸癌においては,そのほかにもアポトーシスや細胞周期停止により,抗癌作用がある可能性が考えられている22).しかし,いくつかの臨床試験やメタアナリシスではその効果は否定されており23)
~
25),抗癌作用は確実なものではない.
V.癌による糖尿病への影響
これまで記載してきたように糖尿病は癌のリスクファクターであるが,逆に癌が糖尿病のリスクファクターとなる可能性を指摘する報告もある.韓国の大規模なコホート研究で,固形癌への罹患後は癌を有さないグループに比べて糖尿病の発症リスクが35%上昇するということが報告された26).膵癌・腎癌・肝癌・胆嚢癌・肺癌・乳癌・胃癌・甲状腺癌などで糖尿病のリスクが上昇する可能性が指摘されているが,その分子メカニズムに関しては原発臓器ごとに異なっている可能性が高く,今後の研究の進展が待たれる.
乳癌においては,化学療法を受けた群では診断後2年以内の早期の糖尿病発症率が乳癌を有さない女性と比較して有意に高いが,化学療法を受けていない群では診断後3年以降から糖尿病の発症が増加し始める27).このことから,癌に起因する耐糖能異常においては,化学療法を介する関連性と,化学療法を介さない関連性の2種類が存在することが示唆される.
また近年様々な癌に対して適応が拡大している免疫チェックポイント阻害薬も,その有害事象の一つとして1型糖尿病の発症があり急激な転機を辿る可能性があるため28),常にその可能性を念頭に置いておく必要がある.
VI.おわりに
糖尿病は癌のリスクファクターであり,癌は糖尿病のリスクファクターである.日常診療においてはそれらの関連性を常に念頭におきながら癌患者の治療にあたる必要がある.また,現在新たな癌治療としての利用が期待されている糖尿病治療薬の抗癌作用に関しては各臓器における大規模な臨床試験を含めた今後の研究結果を待つ必要がある.
利益相反:なし
文献
1) Sun H, Saeedi P, Karuranga S, et al.: IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract, 183: 109119, 2022.
2) Goto A, Noto H, Noda M, et al.: Report of the Japan diabetes society/Japanese cancer association joint committee on diabetes and cancer, Second report. Cancer Sci, 107(3): 369-371, 2016.
3) Tsilidis KK, Kasimis JC, Lopez DS, et al.: Type 2 diabetes and cancer: umbrella review of meta-analyses of observational studies. BMJ, 350:g7607, 2015.
4) Nakamura J, Kamiya H, Haneda M, et al.: Causes of death in Japanese patients with diabetes based on the results of a survey of 45,708 cases during 2001-2010: Report of the Committee on Causes of Death in Diabetes Mellitus. J Diabetes Investig, 8(3): 397-410, 2017.
5) Bar-Tana J: Type 2 diabetes - unmet need, unresolved pathogenesis, mTORC1-centric paradigm. Rev Endocr Metab Disord, 21(4): 613-629, 2020.
6) Liberti MV, Locasale JW: The Warburg Effect: How Does it Benefit Cancer Cells? Trends Biochem Sci, 41(3): 211-218, 2016.
7) Turner DP: The Role of Advanced Glycation End-Products in Cancer Disparity. Adv Cancer Res, 133: 1-22, 2017.
8) de Beer JC, Liebenberg L: Does cancer risk increase with HbA1c, independent of diabetes? Br J Cancer, 110(9): 2361-2368, 2014.
9) Carstensen B, Read SH, Friis S, et al.: Cancer incidence in persons with type 1 diabetes: a five-country study of 9,000 cancers in type 1 diabetic individuals. Diabetologia, 59(5): 980-988, 2016.
10) Faerch K, Witte DR, Tabak AG, et al.: Trajectories of cardiometabolic risk factors before diagnosis of three subtypes of type 2 diabetes: a post-hoc analysis of the longitudinal Whitehall II cohort study. Lancet Diabetes Endocrinol, 1(1): 43-51, 2013.
11) Singh S, Earle CC, Bae SJ, et al.: Incidence of Diabetes in Colorectal Cancer Survivors. J Natl Cancer Inst, 108(6):djv402, 2016.
12) Crowe FL, Key TJ, Allen NE, et al.: A cross-sectional analysis of the associations between adult height, BMI and serum concentrations of IGF-I and IGFBP-1 -2 and -3 in the European Prospective Investigation into Cancer and Nutrition (EPIC). Ann Hum Biol, 38(2): 194-202, 2011.
13) Gallagher EJ, LeRoith D: Obesity and Diabetes: The Increased Risk of Cancer and Cancer-Related Mortality. Physiol Rev, 95(3): 727-748, 2015.
14) Howe LR, Subbaramaiah K, Hudis CA, et al.: Molecular pathways: adipose inflammation as a mediator of obesity-associated cancer. Clin Cancer Res, 19(22): 6074-6083, 2013.
15) Sanaki Y, Nagata R, Kizawa D, et al.: Hyperinsulinemia Drives Epithelial Tumorigenesis by Abrogating Cell Competition. Dev Cell, 53(4): 379-389 e375, 2020.
16) Lega IC, Shah PS, Margel D, et al.: The effect of metformin on mortality following cancer among patients with diabetes. Cancer Epidemiol Biomarkers Prev, 23(10): 1974-1984, 2014.
17) Evans JM, Donnelly LA, Emslie-Smith AM, et al.: Metformin and reduced risk of cancer in diabetic patients. BMJ, 330(7503): 1304-1305, 2005.
18) Goodwin PJ, Chen BE, Gelmon KA, et al.: Effect of Metformin vs Placebo on Invasive Disease-Free Survival in Patients With Breast Cancer: The MA.32 Randomized Clinical Trial. JAMA, 327(20): 1963-1973, 2022.
19) Tsakiridis T, Pond GR, Wright J, et al.: Metformin in Combination With Chemoradiotherapy in Locally Advanced Non-Small Cell Lung Cancer: The OCOG-ALMERA Randomized Clinical Trial. JAMA Oncol, 7(9): 1333-1341, 2021.
20) Cho WR, Wang CC, Tsai MY, et al.: Impact of metformin use on the recurrence of hepatocellular carcinoma after initial liver resection in diabetic patients. PLoS One, 16(3):e0247231, 2021.
21) Brown JR, Chan DK, Shank JJ, et al.: Phase II clinical trial of metformin as a cancer stem cell-targeting agent in ovarian cancer. JCI Insight, 5(11):e133247, 2020.
22) Blanquicett C, Roman J, Hart CM: Thiazolidinediones as anti-cancer agents. Cancer Ther, 6(A): 25-34, 2008.
23) Monami M, Lamanna C, Marchionni N, et al.: Rosiglitazone and risk of cancer: a meta-analysis of randomized clinical trials. Diabetes Care, 31(7): 1455-1460, 2008.
24) Koro C, Barrett S, Qizilbash N: Cancer risks in thiazolidinedione users compared to other anti-diabetic agents. Pharmacoepidemiol Drug Saf, 16(5): 485-492, 2007.
25) Du R, Lin L, Cheng D, et al.: Thiazolidinedione therapy and breast cancer risk in diabetic women: A systematic review and meta-analysis. Diabetes Metab Res Rev, 34(2), 2018.
26) Hwangbo Y, Kang D, Kang M, et al.: Incidence of Diabetes After Cancer Development: A Korean National Cohort Study. JAMA Oncol, 4(8): 1099-1105, 2018.
27) Lipscombe LL, Chan WW, Yun L, et al.: Incidence of diabetes among postmenopausal breast cancer survivors. Diabetologia, 56(3): 476-483, 2013.
28) Kotwal A, Haddox C, Block M, et al.: Immune checkpoint inhibitors: an emerging cause of insulin-dependent diabetes. BMJ Open Diabetes Res Care, 7(1):e000591, 2019.
PDFを閲覧するためには Adobe Reader が必要です。