日外会誌. 123(6): 538-545, 2022
特集
ロボット支援下手術の現況と展望
5.ロボット支援下手術の現況と展望 <膵臓>
|
岡山大学 消化器外科学 高木 弘誠 , 八木 孝仁 , 楳田 祐三 , 吉田 龍一 , 藤 智和 , 安井 和也 , 藤原 俊義 |
ロボット支援下膵切除術は,欧米先進諸国において近年急速に普及し,その手術成績についても一定のエビデンスが得られてきている.一方,本邦では2020年の保険収載以降,大学病院や基幹病院を中心として徐々に普及しつつあるが,標準手術としての定着にはもう少し時間を要するのが現状である.高難度手術である膵頭十二指腸切除術や膵体尾部切除術に対するロボット支援下手術の安全な導入と普及には,術式の定型化とトレーニングシステムの確立が急務である.さらに,安全な手術の実践には,ロボット支援下手術の特性を理解し,外科医個人のみならずチームとして成熟していくことが重要である.今回,ロボット支援下膵切除術の欧米におけるコンセンサスを検討するとともに,当施設におけるロボット支援下膵切除術の定型化に向けた手術概要とトレーニングシステム,チームとしての取り組みを報告する.
キーワード
ロボット支援手術, 膵切除
I.はじめに
ロボット支援下膵切除術は,米国ではUniversity of Pittsburgh Medical Center(UPMC)を中心に2000年代に導入され,一定のエビデンスの確立とともに,急速に普及しつつある1).欧州に目を向けると,オランダでは,早くから鏡視下膵切除術に対するトレーニングプログラム(LAELAPS-1試験2),LAELAPS-2試験3))が構築され,2016年にはUPMCの協力のもとロボット支援下膵頭十二指腸切除術(Robotic pancreatoduodenectomy: RPD)に特化したトレーニングプログラム(LAELAPS-3試験4))が発足した.筆者は,2017~2019年にオランダ・ロッテルダムのErasmus Medical Centerに肝胆膵・移植外科のClinical fellowとして勤務する中で,LAELAPS-3試験に参加し,系統的なロボット支援下膵切除術の教育を受けた5).
本邦では2020年4月に腹腔鏡下膵体尾部腫瘍切除術(K702-2)と腹腔鏡下膵頭部腫瘍切除術(K703-2)においてロボット支援下膵切除術が保険収載され,大学病院や基幹病院を中心に徐々に普及してきている.ロボット支援下膵体尾部切除術(Robotic distal pancreatectomy: RDP)では,通常のリンパ節郭清を伴わないRDP,膵臓癌に対するRadical antegrade modular pancreatosplenectomy(RAMPS)6),脾臓温存術式(Spleen-preserving distal pancreatectomy: SPDP)7)など術式は多岐に渡る.一方,RPDは肝胆膵外科領域では高難度手術の一つであり,複雑な切除に加え,高難度の消化管再建を要する.いずれの術式も,膵臓手術の十分な知識と経験に加え,ロボット操作に習熟する必要がある.
今回,ロボット支援下膵切除術の現状を術式毎に報告し,今後の展望を考察する.
II.ロボット支援下膵切除術のコンセンサスと導入
鏡視下膵切除術のコンセンサスに関して,International Study Group on Minimally Invasive Pancreas Surgery(I-MIPS)からMiami International Evidence-based Guidelinesが報告された8).術式毎の鏡視下膵切除術,患者選択,施設基準,トレーニング体制などに関する26項目について,エビデンスレベルが評価され,今日のロボット支援下膵切除術の指標となっている(表1).
本邦では,ロボット支援下膵切除術導入に関して,日本内視鏡外科学会・日本肝胆膵外科学会から『ロボット支援下膵切除術導入に関する指針』が示され,術者条件,および施設条件が厳密に定められた.さらにレジストリー制度として,National Clinical Databaseへの症例登録が必須となっている.

III.ロボット支援下膵頭十二指腸切除術
Miami Guidelinesでは,「開腹PD(OPD)よりも腹腔鏡下PD(LPD)・RPDを推奨するデータは不十分(GRADE 2A)」,「悪性疾患に対するLPD/RPDは選択された患者にとって有効(GRADE 2B)」,「術前化学療法後の膵頭部癌に対するLPD/RPDとOPDの比較はデータ不十分(GRADE 2C)」,「LPDとRPD間の優越性に関するデータは不十分(GRADE 2C)」と報告されている(表1)8).
OPD(n = 48,382),LPD(n = 5,570),RPD(n = 2,488)の手術成績を検討した最新のメタ解析では,OPDに対してRPDは術後在院死亡(リスク比0.78,95%CrI 0.54~1.12),臨床的膵液瘻(リスク比0.87,95%CrI 0.64~1.14),重篤な合併症率(リスク比0.93,95%CrI 0.65~1.14)と遜色の無い成績であった9).また,OPDと比べ,LPD/RPDでは有意に入院期間は短く,出血量や,感染性合併症・呼吸器合併症発生率は少なかった.以上より,術者や施設の経験に応じて適切な術式を選択することが,術後アウトカムの改善に寄与する可能性が示唆された.
治療成績に関して,UPMCからの初期500例のRPD手術成績は,平均手術時間415分,出血量中央値250 mL,開腹移行率5.2%,平均入院期間8日,臨床的膵液瘻7.8%,胃内容排泄遅延(grade B, C)14.8%,重篤な術後合併症24.8%,30日死亡率1.8%,90日死亡率3.0%と報告されている1).一方,オランダからのLAELAPS-3試験(n = 275)の結果では,手術時間中央値420分,出血量中央値250 mL,開腹移行率6.5%,入院期間中央値12日,臨床的膵液瘻23.6%,胃内容排泄遅延(grade B, C)33.1%,重篤な術後合併症44.4%,30日死亡率2.2%,90日死亡率4.7%であった4).
当院におけるRPDの実際の手術手順を概説する.当院では,筆者のオランダでの経験を基に,UPMCスタイルを踏襲している10)
~
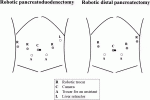
12).体位は仰臥位・開脚位,頭高位7度,右側高位7度で手術を開始する.ポート配置は図1に示す.RPDの工程は多岐にわたるため,大きく七つのステップに分類している(表2).切除パートでは,Kocher授動から開始する(ステップ1).胃を挙上し網嚢腔を開放,十二指腸・結腸間膜間を剥離し,右側結腸をある程度授動する.次に,膵頭十二指腸を授動し,トライツ靭帯を幅広く開放する.空腸をトライツ経由で右側へ引き抜き,切離する.続いて,亜全胃温存のラインで胃を切離する.ステップ2は,膵上縁〜肝十二指腸間膜剥離を行う.膵上縁で#8aリンパ節を郭清した後に,総肝動脈から胃十二指腸動脈の分岐部を剥離同定し切離する.さらに膵頚部上縁で門脈を確認する.悪性疾患であれば,ここで肝十二指腸間膜のリンパ節郭清を行う.ステップ3では,膵トンネリング・膵切離を行う.膵下縁で上腸間膜静脈(Superior mesenteric vein: SMV)を同定し,膵トンネリング後にSMV上で膵切離を行う.ステップ4では,膵頭神経叢切離を行う.上腸間膜動脈(Superior mesenteric artery: SMA)をランドマークに,適宜SMA・SMVからの分枝を処理しながら膵頭神経叢を尾側から頭側へ向けて切離する.最後に胆摘と胆管切離を行い,標本切離を行う.下腹部のPfannenstiel incisionから切除標本を回収し,再建へ移る.消化管再建は,膵再建(ステップ5)より開始する.膵再建は,Blumgert変法による膵管空腸粘膜吻合を基本再建法としている.膵実質-空腸漿膜筋層吻合から開始し,続けて膵管-空腸粘膜吻合を行う.膵管ステントをロストステントとして留置している.胆道再建(ステップ6)は胆管空腸吻合を拡張・非拡張に関わらず結節吻合で行い,胆管径に応じてロストステントを留置している.最後に,胃空腸吻合・ブラウン吻合(ステップ7)を付加し,手術終了とする.
PDは高難度術式であり,不完全な消化管再建は術後の膵液瘻や胆汁瘻などの重篤な合併症に直結する.従来の腹腔鏡手術では,鉗子の可動域制限が問題となり,複雑な消化管再建は難易度が高かった.こうした観点からも,拡大視効果や多関節機能を有するロボット支援下手術は,複雑な再建を要するPDにおいて特に有効であると考える.安全にRPDを行うには,膵切除に関する十分な解剖学的知識と手術経験,そして手術手技の定型化が必須とわれわれは考えている.


IV.ロボット支援下膵体尾部切除術
Miami Guidelinesでは,「低悪性度腫瘍に対する腹腔鏡下DP(LDP)・RDPは,開腹DP(ODP)よりも在院期間が短く出血量も少ないため有効である(GRADE 1B)」,「LDP/RDPはODPよりも術後のQuality of lifeが良い(GRADE 2B)」,「膵臓癌に対するLDP/RDPの有効性と安全性は報告されているが,前向き試験は不足している(GRADE 2B)」「LDPもRDPも安全で有効であるため,術者や施設の経験で選択できる(GRADE 1B)」「鏡視下SPDPと開腹SPDPを比較した報告はない(GRADE 2C)」と報告されている(表1)8).
ODP(n = 3,137),LDP(n = 4,250),RDP(n = 990)の治療成績を検討した最新のメタ解析では,出血量,臨床的膵液瘻,術後出血,再手術,重篤な術後合併症,死亡率においてRDPの最も良好な結果が示された13).また,RDPはR0切除率が高く,リンパ節郭清個数が多かった.以上より,RDPの有効性が示された.
治療成績に関して,UPMCからの初期100例のRDP手術成績は,平均手術時間246分,出血量中央値150 mL,開腹移行率2.0%,入院期間中央値6日,臨床的膵液瘻18.0%,死亡率0%であった14).一方,膵臓癌に対するRAMPS施行症例100例の検討では,手術時間中央値235分,出血量中央値210 mL,開腹移行率1.0%,平均入院期間9日,臨床的膵液瘻17.0%,90日死亡率1.0%であった15).腫瘍学的因子に関して,腫瘍径4cm,郭清リンパ節個数12個,リンパ節転移率29.0%,R0切除率 94%であり,膵臓癌に対するRAMPSの安全性と有効性が示された.
当院での①郭清を伴わないRDP,②膵臓癌に対するRAMPS6),③SPDP7),について述べる.疾患や腫瘍局在に応じて膵切離ラインや選択術式は様々であるが,基本的に膵切離を先行し内側アプローチにて膵体尾部の授動を行う12).体位は仰臥位・開脚位,頭高位7度,左側高位7度で手術を開始する.ポート配置は図1,手術手順は表2に示す.通常のRDPでは,まず胃を挙上し網嚢腔を開放(ステップ1),膵切離ラインで膵周囲を剥離(ステップ2),膵切離と脾動静脈の切離を行い(ステップ3),内側アプローチにて膵体尾部を授動する(ステップ4).RAMPSでは,後腹膜郭清を行う.
われわれは,膵臓癌に対するRAMPSやSPDPにおいて従来の腹腔鏡手術よりもRDPは有効と考えている.また,RDPを通してロボット支援下手術の経験を積むことが,RPDの安全な導入につながると考える.



V.その他のロボット支援下膵切除術
ロボット支援下膵全摘術(Robotic total pancreatectomy: RTP)や膵中央切除術(Robotic central pancreatectomy: RCP)は海外からの報告はあるが,本邦では保険収載外である.
RTPは病変が膵臓全体に認める場合に適応となる.Miami Guidelinesでは,RTPに関する推奨は明記されていない.RTP 56症例を検討した最近の総説では,開腹移行率3.6%,重篤な術後合併症率10.7%とRTPの安全性が報告された16).アプローチ方法に関しては,(1)膵離断を行う“dividing technique”と(2)膵離断を行わない“en-bloc technique”が報告されている.“en-bloc technique”に関しては,膵体尾部の操作から開始する方法と膵頭部の操作から開始する方法(the pancreatic head-first approach)が報告されている17).
一方,RCPは膵体部領域に発生した低悪性度腫瘍に対して適応となる術式である.膵頭部および膵尾部を温存するため,術後の膵内・外分泌機能が温存されるが,膵尾側断端と膵空腸吻合を要するため,膵液漏のリスクは高くなる.Miami Guidelinesでは,「鏡視下手術のfeasibilityは報告されているが,開腹手術と比較して安全性に関してはさらなる検討が必要(GRADE 1C)」と報告されている(表1).RCP 265症例を検討した最近の総説では,臨床的膵液瘻発症率は42.3%,重篤な術後合併症率9.4%とRCPのfeasibilityが報告された18).また,術後糖尿病発生頻度は0.3%と機能温存の有効性も示された.

VI.ロボット支援下膵切除術におけるラーニングカーブ
開腹,腹腔鏡,ロボット支援下膵切除術におけるラーニングカーブの評価は重要である.最新の総説では,OPD,LPD,RPDのラーニングカーブはそれぞれ約30例,39例,25例と報告された19).一方,LDP,RDPのラーニングカーブはともに約15例とされている.ラーニングカーブの評価には,評価項目として手術時間や出血量,合併症率などが用いられているが,評価項目の選別は重要となる.しかし,ラーニングカーブには,術者因子(トレーニング,経験,技量など),施設因子(トレーニングシステム,症例数,専属スタッフなど),患者因子(Body mass index,基礎疾患,開腹歴,疾患など),術式など,様々な因子が複雑に絡むため,これらの因子を加味したさらなる検討が必要と考える.
VII.ロボット支援下膵切除術の展望
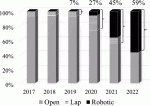
当院では2020年に保険収載に合わせて,まずRPDを導入した.そして2021年にはRDPを導入し,2022年からは腹腔鏡下膵切除術を廃止し,鏡視下膵切除の適応症例は全例ロボット支援下手術で行っている.ロボット支援下手術の導入以降,当院における膵切除症例における鏡視下手術の割合は急増し,2022年5月時点で約60%をロボット支援下手術で行っている(図2).今後,適応拡大に伴い,さらにロボット支援下手術の割合が増加することが予想される.
一方,本邦では保険収載以後多くの施設でロボット支援下膵切除術が導入されているが,手術手順は様々なバリエーションで行われており,系統的なトレーニングシステムは存在しない.従って,術式の標準化とトレーニングシステムの確立が今後の課題である.トレーニングシステムに関して,当院ではオランダでの経験(LAELAPS-3試験)を元にロボット支援下膵切除術トレーニングプログラムを確立している(図3)10).Simulatorトレーニング,Biotissueを用いた吻合トレーニングで外科医個々のSkill-upを図り,手術ビデオを用いたVideoカンファレンスを通して手術チーム内で定型化した手術手技の理解を深化させている.こうした試みと並行して,実臨床を通してRPD/RDPの手術パートを術者・助手毎に更に細分化して段階的に行うことで,安全な手術の実践とチーム全体のビルドアップにつなげている.

VIII.おわりに
ロボット支援下膵切除術の現状と展望を述べた.ロボット支援下膵切除術の安全な導入には,従来の腹腔鏡手術とは異なるロボット支援下手術の特性を理解し,外科解剖の熟知,術式の定型化が重要である.
利益相反:なし
文献
1) Zureikat AH, Beane JD, Zenati MS, et al.: 500 Minimally Invasive Robotic Pancreatoduodenectomies:One Decade of Optimizing Performance. Ann Surg, 273(5): 966-972, 2021.
2) de Rooij T, van Hilst J, Boerma D, et al.: Impact of a Nationwide Training Program in Minimally Invasive Distal Pancreatectomy (LAELAPS). Ann Surg, 264(5): 754-762, 2016.
3) de Rooij T, van Hilst J, Topal B, et al.: Outcomes of a Multicenter Training Program in Laparoscopic Pancreatoduodenectomy (LAELAPS-2). Ann Surg, 269(2): 344-350, 2019.
4) Zwart MJW, Nota CLM, de Rooij T, et al.: Outcomes of a Multicenter Training Program in Robotic Pancreatoduodenectomy (LAELAPS-3). Ann Surg, 2021. Feb 1. doi:10. 1097/SLA. 0000000000004783. Online ahead of print.
5) 高木 弘誠,楳田 祐三,吉田 龍一,他.海外におけるロボット支援下膵頭十二指腸切除の現状.胆と膵,42(3): 217-221, 2021.
6) Takagi K, Umeda Y, Yoshida R,et al.: Robotic Radical Antegrade Modular Pancreatosplenectomy Using the Supracolic Anterior Superior Mesenteric Artery Approach. J Gastrointest Surg, 25(11): 3015-3018, 2021.
7) Takagi K, Umeda Y, Yoshida R, et al.: Robotic spleen-preserving distal pancreatectomy using indocyanine green fluorescence imaging (with video). Asian J Surg, 45(1): 596-597, 2022.
8) Asbun HJ, Moekotte AL, Vissers FL, et al.: The Miami International Evidence-based Guidelines on Minimally Invasive Pancreas Resection. Ann Surg, 271(1): 1-14, 2020.
9) Aiolfi A, Lombardo F, Bonitta G, et al.: Systematic review and updated network meta-analysis comparing open, laparoscopic, and robotic pancreaticoduodenectomy. Updates Surg, 73(3): 909-922, 2021.
10) Takagi K, Umeda Y, Yoshida R, et al.: Surgical training model and safe implementation of robotic pancreatoduodenectomy in Japan:a technical note. World J Surg Oncol, 19(1): 55, 2021.
11) 高木 弘誠.私たちのロボット支援下膵頭十二指腸切除術④.新DS NOW,11: 90-99,2021.
12) 高木 弘誠,楳田 祐三,吉田 龍一,他.ロボット支援下膵切除術の導入と手術教育.手術,76: 69-77,2022.
13) Lyu Y, Cheng Y, Wang B, et al.: Comparison of 3 Minimally Invasive Methods Versus Open Distal Pancreatectomy:A Systematic Review and Network Meta-Analysis. Surg Laparosc Endosc Percutan Tech, 31(1): 104-112, 2020.
14) Shakir M, Boone BA, Polanco PM, et al.: The learning curve for robotic distal pancreatectomy:an analysis of outcomes of the first 100 consecutive cases at a high-volume pancreatic centre. HPB (Oxford), 17(7): 580-586, 2015.
15) Li M, Liu Q, Zhang T, et al.: Evaluating the learning curve of robotic radical antegrade modular pancreatosplenectomy:A retrospective cohort study. Int J Surg, 101:106612, 2022.
16) Takagi K, Koerkamp BG: Robotic Total Pancreatectomy:A Narrative Review. In Vivo, 35(4): 1907-1911, 2021.
17) Takagi K, Koerkamp BG: Robotic Total Pancreatectomy:A Novel Pancreatic Head-First Approach (with Video). J Gastrointest Surg, 25(6): 1649-1650, 2021.
18) Rompianesi G, Montalti R, Giglio MC, et al.: Robotic central pancreatectomy:a systematic review and meta-analysis. HPB (Oxford), 24(2): 143-151, 2022.
19) Müller PC, Kuemmerli C, Cizmic A, et al.: Learning Curves in Open, Laparoscopic, and Robotic Pancreatic Surgery:A Systematic Review and Proposal of a Standardization. Annals of Surgery Open, 3(1):e111, 2022.
PDFを閲覧するためには Adobe Reader が必要です。