日外会誌. 123(1): 95-97, 2022
定期学術集会特別企画記録
第121回日本外科学会定期学術集会
特別企画(7)「≪外科学再興特別企画≫癌に対する免疫治療New Era」
6.癌に対する複合免疫療法の新展開~外科医でなければできないこと~
|
福島県立医科大学 呼吸器外科学講座 鈴木 弘行 , 猪俣 頌 , 山口 光 , 峯 勇人 , 高木 玄教 , 尾崎 有紀 , 渡部 晶之 , 井上 卓哉 , 福原 光朗 , 山浦 匠 , 武藤 哲史 , 岡部 直行 , 松村 勇輝 , 長谷川 剛生 , 大杉 純 , 星野 実加 , 樋口 光徳 , 塩 豊 (2021年4月10日受付) |
キーワード
免疫療法, 免疫チェックポイント阻害薬, 複合免疫療法, Tertiary Lymphoid Structure(TLS)
I.はじめに
本邦では2014年に初めて免疫チェックポイント阻害薬(Immune checkpoint inhibitors:ICI)が悪性黒色腫に承認され,2015年12月に肺癌に対して適応拡大が行われた.その後薬物療法との併用,ICIの併用となど複合免疫療法(Combined immunotherapy:CIT)が開発されている.一方で効果予測因子や有害事象対策などの課題も残されている.本稿では近年のCITについて概説し,外科医がリードすべき課題について言及する.
II.CIT開発の現状
非小細胞肺癌(以下,肺癌)領域でのICI療法およびCITについて概説する.肺癌におけるICIは,まず標準治療不応2次治療以降の単剤療法としてPD-1抗体のニボルマブ,ペンブロリズマブが,次いでPD-L1高発現群に対する一次治療としてペンブロリズマブ単剤療法が適応となった.現在では2種類のPD-1抗体(前述)と2種類のPD-L1抗体(アテゾリズマブ,デュルバルマブ),加えて1種類のCTLA-4抗体(イピリムマブ)が上市されている.種々の殺細胞性抗癌剤との併用や複数のICIの併用など幅広い治療法が選択できる.適応病期は当初は転移を有する進行肺癌のみであったが,その後stage Ⅲ局所進行肺癌に対する放射線化学療法後の維持療法としても使用可能である.現在は手術との併用療法が検討され多くの臨床試験が進行中である.
III.ICI,CIT療法にける課題
1)効果予測因子の解析
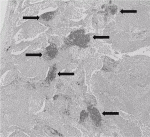
ICI単独療法は約20~30%程度の有効率であり,治療効果の改善を目的としてCITが開発されている.一方,効果予測因子の解明も重要視されている.臨床応用されているものは腫瘍におけるPD-L1分子の発現がある.ただ,PD-L1のみでは効果予測には十分ではないことはこれまでのデータでも示され,臨床例でも実感される.効果予測因子として腫瘍の遺伝子変異数(Tumor mutation burden:TMB)や末梢血中のリンパ球のキャラクター1),腸内細菌叢の変化など様々な因子の検討が進められているが,教室では上述した因子に加え,外科切除検体を用いた腫瘍の微小環境の解析を行ってきた.近年は3次リンパ節構造(Tertiary lymphoid structure:TLS)に着目し解析を進めている(図1).TLS2)は腫瘍の周辺や腫瘍内にみられるリンパ球の集簇巣によって定義付けられるが,その機能や臨床的意義は明らかではない.TLSの特徴の一つに通常のリンパ節構造でみられるHigh Endothelial Venules(HEV)の存在がある.HEVのマーカーであるPeripheral node addressin(PNAd)を用いて確認すると,PNAd陽性の脈管構造がTLS様のリンパ球の集簇巣内に確認された.PNAdのリガンドは接着分子であるCD62L(L-Selectin)が,これは抗原刺激を受ける前のnaïve T細胞のマーカーでもある.CD62L陽性細胞は抗原刺激の後に分子発現が減弱することもよく知られている.以上より腫瘍内部に種々の刺激によってHEV構造を伴うTLSが構築されると,腫瘍の外部からnaïve T細胞がリクルートされる.次いで,TLS内で腫瘍特異的なT細胞の活性化が起き,最終的にCD62L陰性化した活性化T細胞が腫瘍内部で誘導され抗腫瘍を発揮する,というシナリオが想定される.TLSの存在および構築はICI療法の有効性の指標となることも示されている.加えて,われわれは腫瘍内部に集簇する腫瘍特異的なリンパ球は末梢血中では極めて少ないことも確認しており,より腫瘍量が多い(=腫瘍特異的リンパ球が多い)術前にICIを投与することの合理性を裏打ちするものと考えている.これまでの動物実験レベルでの基礎的な検討でも術前治療のほうがより有効性が高いとする報告がなされており,興味深い.実際の患者にこれらのデータがそのまま当てはまるのかどうか,すなわち術前治療と術後治療のいずれがより有効であるのかについては,今後の臨床試験の結果を待つ必要があろう.
2)免疫学的有害事象対策
ICI療法では内分泌障害など様々な免疫学的有害事象(Immune related adverse event:irAE)が発生する.irAEの発生は効果にも関連することが知られ3),適切なマネジメントが求められる.特に多職種によるチーム医療による対応が重要とされている.当院では薬剤部を中心に関連する診療科が関わるirAE対策チームを立ち上げ対策を取っている(Active Care of immune-related Adverse Events Supportive Team@Fukushima:ACiST Fukushima).
IV.おわりに
ICI療法およびCITにおける現状と課題を概説した.効果予測因子および効果発現メカニズムの解析において腫瘍の微小環境を理解することは重要であり,この点で外科医が行う研究の重要性は高まっている.また,irAEをマネジメントすることは実臨床において重要で,そのためにはチーム医療のさらなる充実が必要である.
利益相反
講演料など:小野薬品工業株式会社,アストラゼネカ株式会社
研究費:テラ株式会社,小野薬品工業株式会社,ブリストル・マイヤーズ スクイブ株式会社,MSD株式会社,中外製薬株式会社,大鵬薬品工業株式会社
その他報酬:アストラゼネカ株式会社
文献
1) Topalian SL, Taube JM, Anders RA, et al.: Mechanism-driven biomarkers toguide immune checkpoint blockade in cancer therapy. Nat Rev Cancer, 16: 275-287, 2016.
2) Sautès-Fridman C, Petitprez F, Calderaro J, et al.: Tertiary lymphoid structures in the era of cancer immunotherapy. Nat Rev Cancer, 19: 307-325, 2019.
3) Das S, Johnson DB: Immune-related adverse events and anti-tumor efficacy of immune checkpoint inhibitors. J Immunother Cancer, 15 : 306, 2019.
PDFを閲覧するためには Adobe Reader が必要です。