日外会誌. 121(2): 158-163, 2020
特集
臓器移植の現状と展望
2.心移植
|
東京大学大学院 医学系研究科心臓外科 小野 稔 |
1999年2月に法律に基づく心臓移植が開始されて以来20年以上が経過した.2010年7月から改正臓器移植法が施行され,それまで非常に限られていた心臓移植が年間50例以上施行されるようになった.当初懸念された遠隔成績も10年生存率で約90%を維持していて,国際的に極めて優れた成績となっている.植込み型補助人工心臓が2011年に心臓移植の橋渡し目的で保険償還されたことによって長期の安定した移植待機が可能となり,移植登録希望者が急速に増えることになった.限られた脳死臓器提供数と相まって,2018年の平均移植待機期間は1,310日と3年を超えた.小児の心臓移植は国内での実施は極めて困難で,海外渡航移植に依存せざるを得ない状況が長く続いた.臓器移植法が改正されて小児からの臓器提供が可能となり,また小児用補助人工心臓が2015年に保険償還されたことも影響して,小児心臓移植は2017年から急速に増加してきた.抗HLA抗体(特にドナー特異的抗体:DSA)の検査が身近になり,抗体関連拒絶反応(AMR)の病理,DSAの関与,転帰,治療についての知見が蓄積され,わが国の心臓移植の日常診療においてもようやくDSA,AMRの重要性が認識されるに至った.これらの新しい知見に基づいた移植医療は,今後さらに優れた長期成績を可能にするものと期待される.
キーワード
心臓移植, 脳死臓器提供, 補助人工心臓, マージナルドナー
I.はじめに
心臓移植は重症心不全の確立された外科治療として世界で広く行われている.国際心肺移植学会(ISHLT)の心臓移植2018年 レジストリー報告によると,2017年6月までに141,268例の心臓移植が登録された1).このうち,18歳未満の小児心臓移植は14,606例(10.3%)であった.わが国では1997年10月に臓器移植法が施行され,1999年2月28日に大阪大学で法施行後第1例目が行われた.しかしながら,2010年7月の臓器移植法改正までの約13年間で心臓移植数はわずか69例であった.法改正後に家族承諾による脳死臓器提供が可能となり,これは同時に小児からの提供も可能とした.本稿では,海外および国内における最近の心臓移植の現況について述べる.
II.世界と日本の現況
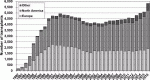
ISHLTレジストリー報告によると,1993年をピークに減少傾向にあった心臓移植は2013年より増加に転じ,2016年には5,842例となった(図1).わが国では,2016年に年間50例を超え,法改正後2019年8月までの9年間で通算407例の心臓移植が実施された.小児における心臓移植は,長年にわたり渡航移植に頼らざるを得ない状況が続いていたが,小児用補助人工心臓であるBerlin heart EXCORが承認されたことが一つの契機となり,2017年6例,2018年7例,2019年は8月までに12例と増加傾向にある.
レシピエントは世界的に高齢化が進んでいる.60歳台の割合は,1982~1998年では16%であったのが,2009~2016年では26%まで増加した.2016年に限定すると29%であった.ドナー年齢の上昇も続いている.1980年代前半には20歳台前半であった小児を含む全心臓ドナーの年齢中央値は,1996年に30歳を越え,2014年には33歳に達した.60歳以上のドナーも増加傾向で,2016年には3.1%であった1).
移植手技は長くLower-Shumway(LS)法が基本であったが,最近ではBicaval(BC)法が主流となりつつある.わが国の2018年までの428例の心臓移植においては,Kitamuraらが報告したModified bicaval法2)が86%の症例で採用されている.1997~2007年までのUnited Network of Organ Sharing(UNOS)20,999症例の分析によると,1997年にはLS法が97.6%と大多数であったのに対して,2007年にはBC法が62.0%と標準術式が入れ替わった3).
平均虚血時間は1992~2003年では3.0時間であったが,2009~2017年6月では3.2時間となった.心臓移植ではHLAの適合をドナー選択基準としていないために,最近の移植でもHLA不適合が0-2 locusである割合は3.9%と低い.1992~2003年までと比較すると,2016年では移植前に補助人工心臓(VAD)が装着されている症例が急激に上昇した(20.1% vs 54.5%)1).これは安全で小型化された植込み型VADの普及によるところが大きい.
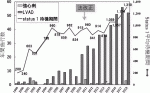
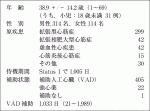
移植施設は2018年9月に新規認定された千葉大学を含め現在10施設である.東京大学,大阪大学,国立循環器病研究センターの3施設では,2015年5月から成人症例に限定して日本循環器学会の事前審査が免除されている.移植待機は重症度によって2グループに分けている.2018年までに行われた428例のうち小児の1例のみがStatus 2で,残りはすべてStatus 1であった.わが国では移植希望登録者数(2019年8月末現在で780名4))と比較して臓器提供者が著しく少ないために待機期間はきわめて長期となっている.図2に日本心臓移植研究会でまとめた年別の待機期間を示すが,2017年に3年を超えた.長期の待機を乗り切るために,ほぼ全例がVADを装着して移植に到達している5).
わが国のレシピエント年齢は欧米よりかなり低く,2018年までの428例の平均は38.9歳であった.また,脳死ドナーが少ない中から提供臓器の利用を高めるために,わが国独自のドナー管理システムMedical consultant(MC)システムが2002年から導入されてきた.このシステムの導入によって,全ドナーに占める心臓利用率は76%と米国の32%をはるかに超えている.そのために心臓ドナー平均年齢(2017年6月までの340例)は41.4歳とやや高く,marginal donorの割合もかなり高い.60歳以上の心臓ドナーの割合も8.8%とISHLT報告より高い.
III.適応
2018年のISHLT報告1)によると,2009~2017年までに移植を受けた18歳以上の患者の原疾患は,拡張型心筋症50%,虚血性心疾患33%であり,拘束型心筋症,弁膜症,先天性心疾患,肥大型心筋症,再移植がいずれも3%ずつであった.わが国の2018年までの428例の原疾患の内訳は,拡張型心筋症が70%と断トツに多く,拡張相肥大型心筋症10%,虚血性心疾患10%,心筋炎後心筋症4%などで,虚血性心疾患の割合が少ないのが特徴である5).わが国では心肺同時移植は認められているが,心腎同時あるいは心肝同時移植は認められていない.
IV.手技
現在の標準移植手技にはLS法とBC法がある.前者は2005年頃まで全世界のスタンダードであった.手技的には容易であるが,洞機能不全がしばしば起こり,遠隔期の三尖弁閉鎖不全症の合併が多い.後者は1990年頃から行われるようになった.移植後のペースメーカー装着がBC法で有意に減少した(LS:16.7%,BC:1.8%)ことが報告され,最近では国際的にBC法が主流となった.わが国では,Kitamuraらが上下大静脈を独立に吻合するのではなく,右房後壁の連続性を維持して,それぞれ心房・大静脈レベルで吻合するModified bicaval法を報告した2).この方法では,ドナー・レシピエント間でしばしば遭遇する大静脈の口径差を調節して吻合しやすいという利点があり,わが国の移植手技の86%を占めている.
V.成績
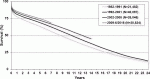
図3にISHLTの年次別成人心臓移植遠隔成績を示す1).時代とともに成績が向上している.最近の1年,5年,10年,20年生存率はそれぞれ,85.4%,74.6%,57.8%,20.0%である.移植後成績の改善傾向は特発性心筋症,虚血性心疾患,先天性心疾患,弁膜症,再移植のいずれでも観察されている.移植後死亡原因では,1カ月以内はグラフト不全(多くはprimary graft dysfunction:PGD),1カ月~1年はnon-CMV感染症,1~5年はグラフト不全(おそらく多くはnon-complianceによる急性拒絶または移植後冠動脈病変)が最多である.5年以降は悪性腫瘍が最多となり,グラフト不全および移植後冠動脈病変(CAV)が2番目となっている1).
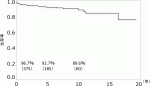
図4および表1に2018年までに行われた428例の国内心臓移植の内訳と遠隔成績を示す5).1年,5年および10年生存率はそれぞれ96.7%,92.7%および89.6%で,ISHLTデータよりも著しく優れている.これまでに31例が死亡しているが,死因として感染症の12例が最多で,悪性腫瘍が4例,多臓器不全が3例などであった.PGDによる死亡が2例,CAVによる死亡は2例のみである.
VI.最近の新たな動向
米国では心臓移植が2013年頃から増加に転じたが,その原因として二つ考えられている.一つ目は従来マージナルドナーとして移植に使用してなかった高齢ドナーや心機能が安定しないドナーの心臓についても,ドナー管理によって移植に利用するようになったためである.二つ目は有効性の高いC型肝炎治療薬が登場することによって,C型肝炎ドナーからの臓器も積極的に移植するようになったことである.わが国は高齢ドナーであってもMCによる評価を通じて積極的に提供につなげている.今後はC型肝炎抗体陽性の脳死者からの臓器提供についての検討が必要であろう.
米国では10年以上にわたり臓器配分優先度をStatus 1A,1B,2の3段階に分けてきたが,多くの問題点が指摘されるようになった.これを改善すべく,2018年10月から6段階に分ける新たな臓器配分システムが開始された.従来のStatus 1AをTier 1~3の3段階に細分し,Status 1BをTier 4とし,Status 2をTier 5~6の2段階とした.これは,重症患者により優先的に,また従来の臓器配分システムで恩恵を受けにくかった特定の疾患群にも均等に移植を可能とするためである.わが国では1997年以来,Status 1と2の2段階配分を採用している.しかし,両心補助人工心臓を必要とする症例,拘束型心筋症などのVADが適用困難な症例,フォンタン術後心不全症例などで臓器配分を受けることが著しく困難であり,関連する協議会・委員会では新たな臓器配分システムについて議論が開始されている.
心臓移植においても,臓器機能や生命予後の改善のためにはHLA抗体の診断,管理,治療等が極めて重要であることが強く認識されるようになった.わが国では,補体依存性リンパ球障害試験(CDCクロスマッチ)がドナー選定における必須検査として実施されてきていて,移植前から存在する抗ドナーHLA抗体(DSA)による移植後の超急性拒絶反応の回避には有効であった.しかし,移植前の弱~中等度のpreformed DSA,さらには移植後に新たに出現したde novo DSAを検出して,どう対処するかについての一定のコンセンサスがなかった.2018年の保険収載改定時に,移植後のHLA抗体検査に保険点数が付与され,ルーチン検査実施が容易になった.今後のDSAを移植管理の必須項目として利用することによって遠隔成績がさらに改善することが期待される.DSAが原因となって起こる抗体関連拒絶反応についてはISHLTの診断基準が2度にわたって改訂され,わが国においても心筋生検病理診断における必須の診断基準として採用されるようになった.しかしながら,病理診断重症度と臨床的血行動態の重症度が一致しないことが多く,病理重症度の解釈と治療の必要性について今後さらなる知見の蓄積が必要である.
VII.おわりに
わが国の心臓移植はドナーが極めて少ないために待機期間は4年に迫りつつあり,今後はさらに長期化する可能性がある.長期待機を安全に乗り切るために,植込み型VADによる補助は必須である.小児においてはBerlin Heart EXCORが使用できるようになったが,小型の次世代型植込み型補助人工心臓(HVAD, HeartMate 3)が2019年に相次いで承認され,小児への適用が検討されている.着実に脳死臓器提供が増加している現在において,高い臓器利用率を維持しながら,優れた遠隔成績を出し続けるために,MC制度も新たな局面に差し掛かっている.
利益相反
奨学(奨励)寄附金:アステラス製薬株式会社
文献
1) Khush KK, Cherikh WS, Chambers DC, et al.: The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation:Thirty-fifth Adult Heart Transplantation Report-2018. J Heart Lung Transplant, 37: 1155-1168, 2018.
2) Kitamura S, Nakatani T, Bando K, et al.: Modification of bicaval anastomosis technique for orthotopic heart transplantation. Ann Thorac Surg, 72: 1405-1406, 2001.
3) Davies RR, Russo MJ, Morgan JA, et al.: Standard versus bicaval techniques for orthotopic heart transplantation:An analysis of the United Network of Organ Sharing database. J Thorac Cardiovasc Surg, 140: 700-708, 2010.
4) 日本臓器移植ネットワークホームページ. http://www.jotnw.or.jp/datafile/index.html, Accessed Sept 20, 2018
5) 日本心臓移植研究会ホームページ. http://www.jsht.jp/registry/japan/index.html. Accessed Sept 20, 2018
PDFを閲覧するためには Adobe Reader が必要です。