日外会誌. 126(2): 173-178, 2025
会員のための企画
外科医が知っておくべき重症心不全治療の現況―補助人工心臓を中心に―
|
東京科学大学大学院医歯学総合研究科 心臓血管外科学 藤原 立樹 |
本邦における重症心不全治療は,ここ10数年間で目まぐるしい変化を遂げている.2011年に植込型補助人工心臓が保険適用される以前は,重症心不全の患者は体外設置型補助人工心臓を装着し,長期間入院するのが一般的であった.当初,補助人工心臓の適応は開心術後心不全(人工心肺離脱困難および術後早期心不全)であったが,次第に心臓移植へのブリッジ(Bridge to transplantation: BTT)としての使用が広がった.
植込型補助人工心臓の最新機種では,血栓症リスクが大幅に改善しており,治療成績の向上とともに,2021年には本邦でも長期在宅補助人工心臓治療(Destination Therapy: DT)としての使用が保険収載された.これにより,心臓移植適応の患者に限定されていた使用が拡大され,年齢や腎機能などの条件が緩和された結果,65歳以上の患者も治療対象に含まれるようになった.一方,米国では日本より約20年早くDTが認可されており,その結果,補助人工心臓患者の非心臓血管手術が増加していると報告されている.
心原性ショックに対する補助人工心臓を用いた治療戦略も大きく変化し,非開胸で装着可能な補助循環用ポンプカテーテルが多くの施設で頻用されている.
本稿では外科医が知っておくべき補助人工心臓を中心に,重症心不全治療の現況について概説する.
キーワード
重症心不全, 心臓移植, 補助人工心臓 Ventricular assist device(VAD), 心臓移植へのブリッジBridge to transplantation(BTT), 長期在宅補助人工心臓治療Destination therapy(DT)
I.はじめに
心不全治療においてはACCF/AHA心不全ステージ分類,NYHA心機能分類,INTERMACS Profile分類など,多様な重症度分類が存在する.循環器領域を専門としない外科医にとって,これらの分類を詳細に把握し活用することは困難である.その点,日常臨床で頻用される“重症心不全”という単語は比較的理解しやすい.厳密な定義はないものの,一般的には「心機能が高度に低下し,薬物治療に抵抗性であり,補助人工心臓などの循環補助装置が必要な状態」を指す.本稿では,外科医が知っておくべき重症心不全治療の現況について説明する.
II.補助人工心臓
外科医が知っておくべき補助人工心臓の原理や種類について解説する1).人工心臓は心臓のポンプ機能を代替する医療機器である.自己の心臓を摘出して心臓移植と同じようにデバイスの装着手術を行う完全置換型人工心臓 total artificial heart (TAH)と,自己の心臓は温存してデバイスの装着手術を行う補助人工心臓 ventricular assist device (VAD)に大別されるが,本邦で使用可能なのはVADのみである(TAHは本邦では承認されておらず,これまで臨床現場で使用されたことはない).VADのうち,左心に装着するものが左室補助人工心臓 left ventricular assist device (LVAD),右心に装着するものが右室補助人工心臓 right ventricular assist device (RVAD)である.LVADとRVADを同時に施行する場合は両心補助人工心臓 biventricular assist device (BiVAD)と呼ばれる.
また,ポンプ本体が体外にあるVADを体外設置型VAD (extracorporeal ventricular assist device : eVAD),体内にあるVADを植込型VAD (implantable ventricular assist device:iVAD),カテーテル型のVADを経皮的VAD (percutaneous ventricular assist device : pVAD)と呼ぶ.eVADやiVADが装着のために開胸手術を必要とするのに対し,pVADは開胸手術を必要としない.
①ニプロVAD
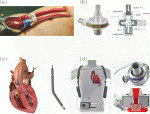
ニプロVADは1982年に国立循環器病研究センターで開発された空気駆動ダイヤフラム型のeVADである(図1a).後にニプロ社が取り扱うようになり“ニプロVAD”という名称が定着した.拍動流補助のため,“拍動流ポンプ”と呼ばれることもある.本デバイスは現在も製造・販売されているが,後述のデバイスが主流となっており,臨床現場で見かけることは少なくなっている.初期のVADの適応は開心術後心不全(人工心肺離脱困難および術後早期心不全)であったが,やがて心臓移植へのブリッジ(Bridge to transplantation: BTT)として使用されるようになった.ニプロVADは管理のために入院が必要であるという制約があったが,2011年にiVADが保険適応となるまでは他に選択肢がなく,本邦の心臓移植待機はニプロVADによって支えられていた2).
②バイオフロート
バイオフロート® BIOFLOAT®(ニプロ社,日本)は動圧浮上型遠心ポンプであり,eVADとして使用される(図1b).動圧浮上軸受によるインペラ(羽根車)の完全非接触回転や,血液接触面へのヘパリンコーティングにより,高い抗血栓性を実現している3).2021年に30日間使用が可能なデバイスとして薬事承認を取得し,保険償還された.本デバイスは左心補助だけでなく右心補助としても承認されている.送血管と脱血管の形状はニプロVADを踏襲している.そのため,装着手術の手技はニプロVADと変わらない.
③IMPELLA
IMPELLA(アビオメッド社,米国)はカテーテル型のpVADであり,大動脈弁を経由してデバイスの先端を左室内に留置する4).小型軸流式ポンプを内蔵し,左室内の血液を吸引して上行大動脈に送血することで左心補助を行う(図1c).本邦では2016年にIMPELLA 2.5®および 5.0®が薬事承認され,2017年から保険償還された.現在使用可能なのはIMPELLA CP SmartAssist®(以下,CP)とIMPELLA 5.5 SmartAssist®(以下,5.5)である.CPはポンプ径が14Frで経皮的挿入が可能であるが,5.5はポンプ径が21Fr(7mm)で,鎖骨下動脈に吻合した人工血管を介して挿入する必要がある.モータ内への血液流入を防ぐため,ヘパリン添加5%ブドウ糖液を吐出部に向かって噴出させ,圧バリアを形成するパージシステムが採用されている.非開胸で装着可能なIMPELLAの登場により,心原性ショックに対する治療戦略は大きく変化し,多くの施設で頻用されている.添付文書上の推奨使用期間は,CPが8日間,5.5が30日間である.
④HeartMate 3
HeartMate 3 TM(アボット社,米国)は完全磁気浮上型遠心ポンプを採用したiVADである(図1d【画像提供:アボット】).構造的特徴として,磁気浮上技術によりポンプ内のインペラを非接触で回転させることで血液流路内に接触軸受けを必要とせず,広い血液流路を確保できるようになった.これにより,血球損傷やフォンウィルブランド因子von Willebrand factor (vWF)の破壊,および血栓形成のリスクを最小限に抑えることが可能となった(vWFの破壊は消化管出血と関連すると考えられている).また人工拍動モード(Pulsatile Mode)が搭載されており,定期的に回転数を変動させることで血流停滞を防ぎ,血栓形成を予防する仕組みとなっている5).
III.植込型LVADの適応
本邦では2011年に植込型LVADが保険償還された.適応疾患は心臓移植とほぼ同一であり,虚血性心疾患,弁膜症,拡張型心筋症,拡張相肥大型心筋症,心筋炎後心筋症,先天性心疾患などが主なものである.植込型LVADの適応は心不全ステージD ,NYHA分類Ⅲ度ないしⅣ度,INTERMACS Profile 2-4 の重症心不全である6).原則的にβ遮断薬などの標準的薬物治療が,忍容性のある最大限の用量で一定期間試みられていることを必要とする.
バイオフロートやIMPELLAの推奨使用期間は30日間であり,デバイスを交換することで1カ月以上の使用が可能な場合もあるが,これらのデバイス使用中は入院が必要である.長期間にわたる循環補助が必要な症例では,植込型LVADを装着することで退院後の在宅治療が可能となる.植込型LVADの適応は大きく以下の二つ,心臓移植へのブリッジ(Bridge to transplantation : BTT)と長期在宅補助人工心臓治療(Destination Therapy : DT)に分けられる(BTTとDTの比較を表1にまとめた).
BTTは,重症心不全患者が心臓移植を待つ間,生命維持と身体状態の安定化を図る目的で植込型LVADを用いるものである.ドナー心臓が提供されるとLVADは摘出され心臓移植が実施される.従ってBTTでは原則として心臓移植適応と承認されていることを必要とする.一般的には,65歳未満で心臓以外の臓器に問題がなく,重篤な併存疾患を有しない患者が対象となる.またケアギバーとして原則継続的に同居する近親者などを指定する必要があり,LVAD機器の取り扱いや緊急時の対応を含めた十分な訓練を受けて貰うことが求められる.ケアギバーの協力が移植後も含めた在宅治療の成功において不可欠であり,ケアギバーが確保できない場合はBTT適応外となる.
DTは,心臓移植が必要とされる状態でありながら,心臓以外の理由により移植適応とならない患者に対して,植込型LVADを最終治療法として使用するものである.年齢,腎機能,ケアギバーなどの要件が満たせず移植適応とならない患者が対象となる.ただし,維持透析や肝硬変はDTの除外条件である.DTの実施基準は,ガイドラインや補助人工心臓治療関連学会協議会のウェブサイトに掲載されている.なお,DTの適応患者において,植込型LVAD装着後に腎機能や肝機能が改善し,結果的に移植登録が可能になる場合がある.このような治療経過を「移植登録となるまでの橋渡し(Bridge to Candidacy: BTC)」と呼び,広義にはDTに含まれる.DTが植込型LVADの適応の一つとして保険収載されたのは2021年と比較的最近のことであり,2024年現在,DT実施施設はまだ20施設に限定されている.

IV.LVAD患者の緊急腹部手術
LVAD患者の脳血管合併症に対する手術を除いた非心臓手術(noncardiac surgery: NCS)について文献を基に解説する.アメリカでは20年以上前に植込型LVADのDTが承認され,年間2,000例以上のLVAD装着手術が行われ,LVAD患者のNCSも増加傾向にある7).メディケア(65歳以上を対象としたアメリカ連邦政府提供の医療保険制度)データベースを用いた調査研究が2020年に報告されている8).2012年から 2017 年までにDT適応にてLVADを装着した患者8,118人のうち,1,326人(16.3%,約6人に1人)がNCSを受けており,そのうち1,000件(75.4%)が緊急手術,326件(24.6%)が予定手術であった.最も頻度の高いNCSは腹部一般手術(613件,46.2%)であった.周術期の主要心血管イベント(major adverse cardiovascular events : MACE)は,緊急手術を受けた169人(16.9%)と予定手術を受けた 23 人 (7.1%) で発生した.
同じくアメリカから2022年に報告された研究では,LVAD装着患者の腹部緊急手術の成績に焦点を当てている9).2010年から2015年の全国入院患者データベースを用い,以前にLVADを装着し,観察期間内に腹部緊急手術を受けた患者を調査したものである.この結果によると,観察対象となったLVAD患者は1,805人で,腹部緊急手術後の死亡率は11.1%であり,死亡率の独立予測因子として術前の腸管虚血と敗血症が挙げられた.
2020年にドイツの単一施設から報告された研究も,同様にLVAD患者の緊急腹部手術の成績に焦点を当てている10).この報告によると2004年から2018年までにLVADを装着した604人のうち,39人(6.5%)が腹部手術を受けていた.予定手術を受けた22人(56.4%)では,腹壁ヘルニア修復,部分結腸切除,胆嚢摘出などが行われ,中央値 23カ月(1~78カ月)の追跡調査で術中または術後の死亡は認めなかった.一方,緊急手術を受けた17人(43.6%)では最も頻度の高い術式が腸管虚血または腸管穿孔であり,術後30日死亡率は47.1%であった.主な死因は敗血症および多臓器不全であった.これらの患者の平均生存期間は約1カ月と厳しい結果であった.また腹部手術を受けた患者は,手術前後の血栓症や感染症によるLVAD交換率が高い事や(5.1% vs. 18.8%,p = 0.031),その後の心臓移植到達率が有意に低い事(21.1% vs. 10.2%,p = 0.037)も示された.
これらの研究結果から,経験豊富な多職種チームによる適切な計画のもとでは,予定腹部手術は安全に実施可能であるが,腸管虚血や腸管穿孔などの緊急手術を必要とする LVAD 患者の腹部疾患は,手術死亡率の上昇に繋がることが示された.
V.LVAD患者の肥満外科手術
心不全患者の中には肥満を有する者が多い.国際心肺移植学会のガイドラインでは,病的肥満が心臓移植の禁忌条件とされ,BMIが35kg/m2を超える患者は移植リスト登録の前にBMIを35kg/m2未満にすることが推奨されている11).しかし,心不全のために身体活動が制限されている場合,体重を減少させることは難しく,肥満外科手術(減量手術)がこれらの患者にとって心臓移植への架け橋となる可能性がある.これまでの研究で,LVAD患者に限らず心不全患者に対する肥満外科手術はBMIを下げ,心不全症状を軽減し,生活の質向上に寄与することが示されている12).
例えばBTT目的でLVADを装着したものの,肥満により移植適応外となった3人に対し,肥満外科手術としてスリーブ状胃切除術を行い心臓移植まで到達した事例が報告されている13).また2022年にアメリカからデータベースを用いた研究が報告されている14).2012年から2019年のLVAD患者14,417人のうち2,798人(19.4%)が肥満(30.0 ≤ BMI < 35.0)であり,そのうち198人(7.1%)が肥満外科手術を受けた.術後30日以内のMACE発生率は6.1%,30日以内の死亡率は5.5%未満,1年以内の死亡率は12.6%であった.肥満外科手術後,心不全の再入院率は減少した.37人が中央値371日(246~575日)後に心臓移植に到達し,13人が心不全より回復しLVADを離脱した.肥満外科手術を受けた群の移植到達率は,受けなかった群の約3倍高いことが示された.
これらの結果から,肥満外科手術は肥満を伴うLVAD患者にとって,安全かつ実行可能なBMI改善の手段であり,心不全症状の軽減と生活の質向上を実現する可能性が示唆されている.本邦ではLVAD患者への肥満外科手術に関する報告はまだないが,食生活の変化や症例数の増加に伴い,今後こうした手術を必要とする状況に遭遇する可能性があると考え,本稿で取り上げた.
VI.おわりに
本稿では,外科医が知っておくべき重症心不全治療の現況について解説した.本邦における重症心不全治療は,この10数年で大きな進歩を遂げている.LVAD患者の非心臓手術は今後も増加していくと予想され,そのような症例に遭遇した際,本稿が参考になれば幸いである.
利益相反:なし
文献
1) 藤原 立樹 :術者が教えるLVAD植込み術のエッセンス.大門雅夫,真鍋 晋,中西弘毅監修,必携!術後心エコーガイドブック,文光堂,東京,pp273-278, 2024.
2) 中谷 武嗣 :わが国における人工心臓の現状と将来展望(世界の状況もふまえて).心臓,38: 579-584, 2006.
3) 築谷 朋典 :バイオフロート®遠心ポンプの特徴.Clin Eng, 34: 355-360, 2023.
4) 此内 緑 :IMPELLAの構造と補助原理. Clin Eng, 34: 334-341, 2023.
5) 安藤 正彦 , 小野 稔 :植込み型補助人工心臓の現状と展望.胸部外科,75: 1137-1147, 2022.
6) 絹川 弘一郎 :植込型補助人工心臓 重症心不全治療における役割.医のあゆみ,282: 170-177, 2022.
7) Alamouti-Fard E , Garg P , Yazji J , et al.: Outcomes after noncardiac surgery in patients with left ventricular assist devices: a systematic review. Front Cardiovasc Med, 17: 1414444, 2024.
8) Mentias A , Briasoulis A , Vaughan Sarrazin MS , et al.: Trends, Perioperative Adverse Events, and Survival of Patients With Left Ventricular Assist Devices Undergoing Noncardiac Surgery. JAMA Netw Open, 3:e2025118, 2020.
9) Place A , McCrum M , Bell T , et al.: Predicting futility in LVAD patients with emergency surgical disease. Am J Surg, 224: 1421-1425, 2022.
10) Beetz O , Bajunaid A , Meißler L , et al.: Abdominal Surgery in Patients with Ventricular Assist Devices: a Single-Center Report. ASAIO J, 66: 890-898, 2020.
11) Peled Y , Ducharme A , Kittleson M , et al.: International Society for Heart and Lung Transplantation Guidelines for the Evaluation and Care of Cardiac Transplant Candidates-2024. J Heart Lung Transplant, 43: 1529-1628, 2024.
12) Miranda WR , Batsis JA , Sarr MG , et al.: Impact of bariatric surgery on quality of life, functional capacity, and symptoms in patients with heart failure. Obes Surg, 23: 1011-1015, 2013.
13) Greene J , Tran T , Shope T : Sleeve Gastrectomy and Left Ventricular Assist Device for Heart Transplant. JSLS, 21: 00049, 2017.
14) McElderry B , Alvarez P , Hanna M , et al.: Outcomes of bariatric surgery in patients with left ventricular assist device. J Heart Lung Transplant, 41: 914-918, 2022.
PDFを閲覧するためには Adobe Reader が必要です。