日外会誌. 125(5): 423-429, 2024
特集
乳癌治療における手術の省略について考える
6.cN+症例に対するリンパ節郭清省略
|
帝京大学医学部 外科学講座 松本 暁子 |
臨床的リンパ節転移陽性(cN+)乳癌の約40%において,術前化学療法(NAC)によりリンパ節転移が陰転化する.このような症例では,腋窩リンパ節郭清(ALND)に代わる腋窩手術のde-escalationが可能となる.しかし,cN+症例に対するセンチネルリンパ節生検(SLNB)は,偽陰性率や同定率が劣ることが指摘されており,リンパ節転移が残存する可能性がある.そこで,SLNBの安全性改善のために,センチネルリンパ節(SLN)の同定に2種類のトレーサーを併用したり,SLNの摘出個数を増やすなどの方法が検討されている.また近年,NAC前に転移リンパ節をクリップなどで標識してSLNとともに摘出するtailored axillary surgery(TAS)の有用性が報告されている.NACを施行したcN+乳癌において,安全にALND省略が可能となれば,リンパ浮腫などの合併症を軽減でき,患者のQOL向上が期待できる.
キーワード
リンパ節転移, 腋窩リンパ節郭清, センチネルリンパ節生検, 術前化学療法, tailored axillary surgery
I.はじめに
臨床的リンパ節転移陰性(cN0)の早期乳癌において,センチネルリンパ節生検(sentinel lymph node biopsy; SLNB)は,腋窩リンパ節郭清(axillary lymph node dissection; ALND)に代わる低侵襲な腋窩ステージング法であり,標準治療となっている.ALNDにより,上肢のリンパ浮腫や感覚・運動障害などの長期にわたる合併症が一定の頻度で生じるが,SLNBでは,このような合併症の頻度が有意に低いことが報告されており1),合併症の回避は腋窩手術縮小の大きなメリットと言える.
一方,臨床的リンパ節転移陽性(cN+)乳癌に対しては,ALNDが標準治療であるが,術前化学療法(neoadjuvant chemotherapy; NAC)を行うことにより,約40%の症例が病理学的リンパ節転移陰性(ypN0)にダウンステージすることが報告されている2)
3).このような症例では,本来ALNDは不要である.しかし,NACを施行したcN+乳癌に対するSLNBは,センチネルリンパ節(SLN)の同定率の低下と偽陰性率の上昇が指摘されており3)
4),安全性については未だ議論の余地がある.
近年,cN+症例における腋窩の縮小手術として,NAC施行前に超音波ガイド下に転移リンパ節をクリップやタトゥーで標識し,手術時にSLNとともに標識リンパ節や腫大のあるリンパ節も摘出するtailored axillary surgery(TAS)が提唱されている5).これにより,同定率,偽陰性率が改善することが報告されており,ALNDに代わる手術のde-escalationとして注目されている.実際の手技などTASの詳細については他章に譲るが,NACを施行したcN+症例が画像上リンパ節転移陰性(ycN0)となった場合に,安全にALNDを省略するにはどのようにアプローチすべきか,本章では今までのエビデンスをふまえて論じる.
II.cN+症例におけるNAC後のSLNBの成績
cN+症例に対して,NAC後のSLNBの安全性を検討した四つの前向き試験の結果が報告されている(表1).ACOSOG Z1071試験は,cN1-2症例に対してNAC後のSLNBを検証した前向き第Ⅱ相試験で,主要評価項目は2個以上SLNを摘出できたcN1症例における偽陰性率であった.対象群525例の偽陰性率は12.6%,同定率は92.9%と報告されている3).SENTINA試験は,NACを施行したcN0/cN+症例を対象にSLNBまたはALNDを施行した4アームの前向きコホート試験である.この中で,cN+からNAC後にycN0となった592例(Arm C)でのSLNBの偽陰性率は14.2%,同定率は80.1%だった4).SN FNAC試験は,cN1-2症例に対する前向き第Ⅱ相試験で,免疫組織化学(IHC)法を用いて0.2mm以下の遊離腫瘍細胞(ITC, ypN0(i+))を含む全ての大きさの転移をSLN陽性と定義しており,偽陰性率は8.4%,同定率は87.6%と報告されている6).ただし,微小転移(>0.2mm)以上の残存(ypN1mi)をSLN陽性とした場合は,偽陰性率は13.3%と上昇した.GANEA2試験は,NACを施行したcN0/N+症例に対する前向きコホート研究で,cN+群307例での偽陰性率は11.9%,同定率は79.5%だった7).
このように,NACを施行したcN+症例のSLNBの成績は,NAC非施行のcN0症例での偽陰性率4.7~9.8%,同定率97.2~98.2%という成績8)
~
10)と比較すると劣る結果となっている.原因として,NACによって起こる炎症や線維化,転移リンパ節の不均一な退縮によりリンパ流に解剖学的な変化がもたらされる可能性が考えられている11)
12).そこで,偽陰性率の改善に関連する因子について,それぞれの臨床試験で検証されている.例えば,SLNの同定にラジオアイソトープ(RI)と色素の併用法を用いた場合,どちらか単独の場合よりも偽陰性率を低下させることが報告されている(表2).また,SLNを2個または3個以上摘出すると,1個のみ摘出した場合と比較して偽陰性率の低下が示されている(表3).
このような結果から,ASCOやNCCNのガイドラインでは,偽陰性率を下げる工夫としてSLNBの際に2種類のトレーサーを併用すること,SLNを3個以上摘出することを条件に,ycN0となったcN+症例に対して,SLNBの結果によるALND省略を推奨している13)
14).ただし,SLNが3個以上同定できない症例が43~66%程度存在する3)
4)ことから,その場合どう対応すべきかは定まっていない.



III.cN+症例におけるTASによるALND省略
cN+症例における腋窩手術のde-escalation の方法の一つとして,近年TASの成績が報告されている.TASとは前述のように,転移リンパ節をNAC前に標識して,SLNに加えて標識リンパ節や触診により腫大が残存しているリンパ節も摘出する手技である.TASに関する30の試験をまとめたメタアナリシスでは,偽陰性率5.5%(95%信頼区間 [CI]:3.3-8.0%),同定率93.5%(95%CI:90.1-96.2%)と良好な成績が報告されている15).また,cN+症例1,500例を対象として手術先行またはNAC後に,TAS±ALNDを比較した第Ⅲ相前向きランダム化試験(TAXIS試験)16)が進行中であり,初期に登録された296例のTASの成績が報告されている.このうち,NAC群125例での偽陰性率は0%,クリップを留置した標識リンパ節の同定率は91.2%と良好な結果だった17).過去の報告では,比較的症例数の多い試験で同定率が高いことから,TASの成績は術者の経験数や技量に影響する可能性が示唆されている15).また,クリップやタトゥーなどのリンパ節の標識方法や標識リンパ節を正確に術中同定する方法など手技の標準化については,今後検討すべき課題と思われる.
IV.cN+症例におけるNACの効果とypN0予測因子
cN+症例において,NACにより34~56%程度がypN0となることが報告されている3)
6)
7)
18).ypN0の予測因子を多重ロジスティック回帰分析を用いて解析した研究では,高い組織学的グレード,ホルモン受容体陰性,HER2陽性などの病理学的因子が関連していることが報告されている19).また,超音波やMRIなどの画像所見を含めてypN0の予測因子を検討した研究では,cN1(対cN2-3),MRIによる50%以上の乳房病変の縮小,NAC後のリンパ節腫大消失などの因子との関連性も示唆されている18).近年はこのような因子を用いたypN0を予測するノモグラムの報告も散見される20).このようなノモグラムがALNDによる腋窩ステージングに代わるものではないが,安全にALND省略が可能な症例をある程度絞り込める可能性がある.特に,HER2陽性やトリプルネガティブなどNACの高い効果が期待できるサブタイプや乳房病変がCRに近い症例では,ALND省略の恩恵を受けられる可能性があると考えられる.
V.cN+症例に対するALND省略の予後
cN+症例に対するALND省略の予後については,後ろ向き研究の結果が複数報告されている.NAC後ycN0となったcN1-2症例147例において,SLNBの結果によりALND省略を検討した後ろ向き研究では,観察期間61カ月において,腋窩再発はSLNB陽性群で1例(0.7%)のみであった21).同様に,ycN0となったcN1-3症例を対象とした後ろ向き研究では,SLNBの結果によりALND追加の有無を決定した428例と,初めからALNDを行った819例が比較され,4年無腋窩再発率は97.8%対99.0%(p=0.148)と両群で有意差を認めなかった22).また,NAC後にypN0となった223例の報告では,ALND群とSLNB群で5年無病生存率(86.4%対89.2%, p=0.671)および全生存率(94.2%対96.3%, p=0.392)に有意差はなかったが,リンパ浮腫の発生率はALND群で有意に多かった(27.1%対8.5%, p<0.001)23).
さらに,NAC後にリンパ節転移が残存した症例においても,腋窩手術の縮小が試みられている.韓国の多施設での後方視的解析では,NAC後にypN+であった1,273例においてALND群1,103例とSLNB群170例が比較されている24).対象となった症例全体の86.2%に術後領域リンパ節照射が施行されている.観察期間75.3カ月において,腋窩再発率は4.8%対4.7%と同等で,5年全生存率はALND群で有意に低い結果であった(86.6%対93.3%, p=0.002).この試験では,さらに傾向スコアマッチングを追加して解析されており,5年無病生存率,全生存率に両群間で有意差は認めなかった.一方,米国のがん登録データベースからypN1症例を抽出し,SLNB(リンパ節摘出個数4個以下)+領域リンパ節照射を施行された304例とALND(摘出個数5個以上)+領域リンパ節照射を施行された1,313例を比較した研究の結果も報告されている25).背景因子の偏りをマッチングした場合,5年全生存率は71%対77%とSLNB群で有意に不良であった(p=0.006).ただし,この研究では実際の腋窩術式はデータベース上不明で,リンパ節の摘出個数によりSLNBとALNDを定義しているという点を考慮する必要がある.
このように,NAC後にycN0となった場合は,ALNDを省略しても予後が良好であるという報告がみられるが,いずれも後ろ向き解析であることに注意が必要である.さらに,ypN+であった場合のALND省略の予後については,研究によって異なる結果が認められており,各ガイドラインでもALNDが推奨されている13)
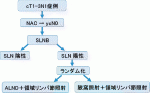
14).現在,NAC後ycN0となった症例においてSLNが陽性の場合に,ALND+領域リンパ節照射と腋窩照射+領域リンパ節照射を比較する前向き試験(Alliance A011202試験)26)が進行中であり(図1),転移が遺残した場合にも今後ALNDが省略可能となるのか予後解析の結果が待たれる.
VI.おわりに
cN+症例におけるNAC後のSLNBは,ycN0となった場合でも,偽陰性率・同定率が劣る可能性があるが,トレーサーの併用やSLN摘出個数を増やすことで,安全性の改善が期待できる.さらにTASの手技が標準化されていけば,ALNDに代わる腋窩手術の選択肢としてより定着すると思われる.近年,乳癌の周術期薬物療法は,NACの治療効果により術後補助療法を変更するresidual disease-guided approachが浸透し,予後の改善が報告されている27)
28).これにより,特にHER2陽性やトリプルネガティブ乳癌において,NACの適応となる対象が今後も拡大すると考えられる.さらに,抗HER2療法や免疫チェックポイント阻害薬などの新規薬剤の登場により,NACの治療成績は向上しており,ALND省略が可能となる症例はこれからも増加していくだろう.今後の乳癌治療は,薬物療法だけでなく,腋窩手術についてもNACの効果によって個別化することで,合併症の軽減と予後改善につながると考えられる.
利益相反:なし
文献
1) Lucci A , McCall LM , Beitsch PD , et al.: Surgical complications associated with sentinel lymph node dissection (SLND) plus axillary lymph node dissection compared with SLND alone in the American College of Surgeons Oncology Group Trial Z0011. J Clin Oncol, 25: 3657-3663, 2007.
2) Fisher B , Brown A , Mamounas E , et al.: Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol, 15: 2483-2493, 1997.
3) Boughey JC , Suman VJ , Mittendorf EA , et al.: Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA, 310: 1455-1461, 2013.
4) Kuehn T , Bauerfeind I , Fehm T , et al.: Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol, 14: 609-618, 2013.
5) Weber WP , Matrai Z , Hayoz S , et al.: Tailored axillary surgery in patients with clinically node-positive breast cancer: Pre-planned feasibility substudy of TAXIS (OPBC-03, SAKK 23/16, IBCSG 57-18, ABCSG-53, GBG 101). Breast, 60: 98-110, 2021.
6) Boileau JF , Poirier B , Basik M , et al.: Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: the SN FNAC study. J Clin Oncol, 33: 258-264, 2015.
7) Classe JM , Loaec C , Gimbergues P , et al.: Sentinel lymph node biopsy without axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients: the GANEA 2 study. Breast Cancer Res Treat, 173: 343-352, 2019.
8) Krag DN , Anderson SJ , Julian TB , et al.: Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomized phase 3 trial. Lancet Oncol, 11: 927-933, 2010.
9) Veronesi U , Paganelli G , Galimberti V , et al.: Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet, 349: 1864-1867, 1997.
10) Veronesi U , Paganelli G , Viale G , et al.: A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N Engl J Med, 349:546-553, 2003.
11) Charfare H , Limongelli S , Purushotham AD : Neoadjuvant Chemotherapy in Breast Cancer. Br J Surg, 92: 14–23, 2005.
12) Pecha V , Kolarik D , Kozevnikova R , et al.: Sentinel lymph node biopsy in breast cancer patients treated with neoadjuvant chemotherapy. Cancer, 117: 4606–4616, 2011.
13) Brackstone M , Baldassarre FG , Perera FE , et al.: Management of the Axilla in Early-Stage Breast Cancer: Ontario Health (Cancer Care Ontario) and ASCO Guideline. J Clin Oncol, 39: 3056-3082, 2021.
14) NCCN Clinical Practice Guidelines in Oncology. [cited 24 April 2024]. Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf
15) Song YX , Xu Z , Liang MX , et al.: Diagnostic accuracy of de-escalated surgical procedure in axilla for node-positive breast cancer patients treated with neoadjuvant systemic therapy: A systematic review and meta-analysis. Cancer Med, 11: 4085-4103, 2022.
16) Henke G , Knauer M , Ribi K , et al.: Tailored axillary surgery with or without axillary lymph node dissection followed by radiotherapy in patients with clinically node-positive breast cancer (TAXIS): study protocol for a multicenter, randomized phase-Ⅲ trial. Trials, 19: 667, 2018.
17) Weber WP , Matrai Z , Hayoz S , et al.: Tailored axillary surgery in patients with clinically node-positive breast cancer: Pre-planned feasibility substudy of TAXIS (OPBC-03, SAKK 23/16, IBCSG 57-18, ABCSG-53, GBG 101). Breast, 60: 98-110, 2021.
18) Kim R , Chang JM , Lee HB , et al.: Predicting Axillary Response to Neoadjuvant Chemotherapy: Breast MRI and US in Patients with Node-Positive Breast Cancer. Radiology, 293: 49-57, 2019.
19) Vila J , Mittendorf EA , Farante G , et al.: Nomograms for Predicting Axillary Response to Neoadjuvant Chemotherapy in Clinically Node-Positive Patients with Breast Cancer. Ann Surg Oncol, 23: 3501-3509, 2016.
20) Corsi F , Albasini S , Sorrentino L , et al.: Development of a novel nomogram-based online tool to predict axillary status after neoadjuvant chemotherapy in cN+ breast cancer: A multicentre study on 1,950 patients. Breast, 60: 131-137, 2021.
21) Galimberti V , Ribeiro Fontana SK , Maisonneuve P , et al.: Sentinel node biopsy after neoadjuvant treatment in breast cancer: Five-year follow-up of patients with clinically node-negative or node-positive disease before treatment. Eur J Surg Oncol, 42: 361-368, 2016.
22) Kang YJ , Han W , Park S , et al.: Outcome following sentinel lymph node biopsy-guided decisions in breast cancer patients with conversion from positive to negative axillary lymph nodes after neoadjuvant chemotherapy. Breast Cancer Res Treat, 166: 473-480, 2017.
23) Kim H , Han J , Kim SY , et al.: Sentinel Lymph Node Biopsy in Breast Cancer Patients with Pathological Complete Response in the Axillary Lymph Node after Neoadjuvant Chemotherapy. J Breast Cancer, 24: 531-541, 2021.
24) Park Y , Shin YS , Kim K , et al.: Omission of axillary lymph node dissection in patients with ypN+ breast cancer after neoadjuvant chemotherapy: A retrospective multicenter study (KROG 21-06). Eur J Surg Oncol, 49: 589-596, 2023.
25) Almahariq MF , Levitin R , Quinn TJ , et al.: Omission of Axillary Lymph Node Dissection is Associated with Inferior Survival in Breast Cancer Patients with Residual N1 Nodal Disease Following Neoadjuvant Chemotherapy. Ann Surg Oncol, 28: 930-940, 2021.
26) Comparison of axillary lymph node dissection with axillary radiation for patients with node-positive breast cancer treated with chemotherapy—full-text view—ClinicalTrials.gov. [cited 24 April 2024]. Available from: https://clinicaltrials.gov/ct2/show/NCT01901094
27) von Minckwitz G , Huang CS , Mano MS , et al.: Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med, 380: 617-628, 2019.
28) Masuda N , Lee SJ , Ohtani S , et al.: Adjuvant Capecitabine for Breast Cancer after Preoperative Chemotherapy. N Engl J Med, 376: 2147-2159, 2017.
PDFを閲覧するためには Adobe Reader が必要です。