日外会誌. 125(2): 139-145, 2024
特集
外科におけるRCT―top journalへの道―
7.肝胆膵外科におけるRCT―top journalへの道―
|
1) 国立がん研究センター東病院 肝胆膵外科 小西 大1) , 池田 公史2) , 仲地 耕平3) |
日本臨床腫瘍研究グループ1202試験にて胆道癌根治切除後の補助療法におけるS-1の有効性を検証するために,S-1を術後6カ月投与する群と切除単独群を比較するRCTを実施した.その結果主要評価項目である全生存期間にてS-1群が有意に生存期間を延長することが示された.胆道癌補助療法の試験としては初めてITT解析にて有意な結果が示された試験となり,The Lancetに掲載されることとなった.本研究の経験をもとに,肝胆膵外科領域のRCTにおける特殊性とtop journal掲載へ向けた注意点に関して独自の考察を行った結果,精度の高いプロトコール作成,十分にコンセンサスの得られた試験デザインの設定,症例集積の工夫としての全数調査,試験結果のインパクトとタイミング,迅速な対応が可能な研究組織と十分なデータ管理が重要な事項として挙げられた.
キーワード
胆道癌, 補助療法, RCT, 肝胆膵外科
I.はじめに
日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)1202試験にて胆道癌根治切除後の補助療法におけるS-1の有効性を証明することができ,その結果は米国臨床腫瘍学会消化器癌シンポジウム(American Society of Clinical Oncology - Gastrointestinal Cancers Symposium:ASCO-GI)での発表を経て,The Lancet1)に掲載されるに至った.研究発案から論文掲載までに15年の歳月を要したが,今回は本研究の内容を紹介するとともに,論文掲載までの過程で感じたランダム化第Ⅲ相試験(Randomized Controlled Trial:RCT)の問題点,特に肝胆膵外科における視点から独自に考察を加え,今後の研究に向けた一助になることを願い報告する.
II.胆道癌術後補助療法の背景
本研究を計画し始めた2008年時点までに,胆道癌術後補助療法のエビデンスはまったくなく,胆道癌単独でのRCTの報告も皆無であった.その原因として考えられることは,胆道癌自体が肝内胆管癌,肝門領域胆管癌,遠位胆管癌,乳頭部癌,胆嚢癌とヘテロな疾患群であること,胆道癌手術の多くは膵頭十二指腸切除もしくは胆管切除を伴う肝切除といった侵襲の高い手技であること,また当時進行胆道癌に対する薬物療法の開発があまり進んでいなかったこと等が挙げられる.この時点で実施されていたRCTは本邦で行われていたゲムシタビン(GEM)の有効性を検証するBCAT試験2)とイギリスで行われていたカペシタビンの有効性を検証するBILCAP試験3)の2試験であり,また本邦において進行胆道癌に対し有効性が示され,保険適用となっていた薬剤はGEMとS-1の2剤のみであった.
III.JCOG1202試験-Lancetへの道のり―
1)薬剤選択
胆道癌補助療法の研究開始にあたって,もっとも重要なことは薬剤選択であったが,上記背景のごとく選択肢は限られたものであり,他の試験も考慮するとS-1もしくはGEM+S-1が候補として挙がっていた.胆道癌は手術侵襲が高くかつ高齢者が多いことから,まずは単剤による試験が望ましいとの判断で,2008年進行胆道癌に対して有効性が示され保険適用となったばかりのS-1を試験治療として選択した.
2)忍容性試験
胆道癌の補助療法としてS-1の実施可能性を確認する必要があると判断し,まず主要評価項目を治療完遂割合とする第Ⅱ相試験を行うこととなった.実投与量/予定投与量が75%以上を治療完遂と定義し,期待治療完遂割合を70%に設定した.参加6施設にて2010年6月より10カ月で33例の症例が登録された結果,治療完遂割合は82%であり,S-1の術後補助療法としての忍容性が良好であることが証明された4).
3)RCTプロトコール作成
第Ⅲ相試験はJCOG肝胆膵グループにて,胆道癌根治切除後症例に対してS-1の補助療法を6カ月行う群と切除単独群を比較するRCT (JCOG1202/ ASCOT)を実施することとなった.主要評価項目は全生存期間(overall survival:OS),主たる解析は最終登録から3年後に行うこととした.JCOG肝胆膵グループでは初めての外科系臨床試験であり,部位ごとに関連する規約が複数存在することや術式も多岐にわたることから,プロトコール作成の時点で様々な事項をあらためて定義する必要があった.胆道癌で行われる可能性のある術式や郭清範囲,特に将来英文雑誌掲載を目指す中で当時はUICCと日本の規約との乖離が大きく,そのすり合わせ作業に多くの労力を費やすこととなった.
また症例数設定,有意水準,検出力の設定には試験結果の出るタイミングとインパクトを常に意識する必要がある.この時点までの胆道癌補助療法で300例以上の症例集積を行った試験がないことから,実施可能性を重視し当初は検出力70%,目標症例数350例に設定し,想定よりも予後が良好な場合や登録が順調な場合はサンプルサイズの再設定を考慮することをプロトコールに盛り込んでおいた.
4)症例集積
登録推進のためには,参加施設の研究者が試験へのモチベーションをいかに保つかが重要となる.2013年9月から登録を開始したのちは,会議ごとに試験の意義を説明するとともに,各施設に対して胆道癌全手術症例のアンケート調査を行い,登録漏れがないように働きかけを行った結果,登録数は予定登録ペースを上回ることができた.
しかし2010年に進行胆道癌に対してゲムシタビン+シスプラチン(GC)療法5)の有効性が発表されて以来,胆道癌の予後は大きく改善し,イベント数(死亡数)が予想を大きく下回っていることが判明した.そこで先述したプロトコールのサンプルサイズ再設定にしたがって検討を加え,検出力を70%から80%に,目標症例数を350例から440例に,さらに登録期間の1年延長を行った.
5)関連試験の結果
この時期,相次いで関連試験の結果が報告された.本邦にて行われたBCAT試験2)とフランスで行われたゲムシタビン+オキザリプラチンの有効性をみたPRODIGE12/ACCORD18試験6)では,いずれも試験治療の有効性を示すことはできなかった.そして2017年ASCOにてBILCAP試験3)の結果が報告された.Intent-to-treat (ITT)解析では有意な結果が示されなかった(ハザード比0.81,95%信頼区間:0.63-1.04, p=0.097)ものの,Per-protocol(PP)解析にてカペシタビン群で有意に良好な結果(ハザード比0.75,95%信頼区間:0.58-0.97, p=0.028)であったという微妙な結果ではあったが,その後欧米ではカペシタビンが補助療法の標準治療へと徐々に変わっていくこととなった.本邦では同剤が胆道癌に保険適応となっていなかったこともあり,補助療法の標準治療がすぐに変わることもなく,2018年6月に440例の登録を完遂した.
6)主たる解析
主たる解析は,最終登録から3年後の2021年に行う予定であったが,定期モニタリングにてイベント数が期待イベント数を大きく下回っており,主たる解析を延長すべきではないかとの提案があった.期間の延長を行えばS-1の有効性を示せる可能性が高くなる一方で,すでに欧米でカペシタビンが標準治療として認識されている中で,実臨床との乖離が大きくなることが危惧された.ここで参考としたのが治療完遂割合であった.これまでの胆道癌やS-1を使用した他癌腫の補助療法試験において,有効性が証明されなかった試験治療の治療完遂割合が50%前後であったのに対し,有効性が証明された試験治療では治療完遂割合が70%以上,比較対象群とのハザード比は0.7以下であった(表1)2)
3)
6)
~
9).本試験の治療完遂割合は72.5%と良好であり,イベント数が少ないことを十分補うハザード比が得られると判断し,予定通り2021年に解析を行うことを決断した.
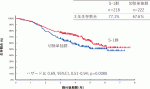
果たして2021年8月に主たる解析が行われ,3年生存割合は切除単独群で67.6%,S-1補助療法群で77.1%(ハザード比0.69,95%信頼区間:0.51-0.94,p=0.0080)と,S-1群で有意に生存期間が延長する結果であり(図1),初めて胆道癌術後補助療法としてITT解析での有意な結果が示された試験となった.
7)学会発表~論文発表
本結果を踏まえ発表はASCOで,論文はtop journalを目指す方針とした.Positiveな結果であるがゆえに,迅速な対応が求められたが,top journal投稿にはプロトコールの英訳など多大な労力を必要とするため,学会発表と論文作成は研究事務局内で分担して行うこととした.まず間髪入れずに研究事務局の池田公史先生がASCO-GIに抄録を投稿し,2022年1月に発表を行った.同時進行として論文は研究事務局の仲地耕平先生が作成し,2022年7月にLancetへ投稿した.1カ月後,Reviewer 5人からA4サイズで9ページに渡る膨大なReview結果が戻ってきた.特に統計に関すること細かなコメントが多くを占め,臨床家が回答しうる範疇を優に超えていたため,仲地先生を中心にJCOGデータセンターの方々,特に統計担当の先生にフル稼働していただき,期限の10日間で回答を作成した.そしてついに10月Acceptの報を受け,2023年1月にLancetにPublishされるに至った.ここまで2008年の構想から15年を要してたどり着いたゴールであった.
論文にはOSの結果の他,無再発生存期間(ハザード比0.80,95%信頼区間:0.61-1.04, p=0.088),サブグループ解析,有害事象が報告された.サブグループでは女性,転移リンパ節陽性症例,stage 3~4a症例でよりS-1群が有意に良好な成績であった.またS-1群におけるgrade 3の有害事象としては好中球減少が14%,胆道感染症が7%に認められたものの,grade 4は切除単独群で5例に認められたのに対しS-1群では4例のみであった.以上よりS-1補助療法の忍容性が高いことも示された.

IV.肝胆膵外科におけるRCTとtop journalへの道
ここまで胆道癌補助療法の研究と論文掲載までの過程を述べてきたが,その過程において感じた肝胆膵外科領域のRCTにおける特殊性とtop journal掲載へ向けた注意点に関して独自の考察を行った.
1)精度の高いプロトコール作成
肝胆膵外科領域のRCTにおいて,疾患や手術手技が多岐にわたる中でいかに精度の高いプロトコールを作り出せるかが肝要である.胆道癌を例にとると,肝内胆管癌が肝癌取扱い規約で扱われている点,UICCと取扱い規約の間にいまだ乖離がみられること,また乳頭部癌の扱いが欧米と異なっている点など事前に調整が必要な事項が多く存在する.このような状況のなかでのプロトコール作成にあたって,対象疾患や治療法の詳細な定義をプロトコール内に記載しておくことが必要である.また手術手技が大きく関わる研究においては,研究グループ内での手技の標準化・均てん化を行うことも重要である.
2)コンセンサスの得られた試験デザインの設定
肝胆膵領域の外科治療,周術期治療に対するエビデンスの構築は容易ではなく,さらに高難度な手技が多いため,治療方針や術式における施設間差はいまだ少なくない.そのような状況下でRCTを遂行するためには,研究グループ内でしっかりとコンセンサスが得られた標準治療を確立することと,それに対しての試験治療の意義を十分に共有できるかが重要となる.また研究者が,比較するそれぞれの治療と試験の意義を十分に納得することが適切な患者説明,ひいては登録促進につながることとなる.
3)症例集積のための工夫
登録促進はいかなる臨床試験においても重要な課題であり,研究遂行にあたっての生命線と言っても過言ではない.本試験において効率よく登録が行われることを目的として導入したものに胆道癌手術症例の全数アンケート調査がある.試験の途中からの導入となったが,一定期間ごとに各施設の全手術症例を非登録例も含め調査したものである(図2).本アンケートの実施は,参加施設の負担増となったものの,研究者のモチベーション維持と登録促進に少なからず寄与したものと考えられる.また副産物として本臨床試験における非登録例の内容を把握することができた.そこで研究成果の実臨床での解釈をより明確にするとともに,このデータが今後胆道癌臨床試験を計画するうえで貴重なものになると判断し論文化に踏み切った10).その結果掲載誌のeditorial commentとして「このような解析が臨床研究において対象となる症例を最大限に引き出すための障害を取り除く唯一の方法である」との評価をいただいた11).特にRCTの設定が容易ではない肝胆膵外科領域において,背景全体を調査したデータの積み重ねは,次世代の臨床研究の貴重な資料となるものであり,今後も同様のデータが公表されていくことを望む.
4)試験結果のインパクトとタイミング
当該の試験結果が出るタイミングとインパクトを常に意識する必要があるのは当然のこと,常に同分野の試験の進捗状況や結果を念頭に置き,それらの結果で当該試験をどのように動かしていくかを想定しておくことも肝要である.さらに結果を予想するのに参考となる代替指標の存在は,研究の微調整をするうえで重要な判断材料となる.今回の試験においては,主たる解析時期の判断に治療完遂割合が非常に参考となった.さらに忍容性を確認する第Ⅱ相試験を実施し良好な結果を得ていたことや,2016年に発表されたJASPAC01試験8)にて膵癌補助療法としてS-1の有効性が示されていたことと合わせ,遅滞なく解析を行うことにつながっていった.
5)アクティブな研究組織とデータの精度管理
Top journalにおいて,まず求められることはデータの質である.これを担保するためには定期的なモニタリングレポートの作成と内容確認,さらに定期的なデータクリーニングを行っておくことは必要不可欠である.
通常の論文であってもreviewerからのコメントに対して,限られた期間のなかで的確な回答を作成するrevise作業は容易ではない.しかしtop journalのそれは,想像を絶するものがあり,この作業を筆頭著者のみで行うことはほぼ不可能と言っても過言ではない.先に述べた如く,統計に関する厳密な解析やデータの質に関して,統計学とデータ管理のスペシャリストの協力が必須となる.どこかの時点で少しでもつまずくと取り返しのつかない遅れになっていくため,迅速な対応が可能な研究組織体制が求められる.
V.おわりに
Lancetに掲載することができた胆道癌補助療法のJCOG1202試験の経験を元に,肝胆膵外科におけるRCTの問題点を考察した.今後の臨床研究の一助となり,本邦の研究成果がtop journalの誌上を賑やかすことを期待する.
最後に,本試験に参加していただいた患者やその家族,38参加施設の先生方,そしてJCOGデータセンターに厚く御礼を申し上げる.
利益相反:なし
文献
1) Nakachi K , Ikeda M , Konishi M , et al.: Adjuvant S-1 compared with observation in resected biliary tract cancer (JCOG1202, ASCOT):a multicentre, open-label, randomized, controlled, phase 3 trial. Lancet, 401: 195-203, 2023.
2) Ebata T , Hirano S , Konishi M , et al.: Randomized clinical trial of adjuvant gemcitabine chemotherapy versus observation in resected bile duct cancer. Br J Surg, 105: 192-202, 2018.
3) Primrose JN , Fox RP , Palmer DH , et al.: Capecitabine compared with observation in resected biliary tract cancer (BILCAP):a randomised, controlled, multicentre, phase 3 study. Lancet Oncal, 20: 663-673, 2019.
4) Nakachi K , Konishi M , Ikeda M , et al.: Feasibility study of postoperative adjuvant chemotherapy with S-1 in patients with biliary tract cancer. Int J Clin Oncol, 23: 894-899, 2018.
5) Valle JW , Wasan H , Palmer DH , et al.: Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med, 362:1273-1281, 2010.
6) Edeline J , Benabdelghani M , Bertaut A , et al.: Gemcitabine and oxaliplatin chemotherapy or surveillance in resected biliary tract cancer (PRODIGE 12-ACCORD 18-UNICANCER GI):a randomized phase Ⅲ study. J Clin Oncol, 37: 658-667, 2019.
7) Neoptolemos JP , Moore MJ , Cox TF , et al.: Effect of adjuvant chemotherapy with fluorouracil plus folinic acid or gemcitabine vs observation on survival in patients with resected periampullary adenocarcinoma:the ESPAC-3 periampullary cancer randomized trial. JAMA, 308: 147-156, 2012.
8) Uesaka K , Boku N , Fukutomi A , et al.: Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer. a phase 3, open-label, randomized, non-inferiority trial (JASPAC01). Lancet, 388: 248-257, 2016.
9) Sakuramoto S , Sasako M , Yamaguchi T , et al.: Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med, 357: 1810-1820. 2007.
10) Kobayashi S , Ikeda M , Nakachi K , et al.: A multicenter survey on eligibility for a randomized, phase Ⅲ trial of adjuvant chemotherapy for resected biliary tract cancer (JCOG 1202, ASCOT). Ann Surg Oncol, 30: 7331-7337, 2023.
11) Divya S , Skye C : Understanding Barriers to Enrollment in Adjuvant Clinical Trials:Insights into Patient Eligibility Criteria from the Adjuvant S-1 for Cholangiocarcinoma Trial (JCOG1202, ASCOT). Ann Surg Oncol, 30: 6967-6969, 2023.
PDFを閲覧するためには Adobe Reader が必要です。