日外会誌. 124(3): 233-238, 2023
特集
がん診療における層別化医療の現状と今後の展望
2.食道がんにおける層別化医療の現状と今後の展望
|
群馬大学大学院 消化管外科 佐伯 浩司 , 宗田 真 , 酒井 真 , 佐野 彰彦 |
食道がん医療はここ数年で大きな変革が起きてきた.実臨床において手術は低侵襲化の方向へと舵が切られ,術前化学療法や術後補助療法の新たなエビデンスが創出されたことにより周術期治療を含めた集学的治療が進歩した.また,進行・再発がんに対する薬物療法においては免疫チェックポイント阻害剤がキードラッグの一つとなり大きな転機を迎えた.一方,層別化医療に関しては,臨床研究を中心にさまざまな検討がなされてきた.特に,手術前の栄養学的評価が術後の転帰に密接に関わることが多く報告され,その臨床応用が期待されている.また,さまざまな治療モダリティーを使い分けるためには,有望な治療効果予測因子の開発が必要である.組織や血液を用いたバイオマーカー研究に加え,日常診療で行われる血液検査や画像検査を用いた新たな評価法の開発も重要な視点と言える.今後,食道がん診療の新たな展開のためには,層別化医療の発展が重要なポイントである.そのためにも,基礎と臨床がタッグを組んで精力的に努力を重ねるべきである.
キーワード
集学的治療, 免疫療法, 診療ガイドライン, 栄養評価, バイオマーカー
I.はじめに
食道がんに対する治療法はここ数年で大きな転機を迎えた.手術は拡大手術から低侵襲手術の時代へと移り変わり,内視鏡手術,ロボット手術が全国へ広く普及した.また,周術期治療としては,術前化学療法や術後補助療法の新たなエビデンスが創出され,集学的治療のパラダイムシフトが起きた.また,進行・再発食道がんに対しては,免疫チェックポイント阻害剤が1次治療のキードラッグとなり,新たな時代に突入したと言える.そのような中,2022年9月に食道がん診療ガイドライン2022年版1)が発刊され,日常診療の指針となっている.
一方,食道がん治療の実臨床においては,高齢症例や,全身状態や栄養状態が不良なハイリスク症例にしばしば遭遇し,必ずしもガイドラインで推奨される治療がそのまま適応できるとは限らない.ハイリスク症例に対する治療層別化の客観的基準が存在することが理想ではあるが,現時点では施設や担当医にその判断が委ねられているのが実情であろう.
本稿では,最近治療法が進歩した食道がん診療における層別化医療の現状について概説したい.また,われわれが今後取り組むべき課題についても言及したい.
II.食道がん手術の層別化
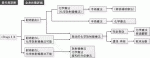
食道がん手術が多く適応となるcStageⅡ,Ⅲ症例の治療アルゴリズムを図1に示す.「耐術能あり」の場合,術前化学療法後の手術療法が標準治療となる.手術に関しては,近年低侵襲手術が進歩したとは言え,食道がん手術は依然として他の消化器がん手術と比較して合併症発生のリスクは高く,注意を要する.食道がん手術において術後合併症が生じた場合,患者QOLが著しく低下するだけでなく,疾患特異的死亡率の上昇をきたすことが明らかとなっており2),個々の症例に対して最適な治療戦略を立てることが重要である.
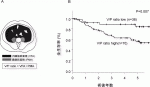
耐術能の評価に関しては,従来の心肺肝腎など重要臓器機能の評価に加え,術前の栄養状態評価や筋肉量・脂肪量評価の重要性が注目されている.近年,がん患者における筋肉量低下(サルコペニア)や脂肪量増加,また両者を合併したサルコペニア肥満と術後成績との関連が着目されているが,われわれは食道がん手術症例を対象に図2Aの方法で内臓脂肪面積と腸腰筋面積の比(V/P ratio)を算出し,V/P ratio高値群が有意に予後不良であることを明らかにした(図2B)3).また,高侵襲治療となるサルベージ手術症例においては,血清アルブミン値とリンパ球数から算出される術前PNI値と術後成績の関係を検討したところ,術後に他病死をきたした症例でPNI値が低く,PNI低値群では全体の予後が不良であった(図3)4).これらのことから,低栄養を認めた症例に関しては,術前の栄養療法の強化などより慎重な周術期管理が必要であることが示唆された.さらには,術前採血やCT画像など,日常診療から得られる情報を基にした栄養評価により,食道がん手術症例の層別化が可能であることが同時に提唱された.

III.食道がん術前治療の層別化
術前治療に関しては,これまでシスプラチン+5-FU療法が標準であったが,JCOG1109の結果によりドセタキセル+シスプラチン+5-FUの3剤併用療法が新たな標準治療となった(ASCO-GI2022で発表).また,術後補助療法に関しては,CheckMate 577試験の結果から,術前化学放射線療法後に根治手術が実施され,病理学的完全奏効が得られない場合,術後の免疫チェックポイント阻害剤(ニボルマブ)の1年間投与が推奨された5).
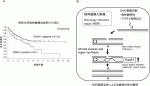
以上から,術前ドセタキセル+シスプラチン+5-FU療法後の手術と,術前化学放射線療法後の手術および術後ニボルマブ療法の2通りの標準治療が存在することになったため,特に局所進行症例に対してはどちらの治療を選択すべきか判断に迷うことがある.われわれは,術前シスプラチン+5-FU療法,術前ドセタキセル+シスプラチン+5-FU療法,術前化学放射線療法のいずれかを行った約600例を対象に,治療前生検標本を用いたバイオマーカー研究を実施した結果,術前化学放射線療法施行症例において,DNA2重鎖切断修復経路の主要因子RAD51が低発現の症例(すなわち,放射線照射やプラチナ系抗がん剤投与後のDNA修復機能が亢進していない症例)では治療効果が高く,予後が良好であることを明らかにした(図4)6).食道がんの術前治療においては高い治療強度が望ましいため,このようなバイオマーカー研究の発展とその臨床応用による治療最適化が望まれる.
IV.食道がん免疫療法の層別化
進行・再発食道がんに対する薬物療法においては,1次治療において大きな二つの臨床試験の結果が近年発表となった.KEYNOTE-590試験では,切除不能進行・再発食道扁平上皮がん・腺がんを対象に,化学療法+免疫チェックポイント阻害剤(ペムブロリズマブ)vs化学療法の第Ⅲ相試験が行われた結果,長期予後において化学療法+ペムブロリズマブ群の優越性が示され,1次治療における新たな標準治療となった7).次に,CheckMate 648試験においては,同じく化学療法群に対して,化学療法+ニボルマブ群,および免疫チェックポイント阻害剤同士の併用療法となるニボルマブ+イピリムマブ群の優越性がいずれも示された8).それらの結果から,1次治療における標準治療としては三つのレジメンが並列で並ぶこととなった(図5).
このように免疫療法が食道がん1次治療のキードラッグとして確立した一方で,治療選択に際してのバイオマーカー開発はいまだ十分とは言えない.CPS(combined positive score)やTPS(tumor proportion score)といった腫瘍組織におけるPD-L1発現が治療効果予測マーカーとして評価されてきたが,いずれもコンパニオン診断としての採用には至っておらず,確固たる層別化マーカーとは言い難い.唯一,ペムブロリズマブには,DNAミスマッチ修復異常に伴うマイクロサテライト不安定性(MSI-High)を有する固形がんに対するがん腫横断的な保険適応があるものの,食道がんにおいてはMSI-Highの症例は非常に稀であり,臨床的な有用性は極めて限定的と言わざるを得ない9).
われわれは,手術検体を用いた検討において,術前PET-CTにおけるFDGのSUVmax値が免疫チェックポイント阻害剤高感受性であるHot tumorを予測できる可能性を見出した10).特に免疫療法では,一部に急激な病勢悪化をきたす不応症例や,重篤な免疫関連有害事象(irAE)を発生する症例も認めるため,今後は層別化医療を目指すためのさらなる努力が必要と考える.

V.おわりに
食道がんに対する治療法としては,内視鏡治療,手術療法,化学療法,放射線療法に加えて,免疫療法が主要治療モダリティーの一つとして加わった.それぞれの治療法にはそれぞれの特性があるため,個々の症例に応じて最適な治療法を選択することが肝要である.一方,食道がんの層別化医療を確立させるためには,臨床試験に伴う付随研究や基礎研究のさらなる発展が必須である.食道がん医療の進歩のためには,これまで以上に基礎と臨床の双方向的なタイアップが求められる.
利益相反:なし
文献
1) 日本食道学会編:食道癌診療ガイドライン 2022年版.金原出版,東京,2022.
2) Saeki H, Tsutsumi S, Tajiri H, et al.: Prognostic significance of postoperative complications after curative resection for patients with esophageal squamous cell carcinoma. Ann Surg, 265: 527-533, 2017.
3) Sakai M, Sohda M, Uchida S, et al.: Impact of the Ratio of Visceral Fat Area (VFA) to Psoas Muscle Area (PMA) (V/P Ratio) on Survival for Surgically Resected Esophageal Cancer. Ann Surg Oncol, Mar 8. Online ahead of print.
4) Sakai M, Sohda M, Miyazaki T, et al.: Association of Preoperative Nutritional Status with Prognosis in Patients with Esophageal Cancer Undergoing Salvage Esophagectomy. Anticancer Res, 38: 933-938, 2018.
5) Kelly RJ, Ajani JA, Kuzdzal J, et al.: Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med, 384: 1191-1203, 2021.
6) Saeki H, Jogo T, Kawazoe T, et al.: RAD51 Expression as a Biomarker to Predict Efficacy of Preoperative Therapy and Survival for Esophageal Squamous Cell Carcinoma: A Large-cohort Observational Study (KSCC1307). Ann Surg, 275: 692-699, 2022.
7) Sun JM, Shen L, Shah MA, et al.: Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet, 398: 759-771, 2021.
8) Doki Y, Ajani JA, Kato K, et al.: Nivolumab Combination Therapy in Advanced Esophageal Squamous-Cell Carcinoma. N Engl J Med, 386: 449-462, 2022.
9) Marabelle A, Le DT, Ascierto PA, et al.: Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer:Results From the Phase II KEYNOTE-158 Study. J Clin Oncol, 38: 1-10, 2020.
10) Kuriyama K, Higuchi T, Yokobori T, et al.: Uptake of positron emission tomography tracers reflects the tumor immune status in esophageal squamous cell carcinoma. Cancer Sci, 111: 1969-1978, 2020.
PDFを閲覧するためには Adobe Reader が必要です。