日外会誌. 124(1): 50-56, 2023
特集
独自の進歩を見せる日本の甲状腺癌治療学
8.甲状腺癌の新規薬物療法
|
神奈川県立がんセンター 乳腺・内分泌外科 岩崎 博幸 , 戸田 宗治 |
はじめに:本邦で放射性ヨウ素内用療法(以下,RAI治療)不応の進行甲状腺癌に分子標的薬が保険適用になったのは,ソラフェニブが2014年,レンバチニブが2015年である.近年,ゲノム検査のコンパニオン診断を必要とするが,エヌトレクチニブ, ラロトレクチニブ, ぺムブロリズマブ, セルペルカニチブなどが,固形癌とともに甲状腺癌に保険適用となった.今回は薬物治療の成績とゲノム検査のタイミングについて述べる.
治療成績:当科において2014年以降分子標的薬を使用した甲状腺分化癌は126例であった.Overall survival(OS)の中央値は41.6カ月,95%Confidence Interval(CI)(29.9~46.7)であった.死亡が54例,治療中が55例,17例が投与を中断している.治療効果が持続する期間には限界があり,有害事象(以下,AE)などで治療継続が難しい症例もある.
ゲノム検査:現在までに検査をした分化癌は20例であり,BRAF変異が16/20(80.0%)と最も多かった.検査により治療薬がみつかった症例は2例であった.一方,13例の甲状腺未分化癌のゲノム検査では,TP53の変異が最も多く,分化癌の遺伝子変異との共通点もみられた.
おわりに:1次治療薬が継続不可能やProgressive disease(PD)となった症例にゲノム検査を施行しているが,残念ながら2次治療薬が適用される症例は限られる.今後はゲノム検査を積極的に行い,2次治療薬の適用症例を増やすとともに,未分化転化のメカニズム解明が課題である.
キーワード
甲状腺癌, 薬物療法, ゲノム検査, 標準治療薬, 2次治療薬
I.はじめに
甲状腺分化癌の予後は良好で,進行癌であっても,標準治療は外科手術と術後の放射性ヨウ素内用療法(以下,RAI治療)であり,薬物療法の適応はなかった.本邦でRAI治療不応の進行甲状腺癌に分子標的薬が保険適用になったのは,ソラフェニブ1)が2014年,レンバチニブ2)が2015年である.近年,ゲノム検査のコンパニオン診断を必要とするが,エヌトレクチニブ3), ラロトレクチニブ4), ペムブロリズマブ5), セルペルカニチブ6)などが,固形癌とともに甲状腺癌に保険適用となった.一方,甲状腺未分化癌の予後は極めて不良であり,有効な治療方法がいまだに確立していない.この両極端の悪性腫瘍の狭間で,RAI不応で予後不良な甲状腺分化癌に対して薬物療法の有効性が認められてきた.本稿では2014年から保険適用となった分子標的薬の治療成績と限界,ゲノム検査結果の分析と効率よく2次治療薬をみつけるための検査のタイミングについて述べる.
II.甲状腺癌に対する薬物療法の進歩
2014年から,分子標的薬が甲状腺癌の薬物治療に適用された.RAI不応の分化癌遠隔転移巣と切除不能局所病変に対する標準治療薬として,National Comprehensive Cancer Network(NCCN)ガイドライン7)では第1選択はレンバチニブであり,ソラフェニブがそれに続くオプションである.髄様癌においては,バンデタニブ,レンバチニブ,ソラフェニブが治療薬として保険適用となった.2019年から標準治療が終了した患者にCGP(Comprehensive Genomic Profiling)検査が保険適応となり,コンパニオン診断に基づく治療薬が固形癌とともに甲状腺癌でもエヌトレクチニブ,ラロトレクチニブ,ぺムブロリズマブ,セルペルカニチブが保険適用となった.
甲状腺未分化癌においては,本邦では2015年にレンバチニブが保険適用となった.当科では診断時にCGP検査を提出し,治験や患者申出療養の適応になるのを期待してレンバチニブを使用している.海外では様々な治験が行われており,その有効性が報告されている8).最も有望な治療薬としてBRAF変異のある甲状腺未分化癌に対するダブラフェニブ,トラメチニブが挙げられる.
III.薬物治療の成績
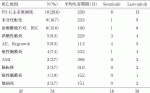
2014年以降当科で126例の分化癌に薬物療法を施行した.内訳は乳頭癌99例,濾胞癌25例,低分化癌2例,髄様癌2例であった.使用した薬剤のうち,最も多いものはレンバチニブであり117例,ソラフェニブが26例,バンデタニブ, セルペルカニチブが2例ずつ,ペムブロリズマブが1例であった.単剤使用が107例,2剤使用が19例,3剤使用が1例であった.レンバチニブとソラフェニブ以外の薬剤は治療経過が短く,症例数も少ないので薬剤ごとに成績は評価できない.甲状腺分化癌における薬物治療の奏効期間を知るため,薬物治療を行った症例全体の成績を図1に示す.Progression free survival (PFS)の中央値は31.2カ月95%CI(21.2~41.8),OSの中央値は41.6カ月95%CI(29.9~46.7)であった.甲状腺分化癌における薬物治療の成績は他の癌腫と比較すれば十分長期生存と言えるが,PDを認めても2次治療薬がみつからず,投与を継続している症例があるので,PFSの中央値より,OSの中央値が10カ月余り長くなっている.126例中,死亡が54例,治療中が55例,17例が投与を中断している.死亡原因は表1に示す通りである.PDによる原病死が最も多く16例(29.6%)で2番目が未分化転化9例(16.7%)である.未分化転化は未分化癌に近い進行した症例を治療しているので未分化転化を起こすことが多いと理解できるが,文献に示す通り9),サイトカイン産生を伴う稀な未分化転化を5例も認めており,薬物療法中の特徴である可能性がある.死亡例における治療後の平均生存期間は,未分化転化症例が23.3カ月であるが,未分化転化を認めてからの平均生存期間は2.0カ月と短かった.また,AEによる死亡3例と治療中断後のregrowthを2例認め,平均生存期間は11.2カ月と短かった.ソラフェニブを使用した26例中18例(69.2%), レンバチニブを使用した117例中50例(42.7%)が2次治療薬を使用できずに死亡している.
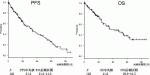
IV.2次治療薬の現状とゲノム検査
表2に2次治療薬一覧とコンパニオン診断(CDx)を示した.エヌトレクチニブとラロトレクチニブはNTRK融合遺伝子が認められた固形癌と甲状腺癌に適応であり,ペムブロリズマブはMSIやTMBhighが認められた固形癌と甲状腺癌に適応である.セルペルカニチブが「RET融合遺伝子陽性の根治切除不能な甲状腺癌,RET遺伝子変異陽性の根治切除不能な甲状腺髄様癌」の適応を追加し,コンパニオン診断薬として「オンコマインTM Dx Target Test マルチ CDx システム」(以下,OM)が承認,保険収載された.OMは,保険点数が5,000点と検査しやすいが,研究用としてRET遺伝子以外の45遺伝子解析結果が得られても,当該薬剤を使用するためにはあらためてCGP検査をやり直さなくてはならない不便さがある.CGP検査には,「OncoGuideTMNCCオンコパネルシステム」と「FoundationOne CDxがんゲノムプロファイル」(以下,F1)「FoundationOne Liquid CDx」がいずれも保険適応となっており,保険点数は56,000点である.当科では組織検体のみで提出可能なF1を用いている.当院研究所でもゲノム検査は実施可能であり,希望者は自費で受け付けている.将来的には,もっと安価で迅速な検査になってほしい.

V.ゲノム検査の結果
現在までにゲノム検査をした分化癌症例は18例であり,検査はF1が9例,OMが11例であり,内訳は乳頭癌18例,濾胞癌2例であった.結果の一覧を表3に示す.BRAF変異が16/20(80.0%)と最も多かった.RET/PTC融合遺伝子の検出を目的に乳頭癌をOMに提出するのでBRAF変異の割合が多い.OMでは検出されないが,TERT変異は,4/9,44.4%に認められた.濾胞癌2例のうち1例にRAS変異を認めた.検査により治療薬がみつかった症例は2例であった.RET/PTC融合遺伝子が検出されセルペルカニチブが使用できた1例(1/18,5.6%)と,TMB highが認められペムブロリズマブが使用できた1例(1/9,11.1%)である.
未分化癌のゲノム検査結果を表4に示す.分化癌のゲノム検査と比較すると,TP53の変異は分化癌で皆無であったが未分化癌では9/13(69.2%)と高頻度であり,際立った結果であった.乳頭癌由来の未分化癌にはBRAF変異が存在し,濾胞癌由来の未分化癌にはRAS変異が認められるという既報の特徴が表れている10).TERT変異が8/13(61.5%)であり,由来に関係なく多く変異が認められた.これらの結果から推察すると,症例1~6が乳頭癌由来で全例BRAF変異あり,症例7~10が濾胞癌由来で全例RAS変異があった.症例11~13はDe novoの未分化癌と分類される.臨床像や生検組織や手術検体に併存した分化癌の所見からも矛盾はなかった.
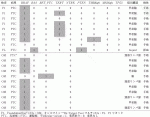

VI.標準治療が困難な症例
1.RAI不応の進行甲状腺分化癌(乳頭癌と濾胞癌)が,標準治療としてガイドライン11)で示される分子標的薬の適応であるが,RAI治療の適応外となるものとして,甲状腺が全摘できない症例,転移病変では,RAI治療の前処置で腫瘍が増大することにより,生命のリスクがある脳転移,脊髄麻痺のリスクがある脊椎転移である.また,推奨されない病変として,外科治療適応外の大きな局所病変やリンパ節転移がある.さらに,社会的適応外として,閉所恐怖症,認知症など,治療室での生活が不可能な患者があげられる.当科では,このような症例を年間10例程度経験する.RAI治療をスキップせざるを得ないし,薬物療法を適用外とすることはできないと考える.
2.外科的治療が困難な場合,従来は可及的切除や外照射で予後延長を期待するしかなかったが,薬物治療を先行させて,縮小効果があれば外科手術が可能になる症例がある12).根治的手術や少なくとも甲状腺全摘が可能になれば,術後にRAI治療を追加できる.術前薬物療法は今後検討されるべき新しい治療戦略と思われる.
VII.ゲノム検査のタイミング
図2に当科で実践している組織型別の薬物治療のフローチャートを示す.甲状腺乳頭癌は薬物療法の適応となった時点でOMを施行し,RET融合遺伝子の有無を調べてもよい.もし,変異があれば,セルペルカチニブの使用ができる.変異のない場合やOM未施行症例は標準治療薬としてレンバチニブやソラフェニブを使用する.標準治療が終了した場合CGP検査が保険適応となり,2次治療薬をみつけることが可能となる.
甲状腺濾胞癌はRET融合遺伝子が検出された報告はなく,亜型のfollicular Hurthle cell carcinomaにあるのみである13).本邦の甲状腺癌取り扱い規約における甲状腺濾胞癌にRET融合遺伝子が検出されることはまずない14)ので,セルペルカチニブの治療対象にはならない.したがって,薬物療法の適応となった時点でOMの検査をする意義は少ない.標準治療薬として,レンバチニブやソラフェニブを使用し,標準治療が終了した場合乳頭癌と同様CGP検査を施行する.
甲状腺髄様癌の場合はすでに遺伝子変異が確認され,MEN2や家族性髄様癌家系と診断されている場合標準治療薬としてセルペルカニチブの使用が可能であり,その他標準治療薬として,バンデタニブ, レンバチニブ,ソラフェニブなども認められている.また,germlineに遺伝子変異のない散発性の髄様癌と診断された患者や,遺伝子検査未施行の患者でもOMによりRET融合遺伝子の有無を確認できれば,セルペルカニチブを使用できるし,標準治療薬も使用できる.標準治療が終了した場合は乳頭癌,濾胞癌と同様にCGP検査を施行する.

VIII.おわりに
2014年以降,根治切除不可能な甲状腺癌に対して初の薬物療法として分子標的薬が保険適用となったことは画期的なことであったが,8年経過した現在,治療効果が持続する期間には限界があり,AEなどで治療継続が難しい症例があることもわかってきた.2019年から標準治療薬が継続不可能やPDとなった症例にCGPが保険適応となり,新規治療薬がみつけられるようになった.しかし,甲状腺癌では対象の遺伝子変異の頻度は少なく,残念ながら2次治療薬が適用される症例は限られる.甲状腺乳頭癌や未分化癌に変異の多いBRAFの阻害剤が保険適用されていないのも課題である.今後はゲノム検査を積極的に行い,2次治療薬の適用症例を増やすことと,未分化転化が起こるメカニズムの解明が進むことが望まれる.
利益相反:なし
文献
1) Brose MS, Nutting CM, Jarzab B, et al.: Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet, 384(9940): 319-328, 2014.
2) Schlumberger M, Tahara M, Wirth LJ, et al.: Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med, 372(7): 621-630, 2015.
3) Liu SV, Macke LA, Colton BS, et al.: Response to Entrectinib in Differentiated Thyroid Cancer With a ROS1 Fusion. JCO Precis Oncol, 1:PO. 17. 00105, 2017.
4) Pitoia F: Complete response to larotrectinib treatment in a patient with papillary thyroid cancer harboring an ETV6-NTRK3 gene fusion. Clin Case Rep, 9(4): 1905-1912, 2021.
5) Mehnert JM, Varga A, Brose MS, et al.: Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with advanced, PD-L1-positive papillary or follicular thyroid cancer. BMC Cancer, 19(1): 196, 2019.
6) Andreev-Drakhlin A, Cabanillas M, Amini B, et al.: Systemic and CNS Activity of Selective RET Inhibition With Selpercatinib (LOXO-292) in a Patient With RET-Mutant Medullary Thyroid Cancer With Extensive CNS Metastases. JCO Precis Oncol, 4:PO. 20. 00096, 2020.
7) Wu HW, Liu YH: [2012 NCCN guideline interpretation of the differentiated thyroid carcinoma]. Zhonghua Wai Ke Za Zhi, 50(8): 675-677, 2012.
8) Subbiah V, Kreitman RJ, Wainberg ZA, et al.: Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. J Clin Oncol, 36(1): 7-13, 2018.
9) Iwasaki H, Toda S, Murayama D, et al.: Three Cases of Anaplastic Thyroid Carcinoma Transformation and Leukocytosis during Lenvatinib Treatment. Case Rep Endocrinol, 2020: 6667237, 2020.
10) Xu B, Fuchs TL, Dogan S, et al.: Dissecting Anaplastic Thyroid Carcinoma (ATC): A Comprehensive Clinical, histologic, Immunophenotypic, and Molecular Study of 360 Cases. Thyroid, 30(10): 1505-1517, 2020.
11) 岩崎 博,北川 亘:【「甲状腺腫瘍診療ガイドライン」を読み解く】 分化癌進行例の外科治療 ガイドライン作成の本音と建前 妥当な治療と厳密な治療.内分泌外科,27(3): 187-192, 2010.
12) Iwasaki H, Toda S, Ito H, et al.: A Case of Unresectable Papillary Thyroid Carcinoma Treated with Lenvatinib as Neoadjuvant Chemotherapy. Case Rep Endocrinol, 2020: 6438352, 2020.
13) de Vries MM, Celestino R, Castro P, et al.: RET/PTC rearrangement is prevalent in follicular Hurthle cell carcinomas. Histopathology, 61 (5): 833-843, 2012.
14) 加藤 良平: 遺伝子変異による甲状腺癌の再分類.日内分泌外会誌,37(2): 68-77, 2020.
PDFを閲覧するためには Adobe Reader が必要です。