日外会誌. 123(3): 240-246, 2022
特集
本邦の大腸癌治療の現状と展望―海外における標準治療と比較して
5.局所進行直腸癌に対する局所制御法
|
国立がん研究センター中央病院 大腸外科 金光 幸秀 |
局所進行直腸癌に対する欧米と本邦の治療パラダイムの違いは,優先順位の違いから生まれたものである.欧米では,治療開発の主眼が側方領域よりもTMEの完全性を術前治療によって高める方に置かれてきたことによる.一方,本邦では拡大リンパ節郭清の概念を発展させ,TMEに側方郭清を加えるという手術手技を独自に発展させてきた.TME導入以前の欧米の局所再発率と比べて明らかに良い成績であることから,側方郭清は下部進行直腸癌に対する標準的治療として受け入れられてきた.その意義を科学的に検証しようというのが,TME vs.TME+側方郭清ランダム化比較試験のJCOG0212である.その主解析結果から得られた知見は,術前画像診断で明らかな側方リンパ節転移が認められない症例に対する側方郭清の位置づけを明らかにし,下部進行直腸癌に対する日本の標準手術であるTME+側方郭清術の妥当性を裏付けるものである.その一方で,側方郭清+術後補助化学療法のみでは治癒が得られない高リスクな対象も明らかになってきた.今後は,再発リスクに応じて側方郭清および術前治療の適応を最適化した集学的治療の開発が期待される.
キーワード
直腸癌, 側方郭清, 術前治療, TME, JCOG0212
I.はじめに
直腸における局所進行癌の定義は明確ではないが,①側方リンパ節転移例,②T4例,③病理学的radial margin陽性例,④高度な直腸間膜内リンパ節転移例,⑤直腸間膜内脈管侵襲陽性例を局所進行癌と定義できよう.このうち,下部直腸癌における側方リンパ節の治療は,理論的にも実践的にも難しい問題であり,この環境下での骨盤側方リンパ節に対する外科的治療(側方郭清)と放射線治療を中心とした術前治療のそれぞれの役割については,現在も議論と関心が続いている.
欧米での直腸癌治療は大まかに言えば,早期の病変は直腸間膜全切除術(total mesorectal excision=TME)のみで治療されるが,より進行した病変(リンパ節転移例や十分なradial marginの確保が危うい例)に対しては,術前補助療法が行われる.そして,病変の進行度に関わらず側方郭清をルーチンには施行せず,補助療法を中心に側方領域の治療を行っている.これに対して,本邦では大腸癌研究会(JSCCR)のガイドラインによって,Ra直腸癌では,リンパ節転移陽性の場合に手術と補助化学療法で治療し,Rb直腸癌の場合は,標準的な手術治療の一環として側方郭清を行うことが規定されている.本章では局所進行下部直腸癌に対する側方郭清について,その発展の歴史,治療的な意義と限界,および今後の展望について論じたい.
II.直腸癌の手術療法と術前治療の変遷
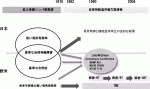
欧米と本邦の治療パラダイムの違いは,優先順位の違いから生まれたものである.欧米では,治療開発の主眼が側方領域よりもTMEの完全性を放射線治療によって高める方に置かれてきたことによる.一方,本邦では拡大リンパ節郭清の概念を発展させ,TMEに側方郭清を加えるという手術手技を独自に発展させてきた.
■郭清の体系
直腸癌外科におけるリンパ節郭清の歴史は,1895年のGerota1)および1904年Poirier2)の理論的なリンパ流研究に始まり,1908年のMiles3)の実践へと続く.病巣の口側・肛門側・側方向への3方向のリンパ節郭清を,その術式の第一目標に掲げて直腸切断術を行った点で画期的であった.リンパ流理解の上に立った実践という意味で,Miles術式は直腸癌外科の歴史の中で確固たる足跡を残し,1982年以降のTMEに繋がった4).
しかし,下部直腸癌に対してTMEのみでは側方転移例の救済が不可能であり,本邦ではGerota・Poirierらの成果を引き継いだ仙波5),Villemin6)の直腸リンパ流の再確認を経て,久留7),梶谷ら8)の側方郭清の臨床研究を基に1970年代から側方郭清が基幹病院で普及した.
一方欧米では,Bacon9)およびStearnsら10)によりaortopelvic lymphadenectomyと称して側方リンパ節の一部が郭清されたが,転移陽性例はすでにsystemic diseaseとの考えから,その有効性は否定され,セントマークス病院,シカゴ大学,Memorialスローン-ケッタリングがんセンターのような一部の施設で行われた時代もあったが,普及することなく今日に至っている.
■機能温存の体系
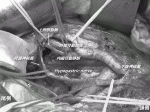
その後本邦では,1977年に『大腸癌取扱い規約』11)が発刊され,これを共通言語に手術に関する治療指針が定められ,側方郭清が多くの施設に普及することになった.この拡大郭清に関する報告は,日本の国立がん研究センターからのものが世界最大であり,小山12),Hojo13),Moriyaら14)の手によって普遍化されていった.そこでの成績は,局所再発率は10%未満と,当時の欧米の局所再発率と比べて明らかに良い成績であることから,側方郭清は下部進行直腸癌に対する標準治療として受け入れられてきた.しかし,反面,拡大郭清は高頻度に術後機能障害を生んだため,この反省から自律神経温存術式15)が誕生し,本邦独自の術式として発展した(図1).このように,拡大郭清による合併症の低減を本邦では,神経温存術という新しい手技の確立に求めたのである(図2).その意義を科学的に検証しようというのが,TME vs.TME+側方郭清ランダム化比較試験のJCOG0212であった.
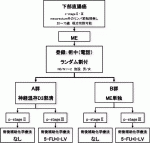
III.JCOG0212の試験デザイン(図3)
■手術療法設定の根拠
本邦における,c-stageⅡ・Ⅲの下部直腸癌に対する標準術式の自律神経温存側方郭清がTMEより良いとするには,まだエビデンスが足りず,有害事象発生率および術後機能としてはTMEの方が良い可能性がある.一方,欧米における,c-stage Ⅱ・Ⅲの下部直腸癌に対する標準手術はTMEである.しかし,側方骨盤リンパ節転移に対してはTMEのみでは対処できない.よって,国際的に認められる標準手術は存在せず,両者を比較するのが妥当であると考えられた.自律神経温存側方郭清のリンパ節郭清範囲として,両側の263D番(内腸骨末梢リンパ節),263P番(内腸骨中枢リンパ節),273番(総腸骨リンパ節),283番(閉鎖リンパ節)の郭清を行うこととした.リンパ節郭清範囲には明快な根拠を示せるデータが存在せず,本邦の大腸癌外科専門医の共通認識を基に設定した.JCOG大腸がんグループアンケート調査で,本試験の対象群に対する側方郭清の範囲に関する質問を行った結果,「両側の263D,263P,283,273番リンパ節を郭清する」との回答が48%と最多であった.
■エンドポイントの設定根拠
直腸癌の主たる再発様式は局所再発,肝再発,肺再発である.再発は生命を奪うのみならず,疼痛などのつらい症状を患者に与える.したがって,OSで差がなくても,RFSで差があれば,臨床的には意味のある差である.また,局所再発巣,肝再発巣,肺再発巣の根治的切除で得られる5年OSは,それぞれ31%16),38%17),41%18)である.このため,本試験では,再発後には再発巣の根治的切除が試みられる.したがって,無再発生存期間(RFS)に差があっても,全生存期間(OS)に差のないことがありうることから,プライマリーエンドポイントは死亡・再発をイベントとするRFSとされた.セカンダリーエンドポイントは,OS,局所無再発生存期間,有害事象発生割合,重篤な有害事象発生割合,手術時間,出血量,性機能障害発生割合,排尿機能障害発生割合とされた.OSに差があれば,臨床的意味は大きい.局所無再発生存期間(LRFS)は,RFSと同様の根拠による.有害事象発生割合,術時間,出血量は臨床的に重要なので,RFS,OS,LRFSのいずれにも差がない場合に,治療法選択の根拠になりうると考えられた.
■臨床的仮説
TMEは自律神経温存側方郭清に比べて,有害事象発生率が低く,手術が容易であるという臨床的有用性の存在する可能性がある.従って,本試験の主たる研究仮説は「試験治療(TME単独群)のRFSが標準治療(神経温存側方郭清)群に対して非劣性であった場合,TMEをより有用な治療法と判断する」とされた.予想される結論は以下の三つである.1)TME単独群が自律神経温存側方郭清に対しRFSが劣っていないことが証明され,さらにその優越性が証明されるかセカンダリーエンドポイントで優越性が証明出来た場合には,TMEをより有用な治療法と判断する.2)TME単独群が自律神経温存側方郭清に対してRFSにおいて劣っている事が証明され,自律神経温存側方郭清が有用な治療法であると判断する.3)TME単独群が神経温存側方郭清群に対してRFSが劣っていないことが証明されたが,セカンダリーエンドポイントで優越性が証明されず,神経温存側方郭清群が有用な治療法であると判断する.
IV.JCOG0212主解析結果の解釈と臨床応用
2003年6月から登録が開始され,2010年8月に701例目を登録して登録終了となった.対象は,c-stageⅡ/Ⅲ腺癌(直腸診,CT/MRI,内視鏡),PS 0~1,腫瘍下縁が腹膜反転部以下の直腸にあり,直腸間膜外のリンパ節に腫大(CT/MRIで短径10mm未満)や他臓器への浸潤を認めない,化学療法未施行の20~75歳の患者である.CT/MRIで側方リンパ節腫大が認められた患者は不適格とされた.実際の主解析結果であるが,5年RFSは,TME+側方郭清群73.4%,TME群73.3%(ハザード比1.07[90.9%信頼区間:0.84-1.36])となった.ハザード比の上限値は非劣性マージンの1.34を上回り,MEの非劣性は証明されなかった(p=0.055).5年OSは,ME+側方郭清群92.6%,ME群90.2%(ハザード比1.25[95%信頼区間0.85-1.84])となり,両群ともに90%を超える良好な値だった.5年LRFSはそれぞれ87.7%と82.4%(ハザード比1.37[95%信頼区間:0.98-1.93])だった(表1).局所再発を認めた患者は,TME+側方郭清群26人(7.4%),TME群44人(12.6%)となり(p=0.024),さらに,側方骨盤リンパ節への転移は,TME+側方郭清群は4人のみに対して,TME群は23人であった(表2).このように,TME単独群が神経温存側方郭清群に対して,プライマリーエンドポイントのRFSが劣っていないことが証明されなかっただけでなく,セカンダリーエンドポイントのLRFSおよび局所再発率で,TME群はTME+側方郭清群に劣っていたため,神経温存側方郭清術が依然として有用な治療法であると判断された19).


V.側方郭清の限界と今後向かうべき治療開発の方向性(East meets West)
術前に側方リンパ節転移が疑われない,いわゆる低リスク直腸癌の中でc-stageⅢ下部直腸癌は,TME+側方郭清に術後補助化学療法を加えても,JCOG0212試験の結果から5年RFSが65%と不良である.また,術前に側方リンパ節転移が疑われる,いわゆる高リスク直腸癌も治癒切除後の再発割合が高く,予後が非常に不良であることが知られている(5年RFS42%)20).そして,どちらのタイプの直腸癌でも,再発形式は局所再発より遠隔転移が優位である.以上より,c-stage Ⅲ下部直腸癌は,側方転移の有無にかかわらず予後不良であり,局所再発のみならず遠隔転移再発をより抑制することで全体の治療成績を上げられる新規の治療開発が求められている.
StageⅢ直腸癌治癒切除後に対する術後補助化学療法は,結腸癌に準じてオキサリプラチンベースのレジメンが用いられているが,直腸癌手術は結腸癌手術に比べて侵襲が高く,術後有害事象の発生割合が高いことや術後補化学療法のコンプライアンスが低いことなどから,直腸癌術後の治療開発は進んでいない.現時点では,直腸癌術後補助化学療法のより有力な新規レジメンの見込みはなく,更なる治療成績の向上にはコンセプトの異なる術前補助療法に期待が集まる.前述したように,これまでは,本邦と欧米では進行下部直腸癌に対する治療パラダイムは異なっていたが(East vs West),今後は,高リスク直腸癌に対しては,本邦と欧米のこれまでの治療原則の組み合わせから(East meets West),リスク/ベネフィットバランスを最適化した集学的治療を開発できれば,全体的な再発率の減少に繋げられるかもしれない.
VI.おわりに
現在は必ず過去につながっている.側方郭清術の確立は,約2世紀の間に観察と実験が積み重ねられた結果である.JCOG0212試験によって,低リスク下部直腸癌に対する側方郭清の治療的意義が明らかになったが,stageⅢ症例に対する外科的治療の限界も明らかになっている.そして,過去10年間で,直腸癌における側方郭清の役割に関する考察は進化してきた.かつては,本邦では郭清,欧米では術前補助療法と郭清を行わないという単純な議論であったが,現在では明らかにニュアンスが異なることが世界的に認識され始めている.そして,局所再発の危険因子が明らかになり,画像診断技術が向上した現在では,高リスクの下部進行直腸癌を正確に選択できるようになっただけでなく,側方リンパ節に関する国際的なコンセンサスができる素地が整った.今後は,東洋と西洋が手を取り合って,患者のリスクプロファイルに応じて層別化することで,側方郭清および術前治療から得られる腫瘍学的な利益を最適化した集学的治療の開発を考える時が来ている.
利益相反:なし
文献
1) Gerota D: Die Lymphgefaesse des Rectums und Anus. Arch Anat Physiol, Anat Abt, 240-256, 1895.
2) Poirier P, Cuneo B, Delamere G: The lymphatics. WT Keener, Chicago, 1904.
3) Miles WE: A method of performing abdominoperineal excision for carcinoma of the rectum and of the terminal portion of the pelvic colon. Lancet, 2: 1812–1813, 1908.
4) Heald RJ, Husband EM, Ryall RD: The mesorectum in rectal cancer surgery—the clue to pelvic recurrence? Br J Surg, 69: 613-616, 1982.
5) 仙波 嘉清:直腸淋巴管系ニ関スル解剖学的研究.福岡医大誌,20: 1213-1268, 1927.
6) Villemin F, Haurd P, Montagne M: Recherches anatomiques sur les lymphatiques du rectum et de l’anus. Rev Chir, 63: 39-80, 1925.
7) 久留 勝:直腸癌.日外会誌,41(7): 832-877, 1940.
8) 梶谷 鐶,高木 国夫:腹腟式合併術式による直腸癌根治手術手技.外科治療,8:82-94, 1963.
9) Bacon HE: Cancer of the colon, rectum and anal canal. JB Lippincott, Philadelphia, 1964.
10) Stearns MW Jr, Deddish MR: Five-year results of abdominopelvic lymph node dissection for carcinoma of the rectum. Dis Colon Rectum, 2: 169-172, 1959.
11) 大腸癌研究会編:大腸癌取扱い規約 第1版.金原出版,東京,1977.
12) 小山 靖夫:直腸癌における拡大根治手術.外科治療,36: 41-45, 1977.
13) Hojo K, Sawada T, Moriya Y: An analysis of survival and voiding, sexual function after wide iliopelvic lymphadenectomy in patients with carcinoma of the rectum, compared with conventional lymphadenectomy. Dis Colon Rectum, 32: 128-133, 1989.
14) Moriya Y, Hojo K, Sawada T, et al.: Significance of lateral node dissection for advanced rectal carcinoma at or below the peritoneal reflection. Dis Colon Rectum, 32: 307-315, 1989.
15) 小松原 正吉:直腸癌手術における膀胱ならびに性機能障害の防止に関する臨床的研究. 岡山医誌,90: 101-119, 1978.
16) Wanebo HJ, Antoniuk P, Koness RJ, et al.: Pelvic resection of recurrent rectal cancer:technical considerations and outcomes. Dis Colon Rectum, 42(11): 1438-1448, 1999.
17) Fong Y, Cohen AM, Fortner JG, et al.: Liver resection for colorectal metastases. J Clin Oncol, 15(3): 938-946, 1997.
18) Okumura S, Kondo H, Tsuboi M, et al.: Pulmonary resection for metastatic colorectal cancer:experiences with 159 patients. J Thorac Cardiovasc Surg, 112(4):867-874, 1996.
19) Fujita S, Mizusawa J, Kanemitsu Y, et al.: Colorectal Cancer Study Group of Japan Clinical Oncology Group. Mesorectal Excision With or Without Lateral Lymph Node Dissection for Clinical Stage II/III Lower Rectal Cancer (JCOG0212):A Multicenter, Randomized Controlled, Noninferiority Trial. Ann Surg, 266: 201-220, 2017.
20) MERCURY Study Group, Shihab OC, Taylor F, et al.: Relevance of magnetic resonance imaging-detected pelvic sidewall lymph node involvement in rectal cancer. Br J Surg, 98: 1798-1804, 2011.
PDFを閲覧するためには Adobe Reader が必要です。