日外会誌. 122(5): 449-455, 2021
特集
大動脈弁疾患に対する外科的治療の現況
3.大動脈弁閉鎖不全症および大動脈基部拡大症例に対する大動脈弁温存手術
|
1) 埼玉石心会病院 心臓血管外科 清水 篤1)2) , 高梨 秀一郎2) |
大動脈弁閉鎖不全症(AR)や大動脈基部拡大に対する大動脈弁温存手術(AVSS)は増加傾向にある.CTやエコーを用いて病因が正確に把握できるようになった.それを元に,疾患を系統的に分類することで,原因に合わせた最適な手技を選択することができる.
AVSSの良好な短期・中期の遠隔成績は多数報告されているが,長期成績の報告はごく少ない.また,イベント(AR再発や再手術)の回避率は満足いく結果とは言えない.例えば,最近注目を集めている大動脈弁二尖弁(BAV)に対するAVSSは,短期的なAR制御は得やすいが,中期を過ぎた頃からARだけでなく大動脈弁狭窄(AS)が急速に問題となるという報告も多い.
術式の改良が得られたことで克服できたイベント危険因子は多数あるが,弁尖変性に対する複雑な介入の予後は悪い.安定した長期成績を持つAVSSを普及とさせる上で最も重要なことは,症例選択にあると言える.
大動脈弁や大動脈に対する治療は日進月歩であり,患者の年齢や全身状態に合わせて,最良な治療方法を常に考え直していく必要がある.
キーワード
大動脈弁温存手術(AVSS), 大動脈弁形成術(AVP), 自己弁温存基部置換術(VSRR), 大動脈弁二尖弁(BAV)
I.はじめに
大動脈弁形成術(aortic valve plasty:AVP)や自己弁温存基部置換術(valve-sparing root replacement:VSRR)などの「大動脈弁温存手術」(aortic valve sparing surgery:AVSS)の対象疾患は,大動脈弁閉鎖不全症(AR),大動脈基部拡大(バルサルバ洞瘤),または両者の複合である.その病因は様々であるが,他の心血管疾患と比べ若年例も多く,術後長期間の弁・大動脈関連イベントの回避を考慮した術式選択が必要となる.
II.治療の歴史
ARに対する標準術式は,大動脈弁置換術(AVR)である.しかし,機械弁置換は生涯にわたる抗凝固療法による出血リスクを伴い,生体弁置換は人工弁劣化(structure valve deterioration:SVD)による再手術の懸念がある.さらに,人工弁関連イベント(e.g. 血栓塞栓症,感染,溶血など)のリスクも背負うことになる.そこで近年では,ARの機序を検討し,可能な症例を選別し,自己大動脈弁組織を修復/温存するAVPが治療の選択肢の一つとなっている.
大動脈基部拡大に対する治療は,人工弁付グラフトを用いた大動脈基部置換術(i.e. Bentall手術)がすでに確立されている.大動脈基部拡大の症例は,有意なARを伴うことも多いが,大動脈弁が正常であるにもかかわらず大動脈基部と大動脈弁の連続性のために,やむなく弁置換を選択されることもあった.しかし,1992年に自己弁温存基部置換術(VSRR)が初めて報告されて以降1),術式を改良しながら,現在では適する症例にはVSRRが積極的に行われるようになっている2).
III.疾患部位類と術式
ARや大動脈基部拡大の原因は様々であるが,Boodhwani3)は外科手術を想定して,ARの発生機序と術式を対応させた分類を提唱した(図1).まず,弁尖の動きや形態を元にして,弁尖の動きが正常なtypeⅠ,弁尖が逸脱しているtypeⅡ,弁尖の可動性が制限されているtype Ⅲの3群に分けた.さらに,typeⅠを,弁尖の接合不全を生じさせる大動脈基部の拡大部位により,バルサルバ洞-上行大動脈移行部(sino-tubular junction:STJ)より遠位が拡大したtypeⅠa,バルサルバ洞とSTJが拡大したtypeⅠb,弁輪が拡張したtypeⅠc,基部拡大はなく弁尖が穿孔したtypeⅠdの4群に分けた.
また,この分類では原因に対し,適切な手技を選択する重要性を提唱した.大動脈の拡大は人工血管置換術,弁輪拡大は人工血管による外固定や弁輪縫縮,弁尖異常は弁尖自由縁の縫縮(central plication)やパッチ補填が長期の耐久性や確実性の高い手技として紹介された(図2).
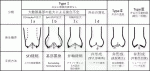
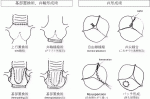
IV.手術成績
現在のところ,Bentall手術とVSRRや,AVRとAVPを対象としたランダム化比較試験はない.傾向スコアを用いた比較では,VSRRやAVPが人工弁置換に比して,周術期の死亡率やイベント回避で優れているとする報告が多い4).
AVSSの長期成績の報告は稀である.厳格な10年以上の経過観察下にVSRRの成績を報告しているのは,トロント大学Davidらの報告のみである5).465例(平均年齢47歳,結合織疾患38%,大動脈弁二尖弁(bicuspid aortic valve:BAV)14%,急性大動脈解離7%)の観察で,20年の全死亡25%,再手術6%,中等度以上のAR再発10%と非常に良好な成績であった.このシリーズでは,VSRRは三尖弁(tricuspid aortic valve:TAV)症例の25%,BAV症例の7%にのみ施行されており,厳格な適応判断が重要であることが強調されていた.
AVPの遠隔期成績は,メイヨークリニック6)(331例,平均年齢53歳)やクリーブランドクリニック7)(1,124例,平均年齢50歳)から多数の症例を含んだ検討が報告されている.しかし,いずれも平均観察期間が3〜6年と短く,術式の有効性を判断するには観察期間が不足している.また,再手術が10年で10〜21%,AR再発も21〜25%に発生しており,必ずしも満足いく結果とは言えない.
V.最新の知見
①最適な手術時期
ARは見かけの心収縮力が保持されやすく,血行動態が代償される間は無症状の期間が長期に持続する病態である.そのため,手術時期の判断に苦慮することも多い.2020年に日本循環器学会から発表されたガイドライン8)には,「慢性ARは重症と診断され,有症状もしくは心機能の低下が認められた時点で手術適応がある」と記載されている.しかし,同時にARの重症度や心機能低下の判断が難しいことも強調されている.近年の研究では,ARによる心機能低下は,LVEF低下(<50%)のみならず,左室収縮末期径(LVESD)の拡大(LVESD>45mm,LVESD index>25mm/m2)も重要な指標とすべきとの提言が出された.さらに,左室機能が保持された無症状症例でも,左心室の縦方向ストレイン平均(left ventricular global longitudinal strain:LV-GLS)を評価することで,予後の推定が可能であることが報告された9).今後はMRIやエコーによる計測項目を総合的に判断することで,手術時期を逸することなく,良好な遠隔成績を得ることができるようになると考える.
②術前の評価方法
AVSSの耐久性を担保する上で重要となるのが,弁尖の正確な評価である.心臓超音波検査を用いて逆流の方向や部位を評価することで,弁尖の偏位(逸脱,部分屈曲)や弁尖の異常(fenestration,穿孔,二尖弁など)を予測することができる.また,弁尖の長さ(Geometric height:GH)や弁輪から弁尖先端までの高さ(effective height:eH),交連の高さや各交連間のバランス,BAVにおける非癒合弁尖のなす角度などを知ることで,形成手技の選択や長期耐久性の予測を行うことができる.弁尖の構造は三次元,さらに心周期を含めた四次元の評価が不可欠であり,経食道心臓超音波検査(TEE)や心電図同期マルチスライス造影CT(4DCT)を用いた評価がガイドライン8)でも推奨されている.
③VSRRの二つの術式に差はあるのか
Remodeling法とreimplantation法は,同時期に発表された二つの異なる自己弁温存大動脈基部置換の方法である.病的な大動脈壁を切除し,波型の大動脈壁(大動脈弁輪)と合わせてトリミングした人工血管を吻合したremodeling法は,生理的な弁運動と手術時間の短縮が得られる術式である.しかし,弁輪部の固定/縫縮を行わないと遠隔期に弁輪部が拡大しARが再発する症例が散見された.対して,病的動脈壁を切除した大動脈弁を人工血管内に内挿して縫合したreimplantation法は,弁輪部,バルサルバ洞部,STJ部のそれぞれを固定/縫縮することが可能であり,止血にも優れているという報告がある.しかし,初期のグラフト選択では,バルサルバ洞の膨らみが失われ,弁機能/耐久性の低下が懸念された.
長年二つの術式は比較検討がなされてきたが,remodeling法は人工血管やsutureによる弁輪部の固定/縫縮を追加することで,reimplantation法は既製のバルサルバ洞型グラフトを用いたり,大口径のグラフトの弁輪部とSTJ部を縫縮して使用することで,それぞれの短所を補うことに成功した.現在では,改良された両術式に,明らかな差がないとされている.
④大動脈二尖弁(BAV)に対する治療
BAV症例は,若年で,弁尖変性や重症ARの割合が多く,弁形成の比重が高いことが多い.さらに,BAVには上行大動脈瘤/拡張は高頻度に発生する.従来BAVに合併した大動脈瘤は破裂の危険が高いとされ,早期手術や軽度拡大での人工血管置換の併施が推奨された時期もあった.しかし,最新のガイドライン10)では,家族歴などの他のリスクがなければ,通常の手術適応と同様と考えることを推奨している.例えば,BAVに対し大動脈弁手術と上行大動脈置換術を行った400例の観察研究では,大動脈基部拡大による再手術は1例(0.3%)のみであった(平均観察期間8.1年)11).
BAVに対するAVSSの遠隔成績をまとめた(表1).平均観察期間は3〜7年であり,交連角の均等化,積極的な基部置換術の併施,パッチ使用の回避など術式の改良で成績の改善はみられているが,5年前後で再手術が増加傾向となり,10年の再手術が9〜36%発生することを念頭に治療の選択を行う必要がある.
また近年,TAVとBAVへのAVSSの治療成績を比較し,成績は同等であるとする報告が多い.しかし,多くが5年未満の中期成績の比較に留まり,BAVではAVSSの適応を厳格に設定するなど,単純に比較してBAVの成績が許容範囲と判断するのは,慎重になるべきであると考える.
⑤再手術やAR再発の危険因子
AVSS後のAR再発や大動脈弁狭窄(aortic stenosis:AS)発生の危険因子は,多数挙げられている.弁輪拡大(28〜29mm以上),弁尖短縮(GH 16〜19mm以下),自由縁とGHの比率12),弁尖石灰化,fenestration,偏在するAR jet13),二尖弁での非癒合尖の角度14),重症AR,左室拡大15),二尖弁16),急性大動脈解離,高安病などがあり,術中因子には形成後のeH 9mm未満,弁尖接合が弁輪以下,パッチの使用17),術中mild以上のAR残存などがある.
既知の危険因子は,術式の改良で克服されたもの(弁輪拡大など)もあるが,弁尖の性状に関わる因子は,短期的な成績は担保されても,中長期で悪化する印象が強い.筆者らは現在,4DCTとTEEを用いて,術前後の弁尖および大動脈基部の形態に着目し,信頼性の高いリスク因子の同定を事前に行えるよう検討している.
⑥経カテーテル的大動脈弁置換術(TAVI)時代のAVSSの立ち位置
2013年のTAVI治療保険収載以降,TAVI治療は急速に拡大している.ARに対するTAVIはまだ実用段階ではないが,AVSS後のAR再発に対してはTAVIを施行した報告もある18)(弁輪内部に人工弁輪(日本未発売)を固定した症例).従来,AVSSの耐久性は,若年者における生体弁置換の再手術回避(10〜15年)が一つの比較対象と考えられてきた.しかし,AR症例の弁輪は比較的大きいこと,生体弁へのTAVI弁留置(TAVI in SAVR)が可能となったことを踏まえると,今後は「大きい生体弁+TAVI in SAVR」(15〜25年間)とのイベント回避の比較を余儀なくされる.そのため,より慎重にAVSSの対象症例を吟味する必要があると考える.

VI. おわりに
疾患への理解や技術の進歩により,ARや大動脈基部拡大症例に対し自己弁温存手術が増加傾向である.さらに今後,術前の心機能や大動脈弁構造の評価が数値化,客観性をもってなされるようになり,再手術の原因分析とさらなる術式の改良が達成されれば,心機能低下/弁変性をきたす前の早期手術を行うことも考慮されると考える.ただし,本術式は長期成績をもって評価されるべきであり,他の治療法や合併疾患と合わせて,慎重に適応症例を検討する必要がある.
利益相反:なし
文献
1) David TE , Feindel CM : An aortic valve-sparing operation for patients with aortic incompetence and aneurysm of the ascending aorta. J Thorac Cardiovasc Surg, 103: 617-621, 1992.
2) Kunihara T , Ichihara N , Miyata H , et al.: Valve-sparing root replacement and composite valve graft replacement in patients with aortic regurgitation:From the japan cardiovascular surgery database. J Thorac Cardiovasc Surg, 158: 1501-1511, 2019.
3) Boodhwani M , de Kerchove L , Glineur D , et al.: Repair-oriented classification of aortic insufficiency:Impact on surgical techniques and clinical outcomes. J Thorac Cardiovasc Surg, 137: 286-294, 2009.
4) Kalra K , Wagh K , Wei JW , et al.: Regurgitant bicuspid aortopathy - is valve sparing root replacement equivalent to bentall procedure? Ann Thorac Surg, im press, 2020.
5) David TE , David CM , Ouzounian M , et al.: A progress report on reimplantation of the aortic valve. J Thorac Cardiovasc Surg, 161: 890-899, 2021.
6) Sharma V , Suri RM , Dearani JA , et al.: Expanding relevance of aortic valve repair-is earlier operation indicated? J Thorac Cardiovasc Surg, 147: 100-107, 2014.
7) Zeeshan A , Idrees JJ , Johnston DR , et al.: Durability of aortic valve cusp repair with and without annular support. Ann Thorac Surg, 105: 739-748, 2018.
8) Group JCSJW: Jcs/jats/jsvs/jscs 2020 guideline on the management of valvular heart disease. Circulation journal:official journal of the Japanese Circulation Society, 2020.
9) Alashi A , Khullar T , Mentias A , et al.: Long-term outcomes after aortic valve surgery in patients with asymptomatic chronic aortic regurgitation and preserved lvef:Impact of baseline and follow-up global longitudinal strain. JACC Cardiovasc imaging, 13: 12-21, 2020.
10) Group JCSJW: Jcs/jscs/jats/jsvs 2020 guideline on diagnosis and treatment of aortic aneurysm and aortic dissection. Circulation journal:official journal of the Japanese Circulation Society, 2020.
11) Patlolla SH , Schaff HV , Bagameri G , et al.: Natural history and outcomes of non-replaced aortic sinuses in patients with bicuspid aortic valves. Ann Thorac Surg, im press, 2021.
12) Tamer S , Mastrobuoni S , van Dyck M , et al.: Free margin length and geometric height in aortic root dilatation and leaflet prolapse:Implications for aortic valve repair surgery. Eur J Cardiothorac Surg, 57: 124-132, 2020.
13) Deas DS Jr , Lou X , Leshnower BG , et al.: Fifteen years of aortic valve-sparing root replacement and impact of eccentric jets on late outcomes. Ann Thorac Surg, im press, 2021.
14) de Kerchove L , Mastrobuoni S , Froede L , et al.: Variability of repairable bicuspid aortic valve phenotypes:Towards an anatomical and repair-oriented classification. Eur J Cardiothorac Surg, im press, 2019.
15) Guo MH , Cole E , Fei LYN , et al.: Preoperative left ventricular end-systolic dimension predicts occurrence of aortic insufficiency following aortic valve preservation and repair surgery. J Thorac Cardiovasc Surg, im press, 2020.
16) Mokashi SA , Rosinski BF , Desai MY , et al.: Aortic root replacement with bicuspid valve reimplantation:Are outcomes and valve durability comparable to those of tricuspid valve reimplantation? J Thorac Cardiovasc Surg, im press, 2020.
17) Karliova I , Schneider U , Ehrlich T , et al.: Results of pericardial patches in tricuspid and bicuspid aortic cusp repair. Ann Thorac Surg, 109: 728-735, 2020.
18) Vogt F , Marianowicz J , Jessl J , et al.: Balloon transcatheter aortic valve replacement after aortic valve repair with haart 300 device. Ann Thorac Surg, 110:e375-e376, 2020.
19) Schneider U , Hofmann C , Schope J , et al.: Long-term Results of Differentiated Anatomic Reconstruction of Bicuspid Aortic Valves. JAMA Cardiol, 5(12): 1366-1373, 2020.
20) de Meester C , Vanovershelde JL , Jahanyar J , et al.: Long-term durability of bicuspid aortic valve repair:a comparison of 2 annuloplasty techniques. Eur J Cardiothorac Surg, in press, 2021.
21) Patlolla SH , Schaff HV , Stulak JM , et al.: Bicuspid Aortic Valve Repair:Causes of Valve Failure and Long-Term Outcomes. Ann Thorac Surg, 111(4): 1225-1232, 2021.
22) Siki MA , Habertheuer A , Bavaria JE , et al.: Two different geometric orientations for aortic neoroot creation in bicuspid aortic valve repair with root reimplantation. J Thorac Cardiovasc Surg, 160(1): 47-57, 2020.
PDFを閲覧するためには Adobe Reader が必要です。