日外会誌. 122(2): 179-184, 2021
特集
肝胆膵領域腫瘍におけるBorderline resectable/Marginally resectableとは
―術前治療の可能性について―
8.膵臓癌
|
和歌山県立医科大学 第2外科 岡田 健一 , 山上 裕機 |
膵癌の進行度に関しては,AJCC(The American Joint Committee on Cancer)のステージングがすでにあり,膵癌の血管への接触角度などの画像所見に基づいて外科的技術の限界を理由にBorderline resectable(BR)の概念を規定することは,Biologicalには意義が低く,より臨床判断に役立つ分類が必要である.このBRの概念は術前治療導入時代に,顕微鏡学的癌遺残リスクを回避するために技術的に切除可能かどうかに注目し,解剖学的画像所見によるカテゴリーを規定したものである.しかし術前治療が多くの膵癌に適応される時代にこの初診時の画像診断に基づく切除可能性カテゴリーの存在意義はやや弱くなりつつあり,そもそもBRカテゴリーが必要かどうかも疑問である.現在必要とされるものは,治療中の各ポイントにおいて切除することが許容されるかどうかを判断するカテゴリーであり,バイオマーカーや術前治療中,治療後の効果判定に基づいて,手術を選択することが治療の最終目標に益するかどうかを判断できるカテゴリーが必要とされている.近年,術前治療前後に得られる様々なパラメーターに関する研究報告があり,それらを統合的に評価利用することで,局所進行切除不能膵癌も含めた全膵癌に適応できる全く新しい概念のカテゴリーが時代に求められている.
キーワード
膵癌, 術前治療, 組織学的効果
I.はじめに
膵癌において既に規定されているBorderline resectable(BR)膵癌は,術前治療導入時代に,手術を先行治療にした場合に顕微鏡学的癌遺残陽性が高率となる患者群に対し,解剖学的画像所見に基づく基準を定めたものである.しかしながら,血管への接触・浸潤を疑う進行膵癌において顕微鏡学的癌遺残陰性(R0)が独立した予後規定因子かどうかについてはcontroversialである.多くの膵癌に対し術前治療が考慮される近年においては,初診時画像診断時の外科医都合のネーミングに使われるカテゴリーよりも,各治療ポイントにおいて手術治療の介入意義を判断できるカテゴリーが求められている.既にBR膵癌は定義されているので,本稿では,あえて今後改訂の可能性とその方向性について検討する.また次の時代に求められる概念を提示すべく,BR概念の意義を再考し,術前に外科的治療を介入すべきかどうかを予測できる可能性のある一つのモデルを提案する.
II.そもそも切除可能境界カテゴリーとは何か?
境界とは,事物や領域などを分ける境目のことであるが,BRの概念はその境目に幅があり,切除可能膵癌と局所進行切除不能膵癌の間の不明瞭な境界上にあるとされる腫瘍集団である.National Comprehensive Cancer Network(NCCN)によるBR膵癌の定義1)も年々改訂されており,現時点での最新の定義の詳細をここで述べることは避けるが,膵臓周囲の血管解剖に基づく初診時の画像所見によって詳細に規定されている.つまり,BRとはこの所見がなければ手術先行治療が許容され,あれば術前治療が推奨されるという,“術前治療推奨カテゴリー”であり,切除可能膵癌とBR膵癌との境界を重視した術前治療導入時代の臨床判断に役立つカテゴリー概念であった.一方NCCNガイドラインでは,BR膵癌の治療アルゴリズムも詳細に記載されているが,一定の治療期間後病状進行の所見を認めれば,局所進行膵癌の治療アルゴリズムを参照するよう示されている.しかし,術前治療期間が長期化しつつあるが,至適治療期間が明らかでないため,どの時点で,どのような方法で切除可能性を再評価するかが,クリニカルクエスチョンである.
また近年BR膵癌の定義とcriteriaに関する国際コンセンサス会議においては,以上の様なAnatomic criteria以外の所見にも注目すべきとの報告がある.具体的には切除可能膵癌のなかでも,転移は証明されていないが,CA19-9値が500U/mlを越える症例や,領域リンパ節転移が生検で証明されている症例,PET-CT検査結果などの複数のデータを統合しBiological definitionを定めるような動きや,患者のperformance statusに基づき Conditional definitionを定めようとする動きもある2).すなわち,Anatomic criteriaだけでなく総合的評価に基づいて個々の症例を検討し,早期に切除を行うことを前提とせず,全生存期間を延長させることがこのカテゴリーで重視されつつある.
III.様々な検査モダリティーが示す治療効果が意味するものと,単独診断の弱点
そもそも,術前治療の治療効果を外科的切除の前に判定することは困難である.また膵癌においては,局所における治療効果のみならず,全身性疾患としても評価することが必須である.近年,多くの研究者が血液検査の腫瘍マーカーや術前治療前後の画像検査におけるパラメータによって生存期間または早期再発を予測できると報告している.Sugiuraらは膵腺癌切除後の予後早期再発と予後不良の重要な予測因子として術前のCA19-9値が100U/ml以上であると報告している3).一方,Tsaiらは,術前補助療法後においてCA19-9値の変化の大きさではなく,CA19-9値の正常化が,長期生存の最も強力な予後マーカーであったと報告している4).Yamamotoらは術前治療前の2-deoxy-2-[F-18] fluoro-D-glucose(FDG) positron emission tomography(FDG PET/CT)検査のSUV-max値≥6.0を術後早期再発や予後不良を示す全身性予後因子として紹介し5),Akitaらは術前治療前後のSUV-max値の50%以上の回帰インデックスについて術前治療の局所の治療効果を予測できる予後因子として報告している6).われわれは,術前治療の前後に拡散強調磁気共鳴画像(DW-MRI)において腫瘍全体の見かけの拡散係数(apparent diffusion coefficient:ADC)値を評価し,術前治療前後のADC値を組織学的治療効果の予測因子として報告した7)
8).しかし,単一のパラメーターによって予後を予測することの弱点は,対象母集団の選択バイアスの影響を受ける.ほかに,糖尿病コントロール不良例や膵炎症例においてPET-CT検査の信頼度が低下したり,腫瘍マーカーCA19-9値が閉塞性黄疸症例で異常高値を示したりルイス抗原陰性患者において陰性化するように,それぞれの上記の予後予測指数には各々に個別の弱点がある.そこでわれわれはこれらのパラメータを統合し六つの好ましいパラメータを決定した.三つの全身的因子の予後良好パラメータとして,術前治療前のCA19-9の値<100U/ml3),術前治療後のCA19-9値の正常化4),術前治療前のFDG PET/CTのSUV最大値<6.05).三つの局所的治療効果良好のパラメータとして,治療後/治療前のSUV-max値の減少指数>50.0%6),治療前の全腫瘍ADC値>1.20×10–3mm2/s,および治療後の全腫瘍ADC値>1.40×10–3mm2/s7)
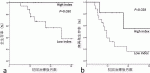
8).収集された個々のパラメータのデータは術後生存期間や再発期間に対し有利または不利と評価し,有利な要素はそれぞれ1ポイントとしてカウントし,最終的に0~6の間の統合された値を合計ポイントとした.統合されたポイントスコア4点以上は高スコアに分類し,4点未満は低スコアに分類した.BRPCの術前治療とその後の外科切除術を受けた連続28症例を分析した(図1).全生存期間(OS)および無再発生存期間(RFS)は,高スコア群(n=11)の患者の方が低スコア群(n=17)の患者より良好(ログランク検定P=0.03/0.028)であった(図2a,b).また病理学的リンパ節転移陰性(P=0.019)および腫瘍細胞消失率>50%(P=0.019)を認めた症例は,高スコア群の患者において有意に発生率が高かった.将来,様々な有望なバイオマーカーが臨床に導入され,このスコアリングの1項目に置き替わることが期待されるが,既に現在臨床現場に存在するこれらの値を統合することでも,より手術治療の介入に意義のあるグループを抽出することは可能と考えられる9).しかし,本試験の結果も,多施設による前向き大規模臨床試験によって検証される必要がある.

IV.膵尾部癌にBorderline resectableは存在しないか?
膵癌における放射線学的(画像診断による)脾臓動静脈浸潤と予後への影響を考慮した,切除可能性に関する定義や基準は現在のところ存在しない.教室では切除可能な膵体/尾部癌におけるその腫瘍学的意義を評価した10).膵体部/尾部癌のうち膵切除を施行した切除可能膵癌102症例と切除可能境界型の膵体部/尾部膵癌(BRPC)51例を後方視的に検討した.切除可能膵体部/尾部癌は,放射線学的画像所見の脾動静脈への接触浸潤所見に基づいて三つのカテゴリーのいずれかに分類した.切除可能膵体部/尾部癌(Rnone)は,脾動脈および脾静脈血管壁への腫瘍接触を認めないもの,あるいは脾動脈または脾静脈血管壁への接触を認めるが狭窄または変形を認めないものと定義した.脾静脈浸潤を伴う切除可能膵体部/尾部癌(RV)は,腫瘍による脾静脈血管壁の狭窄または閉塞を伴い,脾動脈血管壁への接触を認めるも脾動脈狭窄または変形を認めないものと定義した.脾動脈浸潤を伴う切除可能膵体部/尾部癌(RA)は,脾静脈所見に関係なく,腫瘍により脾動脈狭窄または閉塞を伴うものとして定義した.切除可能膵癌の102例のうち,脾動静脈浸潤所見無し(Rnone),脾静脈浸潤所見あり(RV),および脾動脈浸潤所見あり(RA)は,それぞれ37(36.3%),35(34.3%),および30例(29.4%)であった.Rnone,RV,RA,およびBRPC患者の無病生存期間(DFS)は,それぞれ58.5,18.4,10.8,および9.2カ月であった.RVとRAの患者は,Rnoneの患者よりもDFSが有意に低かった(P=0.010,P<0.001)(図3a).Rnone,RV,RA,BRPCの生存期間中央値は,それぞれ80.6,23.4,15.1,21.3カ月であった.RVとRAの患者の生存率はRnoneの患者よりも有意に低く(P=0.001,P<0.001),BRPCの患者と同様に生存期間が短かった(図3b).多変量Cox比例ハザード分析により,術前CA19-9≥37IU/L,放射線学的脾静脈浸潤陽性,放射線学的脾動脈浸潤陽性,術中出血≥500ml,輸血,洗浄細胞診陽性,および補助化学療法の非完遂が独立した予後不良因子として検出された.放射線学的の脾動脈浸潤陽性は切除可能膵体部/尾部癌の予後不良因子であり,治療戦略の層別化に役割を果たしている,すなわち術前治療介入の余地のあるカテゴリーと考えられた10).NCCNによるBR膵癌の定義に上腸間膜動脈や総肝動脈などの主要動脈接触に関する記載がある一方,脾動脈接触に関する記載がないのは,解剖学的にも生物学的にも不自然ではないだろうか.今後,脾動脈浸潤陽性の切除可能膵癌や,他臓器浸潤陽性膵癌のカテゴリー分類にも議論が必要と考えられる.

V.初診時の画像所見よりも一定期間十分な術前治療を施行できたか?
2019年頃から,すべての補助療法を術前に行ってしまうTotal neoadjuvant therapy(TNT)の治療成績がいくつか報告され始めている.Trutyらは,BR膵癌,局所進行切除不能膵癌のTNT療法後の治療効果を予測する要因,周術期の転帰,および生存成績を報告した11).その結果,放射線学的ダウンステージは低率であったが,外科的切除断端癌陰性が高率であった.Major pathologic responseは,CAP基準(College of American Pathology (CAP) protocols)に従って,病理学的治療効果反応のスコアが付けられた.完全な反応がスコア0(viableながん細胞なし),ほぼ完全な応答がスコア1(癌細胞の単一/稀なグループ)で,スコア0または1をMajor pathologic responseとして定義した.一定期間(6サイクル以上)の化学療法の施行,化学療法後のCA19-9正常化,およびMajor pathologic responseの三つの要素のみが長期生存に関連する独立した予測因子であった.三つの要因すべてを達成した患者は,生存率が高く,生存成績が優れていた.また,化学療法を6サイクル以上施行できた群では,有意に高率にTNT後のCA19-9の正常化とMajor pathologic responseを認め,同様にCA19-9値正常化症例ではより高率にMajor pathologic responseを認めていたことを報告している.これらの結果が示すことは,もはや初診時や術前治療後のダウンステージや切除可能性カテゴリーよりも,切除が許容されるかどうかの指標が重視されているということである.どれくらい十分量の術前治療が施行できたか,その上で術前治療後の血清学的,画像的治療効果判定を認める患者集団12)が,外科的切除の恩恵を受ける意義が高い,と言うことができる.
VI.おわりに
術前治療が多くの膵癌に適応される近年では,初診時のみならず治療中の各段階において外科的切除が許容されるかどうかを判断するカテゴリーが必要とされており,BRの定義は今後も変わる可能性がある.また,現在BRカテゴリーに定義されていない脾動脈浸潤陽性の切除可能膵体尾部癌や,他臓器直接浸潤陽性膵癌に対する術前治療の適応に関しても今後議論が必要である.
利益相反:なし
文献
1) National Comprehensive Cancer Network. NCCN practice guidelines for pancreatic cancer, version 1. 2020 Available at: http://www.nccn.org/professionals/physician_gls/PDF/pancreatic.pdf
2) Isaji S , Mizuno S , Windsor JA , et al.: International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology, 18: 2-11, 2018.
3) Sugiura T , Uesaka K , Kanemoto H , et al.: Serum CA19-9 is a significant predictor among preoperative parameters for early recurrence after resection of pancreatic adenocarcinoma. J Gastrointest Surg, 16: 977-985, 2012.
4) Tsai S , George B , Wittmann D , et al.: Importance of Normalization of CA19-9 Levels Following Neoadjuvant Therapy in Patients With Localized Pancreatic Cancer. Ann Surg, 271: 740-747, 2020.
5) Yamamoto T , Sugiura T , Mizuno T , et al.: Preoperative FDG-PET predicts early recurrence and a poor prognosis after resection of pancreatic adenocarcinoma. Ann Surg Oncol, 22: 677-684, 2015.
6) Akita H , Takahashi H , Ohigashi H , et al.: FDG-PET predicts treatment efficacy and surgical outcome of pre-operative chemoradiation therapy for resectable and borderline resectable pancreatic cancer. Eur J Surg Oncol, 43: 1061-1067, 2017.
7) Okada KI , Hirono S , Kawai M , et al.: Value of apparent diffusion coefficient prior to neoadjuvant therapy is a predictor of histologic response in patients with borderline resectable pancreatic carcinoma. J Hepatobiliary Pancreat Sci, 24: 161-168, 2017.
8) Okada KI , Kawai M , Hieono S , et al.: Diffusion-weighted MRI predicts the histologic response for neoadjuvant therapy in patients with pancreatic cancer:a prospective study (DIFFERENT trial). Langenbecks Arch Surg, 405: 23-33, 2020.
9) Okada KI , Kawai M , Hirono S , et al.: Preoperative Scoring System to Predict Prognosis in Patients Who Undergo Neoadjuvant Therapy for Pancreatic Cancer. Anticancer Res, 40: 4033-4040, 2020.
10) Kawai M , Hirono S , Okada KI , et al.: Radiographic Splenic Artery Involvement Is a Poor Prognostic Factor in Upfront Surgery for Patients with Resectable Pancreatic Body and Tail Cancer. Ann Surg Oncol, 2020 PMID:32705517 DOI:10.1245/s10434-020-08922-8.
11) Truty MJ , Kendrick ML , Nagorney DM , et al.: Factors Predicting Response, Perioperative Outcomes, and Survival Following Total Neoadjuvant Therapy for Borderline/Locally Advanced Pancreatic Cancer. Ann Surg, (2019). https://doi:10.1097/SLA.0000000000003284 [Epub ahead of print]
12) Perri G , Prakash L , Wang H , et al.: Radiographic and Serologic Predictors of Pathologic Major Response to Preoperative Therapy for Pancreatic Cancer. Ann Surg, 2019. doi:10.1097/SLA.0000000000003442. [Epub ahead of print]
PDFを閲覧するためには Adobe Reader が必要です。