日外会誌. 122(2): 147-152, 2021
特集
肝胆膵領域腫瘍におけるBorderline resectable/Marginally resectableとは
―術前治療の可能性について―
3.肝内胆管癌
|
東京女子医科大学 消化器・一般外科 有泉 俊一 , 山本 雅一 |
肝内胆管癌の治療は,肝切除が唯一の根治的治療法である.肝内胆管癌の最適な手術適応は単発かつリンパ節転移陰性であり,これらの切除成績は改善され根治切除後の5年生存率は約60%に達する.一方,多発かつリンパ節転移陽性では5年生存は見込めず手術非適応である.多発またはリンパ節転移陽性では,5年生存率が約30%前後でありボーダーライン手術適応と考えられる.切除可能症例に対する術後補助化学療法については前向き試験で有用性が報告され,ガイドラインでも推奨されている.また広範囲な脈管侵襲など高度な局所進展を伴う切除不能(unresectable)症例に対する術前化学療法とconversion手術の報告がある.しかしボーダーライン手術適応例や手術非適応例に対する有用な術前化学療法(ネオアジュバント)はない.今後のさらなる検討が必要である.
キーワード
肝内胆管癌, 手術適応, ボーダーライン手術適応, 補助化学療法, 術前化学療法
I.はじめに
肝内胆管癌の治療は,肝切除が唯一の根治的治療法である.肝内胆管癌は,腫瘤形成型,胆管浸潤型,胆管内発育型に肉眼的に分類される1).この肉眼分類により頻度や発生部位(末梢胆管か肝門寄りか),病理組織像,切除成績が異なる2)
~
4).この中で最も頻度の多い腫瘤形成型や腫瘤形成+胆管浸潤型では根治切除し得たとしても再発率が高く,手術後の5年生存率は30〜40%である2)
~
7).しかし近年,肝内胆管癌の切除成績が改善している.本稿では,肝内胆管癌の手術適応,ボーダーライン手術適応,手術非適応についてと最新の術前・術後の化学療法について述べる.
II.肝内胆管癌の最適な手術適応は
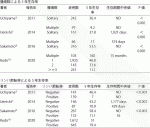
2020年に肝内胆管癌診療ガイドライン2021年度版が作成され発刊された(2020年12月発刊)8).腫瘍条件からみた外科治療の適応については,『単発でリンパ節転移のない場合が外科手術の最も良い適応である.』とされた.これまで腫瘤形成型の単発例の5年生存率は約40%前後であったが,最近は単発例の生存率は改善している(表1).Sakamotoら(日本肝癌研究会による419例の解析)の報告では単発例の5年生存率は53.5%9),第20回肝癌追跡調査報告では単発例の5年生存率は47%と報告された10).同様に,腫瘤形成型のリンパ節転移陰性例の生存率も改善がみられる.Sakamotoらはリンパ節転移陰性例の5年生存率は58.4%9),第20回肝癌追跡調査報告では5年生存率51%と報告された10).腫瘍数とリンパ節転移の両者を考慮したShimadaらの報告によると,腫瘤形成型で単発かつリンパ節転移陰性の5年生存率は65.3%5),自経例においても単発かつリンパ節転移陰性例の5年生存率は61%と腫瘤形成型の中では良好な切除成績であった(図1)11).

III.予後不良因子は?
腫瘤形成型の予後不良因子としては,CA19-9高値,リンパ節転移陽性,多発(肝内転移)が知られている2)
~
7).腫瘤形成型ではリンパ節転移陽性例の5年生存率は著しく低下し10%程度であった3)
~
7).Uchiyamaらの報告ではリンパ節転移陽性139例の5年生存率は7%だが,実際の5年生存例はわずかに3例だけであった3).しかしSakamotoらの報告では,リンパ節転移例の5年生存率は11.1%9),第20回全国肝癌追跡調査報告では5年生存率19.4%と報告され10),リンパ節転移陽性例でも切除成績が改善している.改訂された第6版原発性肝癌取扱い規約では,リンパ節転移陽性例はStage ⅣAとStage ⅣBに分類され,リンパ節転移陽性例の一部に手術適応があることを示唆している1).自験例でもリンパ節転移陽性例の5年生存率は27%まで改善し,単発でリンパ節転移陽性(Stage ⅣA)であれば5年生存率は41%に達した11).一方,多発の生存率はC19-9高値やリンパ節転移陽性よりさらに不良であり,多発の5年生存率は9.2%,MSTは15.2カ月と報告された3)
9).Shimadaらは多発かつリンパ節転移陽性例では25カ月以上の生存例がなかったと報告し5),自験例でも多発かつリンパ節転移陽性例の5年生存率は0%と極めて不良であった11).
IV.手術適応,ボーダーライン手術適応,手術非適応は?
前述したように,単発かつリンパ節転移陰性が最適な手術適応である.一方,多発かつリンパ節転移陽性は手術適応外である.当施設の腫瘍数(肝内転移)とリンパ節転移による生存率を示す(図1)11).多発またはリンパ節転移陽性例では,5年生存率が約30%程度あり,ボーダーライン手術適応と考えられる.

V.術前化学療法
切除不能(unresectable)胆道癌にはゲムシタビン+シスプラチン併用療法が標準治療として確立している12).近年,化学療法により切除不能が切除可能にconversionした報告がある(表2).Katoらは切除不能胆道癌がゲムシタビン+シスプラチン療法により切除可能となったconversion群の生存率は,切除不能群の生存率より有意に良好だったと報告している13).またLe Royらの切除不能肝内胆管癌の検討によると,ゲムシタビンを主体とした術前化学療法によるconversion率は53%(74例中39例)であり,conversion症例の生存期間中央値(MST 24.1カ月)と切除可能症例のMST中央値(25.7カ月)に有意差はなかったとしている14).これらは後向きの検討であるが,切除不能に対する術前化学療法の有効性を示唆した貴重な検討である.一方で切除可能な肝内胆管癌に対する術前化学療法(ネオアジュバント)のエビデンスはない.これらに対する新たな術前化学療法が期待される.

VI.術後補助療法
近年,胆道癌に対する術後のカペシタビン療法やS-1療法の有用性が報告されている(表3)15)
16).Primroseらは,肝内胆管癌を含む胆道癌で検討し,カペシタビン療法(210例)のMST中央値(53カ月)は,手術単独(220例)のMST中央値(36カ月)と比較し有意に生存期間の延長を認めたと報告している15).このカペシタビン療法は海外のガイドラインでは推奨されているが,本邦では保険適応がない.Kobayashiらは,胆道癌を対象とし術後ゲムシタビン療法とS-1療法を比較した16).S-1療法群はゲムシタビン療法群と比較して全生存期間が良好な傾向があり,1年生存率は有意に良好であったと報告している16).一方で,ゲムシタビン+オキサリプラチン併用療法やゲムシタビン療法による有用性は示されていない17)
18).本邦の新しい肝内胆管癌ガイドラインにおいては『認容性が確認され,有効性が示唆されるレジメンがあることから術後補助療法は考慮してもよい(弱い推奨)』とされた8).

VII.おわりに
肝内胆管癌の手術適応は単発かつリンパ節転移陰性例であり,手術非適応は多発かつリンパ節転移陽性例である.多発またはリンパ節転移陽性の場合はボーダーライン手術適応であるが,これらに対する術前化学療法は確立していない.肝切除と術後補助療法による切除成績の改善が認められるためこれを推奨する.
利益相反:なし
文献
1) 日本肝癌研究会編:原発性肝癌取扱い規約.第6版(補訂版),金原出版,東京,2019.
2) Yamamoto M , Takasaki K , Yoshikawa T , et al.: Does gross appearance indicate prognosis in intrahepatic cholangiocarcinoma? J Surg Oncol, 69: 162-167, 1998.
3) Uchiyama K , Yamamoto M , Yamaue H , et al.: Impact of nodal involvement on surgical outcomes of intrahepatic cholangiocarcinoma:a multicenter analysis by the Study Group for Hepatic Surgery of the Japanese Society of Hepato-Biliary-Pancreatic Surgery. J Hepatobiliary Pancreat Sci, 18: 443-452, 2011.
4) Yamamoto M , Ariizumi S : Surgical outcomes of intrahepatic cholangiocarcinoma. Surg Today, 41: 896-902, 2011.
5) Shimada K , Sano T , Sakamoto Y , et al.: Surgical outcomes of the mass-forming plus periductal infiltrating types of intrahepatic cholangiocarcinoma:a comparative study with the typical mass-forming type of intrahepatic cholangiocarcinoma. World J Surg, 31: 2016-2022, 2007.
6) Ariizumi S , Kotera Y , Takahashi Y , et al.: Mass-forming intrahepatic cholangiocarcinoma with marked enhancement on arterial-phase computed tomography reflects favorable surgical outcomes. J Surg Oncol, 104: 130-139, 2011.
7) Uenishi T , Ariizumi S , Aoki T , et al.: Proposal of a new staging system for mass-forming intrahepatic cholangiocarcinoma:a multicenter analysis by the Study Group for Hepatic Surgery of the Japanese Society of Hepato-Biliary-Pancreatic Surgery. J Hepatobiliary Pancreat Sci, 21: 499-508, 2014.
8) 日本肝癌研究会編:肝内胆管癌診療ガイドライン2021年度版,金原出版,東京,2020
9) Sakamoto Y , Kokudo N , Matsuyama Y , et al.: Liver Cancer Study Group of Japan. Proposal of a new staging system for intrahepatic cholangiocarcinoma:Analysis of surgical patients from a nationwide survey of the Liver Cancer Study Group of Japan. Cancer, 122: 61-70, 2016.
10) Kudo M , Izumi N , Kubo S , et al.: Report of the 20th nationwide followup survey of primary liver cancer in Japan. Hepatol Res, (Epub ahead of print).
11) 有泉 俊一 , 山本 雅一 :術前治療と切除適応 胆道癌の予後不良因子とは—手術適応のborderlineはどこか?肝内胆管癌.臨外,72(13)2017.
12) Valle J , Wasan H , Palmer DH , et al.: Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med, 362(14): 1273-1281, 2010.
13) Kato A , Shimizu H , Ohtsuka M : Downsizing Chemotherapy for Initially Unresectable Locally Advanced Biliary Tract Cancer Patients Treated with Gemcitabine Plus Cisplatin Combination Therapy Followed by Radical Surgery. Ann Surg Oncol, 3:S1093-S1099, 2015.
14) Le Roy B , Gelli M , Pittau G , et al.: Neoadjuvant chemotherapy for initially unresectable intrahepatic cholangiocarcinoma. Br J Surg, 105: 839-847, 2018.
15) Primrose JN , Fox RP , Palmer DH , et al.: BILCAP study group. Capecitabine compared with observation in resected biliary tract cancer (BILCAP):a randomised, controlled, multicentre, phase 3 study. Lancet Oncol, 20: 663-673, 2019.
16) Kobayashi S , Nagano H , Tomokuni A , et al.: A prospective, randomized phase II study of adjuvant gemcitabine versus S-1 after major hepatectomy for biliary tract cancer (KHBO 1208):Kansai Hepato-Biliary Oncology Group. Ann Surg, 270: 230-237, 2019.
17) Edeline J , Benabdelghani M , Bertaut A , et al.: Gemcitabine and oxaliplatin chemotherapy or surveillance in resected biliary tract cancer (PRODIGE 12-ACCORD 18-UNICANCER GI):A randomized phase III study. J Clin Oncol, 37: 658-667, 2019.
18) Ebata T , Hirano S , Konishi M , et al.: Randomized clinical trial of adjuvant gemcitabine chemotherapy versus observation in resected bile duct cancer. Br J Surg, 105: 192-202, 2018.
PDFを閲覧するためには Adobe Reader が必要です。