日外会誌. 122(1): 57-61, 2021
会員のための企画
再生医療の現況と今後の展望
|
1) 国立成育医療研究センター 研究所再生医療センター 阿久津 英憲1) , 萩原 悠介1)2) , 鶴田 覚2) |
再生医療とは,病気やけがで機能不全になった組織や臓器を再生あるいは補助する医療であり,再生医療技術は創薬などへの応用も期待されている.本邦では,再生医療の実用化を促進する制度的枠組みが整い,医療のみならず再生医学や再生医療関連産業の更なる発展が期待されている.法律施行から6年が経ち再生医療製品の上市数が順調に増える一方で,開発上の課題として高額な費用や長期間研究開発にかかることなど課題も明らかになってきた.本稿では,幹細胞の基礎的特性を理解しつつ,再生医療の制度的枠組みと開発の現況について概説し,今後の再生医療の課題と可能性についても述べる.
キーワード
stem cells, regenerative medicine, clinical trial, human embryonic stem cells
I.はじめに
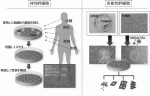
再生医療に使用する細胞,幹細胞についてまずその基本特性を確認したい.体性幹細胞(Adult stem cells)または組織幹細胞(Tissue specific stem cells)は生体内の組織内に存在する細胞である.自己複製能はあるもののその増殖能力には限界があり分化能も特定の胚葉組織に限られる.すでに再生医療の分野で活用されている間葉系幹細胞(Mesenchymal stem cells;MSC)は,脂肪,胎盤や歯髄などあらゆる組織から得られる(図1).MSCは,バイオマーカーによりある程度同定することが可能であるが1),これまで様々なバイオマーカーが提示され,国際的な枠組でMSCバイオマーカーを再考する動きも進んでいる2).体性幹細胞より分化能の高い特性をもつ胚性幹細胞(Embryonic Stem Cells;ES細胞)と人工多能性幹細胞(Pluripotent Stem Cells;iPS細胞)は,無限に細胞増殖する自己複製能を持ちかつあらゆる組織へ分化する能力を合わせ持つ多能性幹細胞である(図1).
II.再生医療の形態
再生医療に用いる細胞は,患者の自己由来(自家移植)か同種(他人)由来(同種移植)となる.主に細胞の二つの特性を期待する医療となる.1)障害等による欠損や機能低下となった部位へ細胞を補充することと,2)移植する細胞が分泌する因子による効果によって抗炎症性,血管新生や組織再生などの作用を期待する.さらに,MSCなどは障害部位へ集まる遊走能もあるとされている.
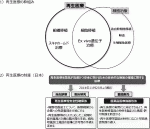
再生医療の枠組みの中には,細胞治療,組織移植とスキャホールド治療がある(図2-1).細胞治療はその名の通り細胞を用いた治療であるが,日本の法制度の枠組みの中で造血幹細胞移植,輸血と生殖補助医療は制度上再生医療の枠外である.組織移植は,培養表皮や培養軟骨のように細胞などを積層化し2.5次元化し移植に用いる方法である.スキャホールド治療は,細胞とともに生体材料(コラーゲン,ポリ乳酸など)を組み合わせ,組織再生を念頭に移植を行う.軟骨や半月板再生などの整形外科領域では,すでにスキャホールド治療が活用されている.Ex vivo遺伝子治療は,標的細胞を採取後治療に必要な遺伝子を導入し,その遺伝子導入細胞を移植する治療である.
III.再生医療に関する法制度
再生医療およびその開発を行うための制度上の枠組について,再生医療に関する二つの重要な法律が整備され,細胞を用いたほとんどの医療が対象となる(図2-2).まず薬事法では,再生医療の実用化に対応できるように再生医療等「製品」の特性を踏まえた承認・許可制度が新設され薬事法が一部改正となった.これまで分類が医薬品と医療機器の二つであったが,薬品医療機器等法が施行され,分類として新たに再生医療等製品が加わった.再生医療等製品の早期承認制度が導入され,より早く市場へ出す仕組みができあがり,世界に先駆けた革新的な制度とされる.もう一つの再生医療トラックとして,再生医療等安全性確保法が新たに整備され,自由診療や臨床研究として実施してきた再生医療が対象となる(図2-2).再生医療等安全性確保法では,人に対して与える影響(リスク)の程度に応じ三段階に分類(「第一種(高リスク)」,「第二種(中リスク)」と「第三種再生医療等(低リスク)」)される.第一種(高リスク)は,「ES細胞やiPS細胞,同種体性幹細胞そして遺伝子導入を行った細胞など」が対象となり,第二種(中リスク)は「培養操作を経た体性幹細胞や細胞移植が相同利用でないなど」,そして第三種(低リスク)は「培養を実施していない体細胞や細胞移植が相同利用である場合など」とされている.いずれにおいても,提供計画を策定し第三者の(特定)認定再生医療等委員会の審査承認を経て最終的に厚生労働大臣に提出しなければならない.一方で,医療機関から細胞培養加工を企業へ外部委託することが可能となった.

IV.わが国における再生医療の現況
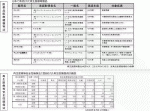
医薬品医療機器等法下で治験開発が行われ最終的に承認された再生医療等製品は,これまで九つの対象疾患の7製品となる(表1).内訳は,同種由来細胞製品は一つ(テムセルHS注)で,自己細胞由来が五つ,さらに遺伝子導入するもの(Ex vivo治療薬)が一つとなっている3).概して高額な治療価格がついており,最大なものは,キメラ抗原受容体T細胞(CAR-T)療法のキムリアで単回静脈投与により3,349万3,407円の薬価がついている.
再生医療等安全性確保法では,「第一種」として臨床研究が16件,「第二種」は臨床・研究合わせて721件,そして「第三種」として臨床・研究で3,367件となり全体では合計4,104件が登録されている(表1).全体の82%が第3種であり自己多血小板血漿(PRP)療法や自己リンパ球活性化療法などが該当している.
V.グローバルにおける再生医療製品の開発状況
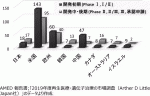
日本医療研究開発機構(AMED)から報告された2019年度再生医療・遺伝子治療の市場調査(Arther D Little Japan社;以下,「AMED再生医療報告書」)4)によると,再生・細胞医療医薬品の上市品数(2020年1月時点)は,日本の6件に対し欧州39件,米国25件,そして韓国23件となりこの3国(地域)で製品数が多い.一方,上市に至る前の再生医療製品開発段階で比較すると米国と欧州で開発数が多く,中国,日本,韓国がそれに続いている(図3).日本も開発の中・後期が17件あり今後の上市製品の増加が期待される.
再生医療は基礎研究の実績や安全性・有効性の検証が進み移植技術も担保されるような皮膚や軟骨疾患から進んでいる.一方で,アンメット・メディカル・ニーズへ適応する観点から大きく二つのアプローチで開発が進められてきた.患者数はある一定数はあるものの治療薬がないケースと患者数は少ないが治療薬の必要性が高いケースである.前者の例では難治性がんに対する開発であり,後者は希少疾患に対するオーファンドラッグの範疇になる.
今後10年の再生医療の動向として,「AMED再生医療報告書」のデータからグローバル規模での開発中・後期の製品分野を見てみると,どの国でも圧倒的にがんが多い.米国では36%(34/95品目),欧州40%(16/40品目)そして日本では24%(4/17品目)である5).今後もキムリアのような自家細胞によるCAR-TなどのEx-vivo遺伝子治療製品が増えることが予想され,「血液のがん」から「固形がん」へも開発が進んでいくと想定される.
次世代の再生医療として期待されているヒト多能性幹細胞による再生医療は,2010年に世界で初めてヒトES細胞を用いた脊髄損傷に対する臨床試験により始まり,さらに網膜性疾患,インスリン依存性糖尿病やパーキンソン病などでも臨床試験が実施されている5).しかし,ヒト多能性幹細胞の再生医療製品開発はまだ初期段階に限定している5).
VI.新たな再生医療へ挑戦
革新的な再生医療を開発し臨床へと進める法令の制度が整っている.再生医療等安全性確保法の下の臨床研究は,AMED研究事業などの公的研究資金の援助を受け臨床研究開発が進められている.企業の開発としては対象となりにくいアンメット・メディカル・ニーズの再生医療に対して,臨床研究では臨床が可能となる.例えば,小児の患者を対象にして「先天性食道閉鎖症術後食道吻合部狭窄への自己由来口腔粘膜上皮細胞シ-ト移植の臨床研究」(国立成育医療研究センター)がAMED事業のサポートの下実施されている6).
再生医療安全性確保法下での臨床研究の多くは公的研究費で運用されるが,先進医療技術へと進めるのか,医薬品医療機器等法での治験開発へ移行するのかなど考慮する必要がある.前臨床研究段階の安全性,有効性等の試験基準などがそもそも臨床試験・治験開発に準じたものでない限りデータが活用できないことが起こりえる.研究開発の早い段階から先を見据え戦略的に研究を実施する必要がある.
外科領域の中での再生医療は,再生医療が既存の治療手段に取って代わるというより既存治療との融合,コンビネーションにより新たな治療価値を見いだしていくことが重要と思われる.国立成育医療研究センターで実施されているヒトES細胞を用いた再生医療が新たな可能性を提示している.有毒なアンモニアを体内で分解できない先天性尿素サイクル異常症の患児に対して,ヒトES細胞由来の肝細胞を肝臓へ移植しアンモニア濃度の上昇を抑え「橋渡しの治療」として無事に生体肝移植を実施できた.新生児対象,さらに肝臓を対象としたヒトES細胞の再生医療は世界で初めての実施例であった7).
ヒト多能性幹細胞研究の分野では,近年疑似臓器(オルガノイド)研究が進んでいる.再生医療的観点から臓器を代替するというレベルまでまだまだ届いていないが,短腸症候群など従来の外科的治療も含めた複合的アプローチでも治療が難渋する症例に対して,次々世代の再生医療として研究開発の意義は大きい.筆者は,若い臨床医が再生医学研究へ挑戦することを心から期待している.
VII.おわりに
日本は,世界に先駆け再生医療に特化した法律が整備され,今後ますます発展が期待される医療分野である.再生医療は,幹細胞生物学,発生学などの基礎医学研究の進展と臨床上の究極的な課題とのマッチングの中で初めてダイナミックに進むものと思われる.基礎研究段階から臨床医の寄与が極めて重要な研究分野である.幹細胞の特性の理解が深まることで発生,組織再生などの基礎医学や再生医学,創薬分野など幅広く研究が進み,再生医療がより大きく貢献できる医療になるよう期待したい.
利益相反:なし
文献
1) Dominici M, Le Blanc K, Mueller I, et al.: Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 8: 315-317, 2006.
2) Mendicino M, Bailey AM, Wonnacott K, et al.: MSC-based product characterization for clinical trials:an FDA perspective. Cell Stem Cell, 14: 141-145, 2014.
3) 医薬品医療機器総合機構(PMDA):再生医療等製品の承認審査情報一覧(2010年10月14日時点), https://www.pmda.go.jp/review-services/drug-reviews/review-information/ctp/0002.html
4) 日本医療研究開発機構(AMED):「2019年度再生医療・遺伝子治療の市場調査業務(Arther D Little Japan社)」: https://www.amed.go.jp/content/000062056.pdf
5) 阿久津 英憲:ヒトES細胞の臨床応用.J Mamm Ova Res, 36: 91-97, 2019.
6) 日本医療研究開発機構(AMED):「再生医療研究開発2020」: https://www.amed.go.jp/content/ 000064155.pdf
7) 国立成育医療研究センター:「先天性尿素サイクル異常症でヒトES細胞を用いた治験実施に関するプレスリリース」: https://www.ncchd.go.jp/press/2020/pr_20200521.html
PDFを閲覧するためには Adobe Reader が必要です。