日外会誌. 122(1): 48-55, 2021
特集
肺・胸腺神経内分泌腫瘍の治療
8.神経内分泌腫瘍の病理
|
国立病院機構茨城東病院 胸部疾患・療育医療センター病理診断科 南 優子 |
2017年に発刊された日本肺癌学会肺癌取扱い規約では,肺癌の神経内分泌腫瘍には小細胞癌:Small cell carcinoma:SCLC,大細胞神経内分泌癌:Large cell neuroendocrine carcinoma:LCNEC,異型カルチノイド:Atypical carcinoid:AC,定型カルチノイド:Typical carcinoid:TCが含まれ,前浸潤性病変としてびまん性特発性肺神経内分泌細胞過形成:Diffuse idiopathic pulmonary neuroendocrine cell hyperplasia:DIPNECHが新たに分類されている.
本章では肺神経内分泌腫瘍分類の変遷,各々の組織型や特徴,遺伝子変異などを述べる.さらに神経内分泌細胞の増殖病変や生検検体での診断名に関しても述べていく.
キーワード
神経内分泌腫瘍, 小細胞癌, 大細胞神経内分泌癌, 定型カルチノイド, 異型カルチノイド
I.はじめに
神経内分泌腫瘍は様々な臓器に発生し,神経分泌顆粒を有し,特徴的な組織型および免疫プロファイルを示す.発生率は,解剖学的部位によって異なり,以下の特徴を認める.1:傍神経節を含むほぼ全ての解剖学的部位に発生し,全身のあらゆる種類の臓器や軟部組織に分布する.2:各部位の上皮または神経/神経外胚葉に由来し,分化に応じて形態学的およびタンパク発現の主要な特徴を示す.3:特定の解剖学的部位でみられる正常な細胞のタンパク発現と同様に神経内分泌腫瘍も発生部位に応じて様々なスペクトルのタンパクを発現する.これらには,一般的な神経内分泌マーカー(Chromogranin AおよびB,Synaptophysin,CD56等)や,ホルモン,転写因子等の部位固有のマーカーが含まれる1).本章では肺に発生する神経内分泌腫瘍について病理学的視点から述べていく.
II.肺神経内分泌腫瘍分類の変遷
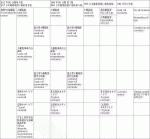
日本肺癌学会編 臨床・病理肺癌取扱い規約初版(1978年)2)から第5版(1999年)3)までは日本独自の組織分類を用いており,小細胞癌:Small cell carcinoma:SCLCは燕麦細胞型(リンパ球様型)と中間細胞型,カルチノイドは(定型的)カルチノイド,亜型として非定型的カルチノイドが分類されていた.第6版(2003年)4)からはWorld Health Organization:WHO分類第3版(1999年)5)と同じ組織分類を用いるようになり,SCLCは細胞型による分類はなくなり,SCLCと特殊型としてSCLCと非小細胞癌からなる混合型SCLCに分類され,カルチノイドは定型的カルチノイド,非定型的カルチノイドが核分裂数と壊死の有無によって分類された.さらに,大細胞癌の特殊型として大細胞神経内分泌癌:Large cell neuroendocrine carcinoma:LCNECが新たに加わり,LCNECの特殊型として腺癌,扁平上皮癌,巨細胞癌,紡錘細胞癌が混在した腫瘍を混合型LCNECとされた.現在はWHO分類第4版(2015年)6)出版時に神経内分泌腫瘍:Neuroendocrine tumour:と新カテゴリーが設けられた.日本の分類には第8版(2017年)7)から反映され,SCLCと特殊型として混合型SCLC,LCNECと特殊型として混合型LCNEC,カルチノイドは定型カルチノイド:Typical carcinoid:TC,異型カルチノイド:Atypical carcinoid:ACと名称が変更された.また,前浸潤性病変としてびまん性特発性肺神経内分泌細過形成:Diffuse idiopathic pulmonary neuroendocrine cell hyperplasia:DIPNECHが新たに分類された.(表1)
III.肺神経内分泌腫瘍の今後の分類
消化器腫瘍のWHO分類2019年8)では内分泌系性質と分化を示す膵・消化管腫瘍を神経内分泌腫瘍:Neuroendocrine neoplasms:NENと総称し,NENはさらに高分化型神経内分泌腫瘍:Neuroendocrine tumour:NET,低分化型神経内分泌癌:Neuroendocrine carcinoma:NECと分類された.NETは核分裂数と細胞増殖マーカーのKi67でグレードをG1:Low,G2:Intermediate,G3:Highとわける.肺ではカルチノイドがNET相当であり,TCはG1,ACはG2,NECにはSCLC,LCNECが相当するが,NET,NECの分類に当てはめつつも,今までの肺癌特有の組織名を用いる可能性が高い1).(表2)

IV.各論
びまん性特発性肺神経内分泌細胞過形成:DIPNECH
DIPNECHは,腫瘍関連性がある肺神経内分泌細胞の多病巣性,びまん性に過形成を示す病変である.終末細気管支に発生し,多くの場合,閉塞性細気管支炎に伴ってみられる.通常は0.5cm未満の病変であり,0.5cmを超えるものはカルチノイドとする.免疫組織化学染色(以下,免疫染色)では神経内分泌マーカーやサイトケラチン(CK)7が陽性でTTF1,CD10,gastrin-releasing peptide/bombesin-like peptideも陽性でカルチノイドよりも発現が高い9).DIPNECHはカルチノイド腫瘍の前浸潤性病変と考えられているがSCLCやLCNECの前浸潤性病変とは考えられていない.
カルチノイド腫瘍:Carcinoid
カルチノイドは神経内分泌分化,すなわち類器官様(organoid),索状(trabecular),島状(insular),柵状(palisading),リボン状(ribbon),ロゼット様構造(rosetts-like)を示す低悪性度腫瘍である.腫瘍細胞は大小不同に乏しく,立方形,多角形,紡錘形で,核クロマチンは細顆粒状である.全肺癌の中でのカルチノイドの頻度は1〜2%で,SCLCやLCNEC等と異なり喫煙との関係は低いとされる.白人女性にやや多く,40〜60歳代に発生する10).
免疫染色では神経内分泌マーカー,INSM1,低分子CKが陽性である.TTF1やEstrogen receptorは半数程度の腫瘍には陽性を示す11).
カルチノイドの遺伝子異常ではSWI / SNF複合体の共有ヒストン修飾因子とサブユニットが,各々40%と22.2%で変異しているという報告12)やMEN1など11qの遺伝子変異が関与するという報告,ARID1A,EIF1AX,PSIP1の変異の報告があるが,もっとも多くみられるMEN1の変異でも11~22%の報告であり,カルチノイドの遺伝子変異は少ない.また,TC,ACも遺伝子変異の差異ではなく壊死の有無,核分裂数で分類される.他のNETで用いられているKi67による区別はまだコンセンサスが得られておらず今後の課題となる1).
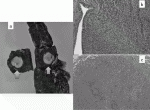
TC,ACの発生は8~10:1とTCが圧倒的に多くみられる.TCは核分裂像が2個/2mm2(400倍10視野)未満で壊死がなく,ACは核分裂像が2~10個/2mm2で壊死がみられる.(表2,図1a,b,c)
大細胞神経内分泌癌:LCNEC
LCNECは,免疫染色で一つ以上の神経内分泌マーカーがびまん性に陽性を示し,核分裂像が11個以上/2mm2認められる神経内分泌分化を示す高悪性度の非小細胞癌である.ただし,核分裂像は平均75個以上/2mm2みられ,30個未満/2mm2であることは稀である.(表2)神経内分泌分化は先のカルチノイドに示した形態を示すものである.混合型LCNECは,腺癌,扁平上皮癌,紡錘細胞癌または巨細胞癌の成分を含む.LCNECの頻度は切除された全肺癌の約3%で,75%以上は肺の末梢に発生する.男性,高齢者(65歳以上)に多く,高喫煙者が90%以上で喫煙と関係がある6)7)13).
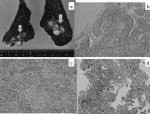
LCNECの遺伝子異常はTP53の変異が最も多く(92%)で,次いでRB1(42%)の変異,TP53とRB1の両方の遺伝子変異(40%)も多くみられる.特に,混合型LCNECは,RB1の変異が多い.さらに,STK11(30%)とKEAP1(22%),ADAMTS2(15%),ADAMTS12(20%),GAS7(12%),NTM(10%)の変異の報告もある.またTP53およびSTK11/KEAP1変異(37%),ASCL1high/DLL3high/NOTCHlowの型およびTP53とRB1の変異,ASCL1low/DLL3low/NOTCHhighの型があるという報告がある13).George Jらの論文ではLCNECと肺腺癌または扁平上皮癌との類似性は示唆されず,LCNECが他のタイプの肺癌のバリアントではなく,神経内分泌性肺腫瘍のスペクトル内で異なるサブグループを示していると報告されている.(図2a,b,c,d)
小細胞癌:SCLC
SCLCは胞体が乏しく,N/C(核/細胞質)比が高い,比較的小型の腫瘍細胞がびまん性に増殖する.壊死も頻繁に認められる.腫瘍細胞の核ではクロマチンは微細顆粒状で核小体は目立たない.気管支鏡下生検など鉗子で採取した検体では腫瘍細胞の挫滅がみられ,核線を引いてみられることが多い.核分裂像が少なくとも11個以上/2mm2,平均では60~70個/2mm2で,200個以上/2mm2になることもある.(表2)混合型SCLCは腺癌,扁平上皮癌,大細胞癌,LCNEC,肉腫様癌,肉腫などの成分を含む.免疫染色では神経内分泌マーカーでCD56,Synaptophysinは陽性,Chromogranin Aは弱陽性,TTF1,CKが陽性を示すがLCNECとは異なり,SCLCを診断するために神経内分泌マーカーが陽性である必要はなく形態のみで診断して良い.SCLCの大部分は中枢気管支に認め,縦隔リンパ節と一塊になることもある.約5%と頻度は少ないが肺末梢にも発生する.全肺癌の15%程度を占め,喫煙との関連が高い6)7).
SCLCの遺伝子異常はLCNECの一部の型と同様のTP53とRB1の変異,ASCL1low/DLL3low/NOTCHhighやTP53とRB1の変異,ASCL1high/DLL3high/NOTCHlowがみられる.また多くのSCLCではNOTCHシグナルの抑制が認められ,P73の再構成も報告されている14).(図3a,b,c)
神経内分泌細胞の増殖病変
テューモレット:Tumorlet
神経内分泌細胞の増殖性病変で女性に好発し,組織学的な肺の検索で偶発的に発見されることが多い.発見頻度は0.1〜0.2%とされる.気管支または細気管支周囲に中等量の細胞質を有した均一な大きさの円形,楕円形ないしは紡錘形の細胞が結節を形成して増殖している.大きさはDIPNECHと同様に0.5cm以下であり,0.5cmより大きいものはカルチノイドに分類される.Tumorletは炎症性肺疾患,肺線維症,結核,気管支拡張症,瘢痕周囲,カルチノイドの周囲にみられる.またDIPNECHに伴ってみられる場合もある.免疫染色では神経内分泌マーカーおよびCK7,AE1/AE3,TTF1,hCGαが陽性を示す11)15).
微小髄膜細胞様結節:Minute meningothelioid nodules
肺胞壁や胸膜下,小葉間隔壁などの小血管周囲に上皮様細胞が小胞巣状,渦巻き様またはZellballen様(充実性胞巣状配列)の構築がみられる.
Minute meningothelioid nodulesは顕微鏡下に偶発的に発見されることが多く,発生頻度は手術例で1.1〜9.5%で,解剖例では0.3〜0.5%とされている.肺腺癌との合併の頻度が高く,女性に多い.本結節ではprogesteron受容体(PgR)が陽性を示し,腺癌でも半数以上がPgR陽性であることから腺癌との合併が多いことが示唆されていて,PgRが細胞増殖に関わっているとも考えられている.その他免疫染色では,EMA,Vimentin,CD56が陽性を示すが,Chromogranin A, SynaptophysinやTTF1,CKは陰性である.本腫瘍はTumorletとの鑑別が問題になる15)16).
生検診断,迅速診断での考え方
生検検体ではSCLCはHE染色で形態的に明らかであればSCLCと診断する.LCNECは神経内分泌分化および神経内分泌マーカーの免疫染色が陽性であることを確認した場合はNon-small cell carcinoma with neuroendocrine morphology and positive neuroendocrine markers, possible LCNEC,LCNECを示唆する非小細胞癌と診断する.神経内分泌分化を確認したのみで,免疫染色で神経内分泌マーカーを確認していない場合はNon-small cell carcinoma with neuroendocrine morphology, possible LCNECと診断する.神経内分泌マーカー陽性の腺癌や扁平上皮癌とは区別することが必要である6)7).また生検検体では混合型腫瘍は診断できない場合がある.
術中に行う迅速診断では免疫染色での診断ができないため,神経内分泌分化がみられLCNECを疑う場合はNon-small cell carcinoma with neuroendocrine morphology, possible LCNECとしてもよい.SCLCは形態的に明らかであればSCLCと診断可能である.


V.おわりに
神経内分泌腫瘍には分子標的薬は現在のところ殆どなく,組織型そのものが治療に関わる.診断の一助として検体を病理に提出する際には病理依頼書に神経内分泌腫瘍を疑う根拠(腫瘍マーカーや画像情報,臨床所見)等を記載していただきたい.
利益相反:なし
文献
1) Rindi G, Klimstra DS, David SK, et al.: A common classification framework for neuroendocrine neoplasms: an International Agency for Research on Cancer (IARC) and World Health Organization (WHO) expert consensus proposal. Mod Pathol, 31: 1770–1786, 2018.
2) 日本肺癌学会:臨床・病理肺癌取扱い規約.初版,金原出版,東京,1978.
3) 日本肺癌学会:臨床・病理肺癌取扱い規約.第5版,金原出版,東京,1999.
4) 日本肺癌学会:臨床・病理肺癌取扱い規約.第6版,金原出版,東京,2003.
5) Travis WD, Cloby TV, Corrin B, et al.: International histological classification of tumours, Histological typing of lung and pleural tumours, World health organization, third edition, Springer, Geneva, 1999.
6) Travis WD, Brambilla E, Burke AP, et al.: WHO classification of tumours of the lung, pleura, thymus and heart, WHO, 4th edition, IARC, Lyon, 2015.
7) 日本肺癌学会:臨床・病理肺癌取扱い規約.第8版,金原出版,東京,2017.
8) WHO Classification of Tumours Editorial Board: WHO classification of tumours, Digestive system tumours, 5th edition, Volume 1, IARC, Lyon, 2019.
9) Mengoli MC, Rossi G, Cavazza A, et al.: Diffuse Idiopathic Pulmonary Neuroendocrine Cell Hyperplasia (DIPNECH) Syndrome and Carcinoid Tumors With/Without NECH, A Clinicopathologic, Radiologic, and Immunomolecular Comparison Study. Am J Surg Path, 42: 646-655, 2018.
10) Caplin ME, Baudin E, Ferolla P, et al.: Pulmonary neuroendocrine (carcinoid) tumors:European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann Oncol, 26: 1604–1620, 2015.
11) Fisseler-Eckhoff A, Demes M: Neuroendocrine Tumors of the Lung. Cancers (Basel), 4: 777-798, 2012.
12) Fernandez-Cuesta L, Peifer M, Lu X, et al.: Frequent mutations in chromatin-remodelling genes in pulmonary carcinoids. Nat Commun, 5: 3518, 2014.
13) George J, Walter V, Thomas RK: Integrative genomic profiling of large-cell neuroendocrine carcinomas reveals distinct subtypes of high-grade neuroendocrine lung tumors. Nat Commun, 9: 1048, 2018.
14) George J, Lim JS, Jang SJ, et al.: Comprehensive genomic profiles of small cell lung cancer. Nature, 524: 47-53, 2015.
15) 深山 正久,野口 雅之,松野 吉宏:腫瘍病理鑑別診断アトラス.肺癌,文光堂,東京,2014.
16) Mizutani E, Tsuta K, Maeshima AM, et al.: Minute pulmonary meningothelial-like nodules: clinicopathologic analysis of 121 patients. Hum Pathol, 40: 678–682, 2009.
PDFを閲覧するためには Adobe Reader が必要です。