日外会誌. 124(5): 404-409, 2023
特集
外科医によるこれからの癌薬物療法―最新知識と安全で効果的な遂行のコツ―
4.肝癌における薬物療法
|
東京大学 肝胆膵外科 市田 晃彦 , 長谷川 潔 |
近年,切除不能肝細胞癌に対する薬物療法としてレンバチニブ,アテゾリズマブ・ベバシズマブ併用療法,デュルバルマブ・トレメリムマブ併用療法などの新たな薬物療法が使用できるようになった.第Ⅲ相試験において従来一次治療に用いられてきたソラフェニブと比較し,レンバチニブは全生存率における非劣性が,他の二つの治療は全生存率における優越性が示された.レンバチニブは腫瘍の血流減少効果が強く治療効果発現が早いという特徴があり,治療強度を維持し継続するためには倦怠感などの副作用マネジメントが重要である.アテゾリズマブ・ベバシズマブは5.5%と高い完全奏効率が報告されており著効する症例もみられている.免疫関連有害事象やベバシズマブに特有の有害事象に注意する必要がある.デュルバルマブ・トレメリムマブ併用療法は2種類の免疫チェックポイント阻害薬を組み合わせた新しい治療である.2023年3月現在,まだ使用された症例数は限られているが今後,症例数の蓄積とともにその特徴が明らかになってくると思われる.これらの薬剤をどのように使い分けるか,他の治療と組み合わせることでさらなる治療成績の改善が得られるか,など今後の検討が必要である.術後補助療法はこれまでは有効な治療法が見出せていなかったが,第Ⅲ相IMbrave050試験の中間解析結果が公表され,アテゾリズマブ・ベバシズマブ併用療法の有効性が報告された.
キーワード
切除不能肝細胞癌, レンバチニブ, アテゾリズマブ・ベバシズマブ併用療法, デュルバルマブ・トレメリムマブ併用療法, 術後補助療法
I.はじめに
切除不能肝細胞癌に対する薬物療法は長らく,ソラフェニブが一次治療の時期が続いていたが2018年3月にレンバチニブが,2020年9月にアテゾリズマブ・ベバシズマブ併用療法が,2022年12月にデュルバルマブ・トレメリムマブ併用療法が承認され,その治療戦略も一昔前とは様変わりしている.また,二次治療以降の選択肢としてレゴラフェニブ,ラムシルマブ,カボザンチニブが使用可能となっている.今後は薬物療法が奏効したために切除不能症例が切除可能になることも増加すると予想され,外科医も主な薬物療法の特徴を把握しておく必要があると思われる.また,術後補助療法については長らく有効な治療法が見出せていなかったが,免疫チェックポイント阻害薬を使用した術後補助療法の第Ⅲ相試験が多数行われており,その一つであるIMbrave050試験の中間解析結果は有望なものであった.本稿では奏効率が比較的高く,今後の一次治療〜二次治療において主要な役割を果たすと思われるレンバチニブ,アテゾリズマブ・ベバシズマブ併用療法,デュルバルマブ・トレメリムマブ併用療法の3種類の薬物療法について,自施設での使用経験や最新知識と安全で効果的な遂行のコツを含めて解説する.また,術後補助療法について今後の展望を含めて解説したい.
II.レンバチニブを用いた薬物療法
本邦で2018年3月に保険承認された経口マルチキナーゼ阻害剤のレンバチニブは第Ⅲ相試験のREFLECT試験において,従来使用されてきたソラフェニブと比較し,全生存率における非劣性と奏効率・無増悪生存期間の優越性が示された1).生存期間中央値はレンバチニブ群で13.6カ月,ソラフェニブ群で12.3カ月であった.mRECISTによる独立画像評価においてレンバチニブ群は40.6%と高い奏功率が報告されている一方でソラフェニブ群の奏功率は12.4%であった(P<0.0001).また,RECIST version1.1による評価ではレンバチニブ群の奏効率は18.8%,ソラフェニブ群の奏効率は6.5%であった(P<0.0001).RECIST version1.1でprogressive disease (PD)と判定された症例はレンバチニブ群18%,ソラフェニブ群32%であった.無増悪生存期間の中央値はレンバチニブ群で7.3カ月,ソラフェニブ群で3.6カ月とレンバチニブ群の方が優位に長かった(P<0.0001).治療に関連したgrade3以上の有害事象はレンバチニブ群の57%,ソラフェニブ群の49%にみられたとされている.このように早期濃染部の大きさで評価を行うmRECISTでの奏効率が高く,血流減少効果が強いのがレンバチニブの特徴の一つである.
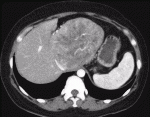
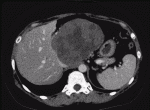
もう一つのレンバチニブの特徴は治療効果発現が早いことである.REFLECT試験1)では治療開始後,8週ごとにダイナミックCTもしくはMRIでの評価を行っており,奏効までの期間の中央値は8週間であった2).40人の患者にレンバチニブを投与し,2週間後のCTによる効果判定で奏効率が57.5%であったとする報告もみられている3).効果発現が早く,血流減少効果が強い例として,自施設で経験した症例を提示する.症例はB型肝肝炎,肝細胞癌の40代女性.肝S1の径115mmの肝細胞癌に対しレンバチニブの投与を行ったところ,4週間後のCTでは腫瘍の造影効果はほぼ消失した(図1,図2).
切除不能肝細胞癌に対してレンバチニブを用いた薬物療法を行い,その後に外科的治療を行った症例報告や単施設からの報告が散見されるが,前向き多施設共同研究ではLENS-HCC試験(臨床研究実施計画番号jRCTs031190057)の結果が2022年のASCO-GIで発表された4).LENS-HCC試験では技術的切除不能症例のみならず,脈管侵襲・肝外転移・多発腫瘍などの予後不良因子を有し,切除後の予後が不良と予測される腫瘍学的切除不能の症例も対象とされた.8週間のレンバチニブ治療後に切除の可否判断が行われ,その時点で技術的に切除可能な症例では手術が行われた.49例が登録され,主要評価項目である外科的切除率は67.3%であり手術関連死亡は認めなかった.治療開始1年後の生存率は75.9%であり無増悪生存期間の中央値は7.2カ月であった.レンバチニブ投与前のICG15分停滞率の中央値は14.5%,治療後のICG15分停滞率の中央値は17.3%でありレンバチニブ投与による肝予備能の悪化は臨床的に問題にならない程度であった.レンバチニブの有害事象は休薬とともに軽快するものがほとんどであり,レンバチニブ投与に関連する術後合併症は認めなかった.LENS-HCC試験によりレンバチニブ投与後外科的治療の安全性が確認されたが観察期間の中央値は9.3カ月と短く,今後は長期予後の解析結果が待たれるところである.
最後に,当科でのレンバチニブ使用経験と安全で効果的に治療を行うコツについて解説したい.当科ではLENS-HCC試験に登録した症例も含めて7例の腫瘍学的切除不能症例に対してレンバチニブ投与を行った.ほとんどの症例で休薬や投与量の減量を要する有害事象を認め,減量・休薬なしに8週間治療を継続できた症例は1例のみであった.休薬を要する有害事象として,4例で倦怠感・食欲低下を,1例で急性胆嚢炎を1例で発熱を認めた.治療を継続するためには倦怠感のマネジメントが重要であると思われた.近年,Weekends-Off法(レンバチニブの5投2休)がレンバチニブ投与期間と生存期間を延長させる上で有用であったことが報告されている5).また,漢方薬の人参養栄湯を併用することがレンバチニブ治療中の倦怠感の抑制や肝機能の維持に有用であることが報告されている6).
III.アテゾリズマブ・ベバシズマブ併用療法を用いた薬物療法
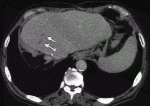
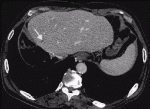
2020年9月に保険承認された抗PD-L1抗体アテゾリズマブと抗VEGF抗体ベバシズマブの併用療法は第Ⅲ相試験のIMbrave150試験において,ソラフェニブと比較して有意に全生存期間と無増悪生存期間を延長させ,死亡リスクを42%減少させることが報告されている7).治療開始12カ月後の時点での生存率はアテゾリズマブ・ベバシズマブ併用療法群67.2%,ソラフェニブ群54.6%であった.mRECISTによる評価ではアテゾリズマブ・ベバシズマブ併用療法群の奏効率は33.2%,ソラフェニブ群の奏効率は13.3%であった(P<0.001).RECIST version1.1による評価ではアテゾリズマブ・ベバシズマブ併用療法群の奏効率は27.3%,ソラフェニブ群の奏効率は11.9%であった(P<0.001).RECIST version1.1による評価でPDと判定された症例はアテゾリズマブ・ベバシズマブ併用療法群で19.6%,ソラフェニブ群で24.5%であった.無増悪生存期間の中央値はアテゾリズマブ・ベバシズマブ併用療法群で6.8カ月,ソラフェニブ群で4.3カ月とアテゾリズマブ・ベバシズマブ併用療法群の方が優位に長かった(P<0.001).治療に関連したgrade3以上の有害事象はアテゾリズマブ・ベバシズマブ併用療法群の56.5%,ソラフェニブ群の55.1%にみられたとされている.アテゾリズマブ・ベバシズマブ併用療法の最大の特徴は高い奏効率であり,RECIST version1.1による評価では完全奏効の割合は5.5%であった.自施設で経験した完全奏効の症例を提示する.症例は70代男性,門脈内腫瘍栓を伴う非B非C肝細胞癌に対し右肝切除を行ったが半年後に肝S4門脈内に腫瘍栓の再発を認めた(図3).病勢コントロールのためアテゾリズマブ・ベバシズマブ併用療法を8コース施行.腫瘍栓の縮小を認めた(図4).肝S4の切除を行ったが病理所見ではviableな腫瘍細胞の残存は認めなかった.2回目の手術から半年経過した現在でも無再発生存中である.
レンバチニブと同様に,切除不能肝細胞癌に対してアテゾリズマブ・ベバシズマブ併用療法を行い,その後に外科的治療を行う前向き多施設共同研究RACB試験(臨床研究実施計画番号jRCTs0512 10148)が行われており,2023年3月現在,症例登録中である.
当科のアテゾリズマブ・ベバシズマブ併用療法の経験について,当科ではこれまで7例の腫瘍学的切除不能症例と3例の技術的切除不能症例にアテゾリズマブ・ベバシズマブ併用療法を行ってきた.レンバチニブと比較すると有害事象はマイルドな印象であり,軽微なものも含めると腎機能障害2例,発熱2例,高血圧2例,蛋白尿2例,皮膚障害2例,糖尿病悪化1例,甲状腺機能低下1例,好中球減少1例,肺炎1例であった.休薬を要する症例も少ない印象であるが腎機能障害を認めた症例は腎機能障害が遷延した.腎機能障害を認めた症例のうち1例では腎生検を行ったが免疫関連有害事象と断定は困難な所見であった.最終的に腫瘍学的切除不能の3例および技術的切除不能の2例で外科的治療が行われたがアテゾリズマブ・ベバシズマブ併用療法に関連する術後合併症は認めなかった.
最近のトピックスとして,ベバシズマブの休薬について述べたい.ベバシズマブは出血,消化管穿孔,創傷治癒遅延など特有の副作用が報告されており,治療経過中に投与困難な状況になることがある.そのような際にベバシズマブの投与を中止し,アテゾリズマブ単剤で治療を行った場合でも生存率に影響はみられなかったことが報告されている8).ベバシズマブの投与が困難な状況になった際には二次治療に移行するのではなく,アテゾリズマブ単剤で治療を継続するという選択肢についても考慮する必要がある.
IV.デュルバルマブ・トレメリムマブ併用療法を用いた薬物療法
2022年12月に保険承認された抗PD-L1抗体デュルバルマブと抗CTLA-4抗体トレメリムマブの併用療法はSTRIDEレジメン(Single Tremelimumab Regular Interval Durvalumab)と呼ばれている.第Ⅲ相試験のHIMALAYA試験において,ソラフェニブと比較して有意に全生存期間を延長させ,死亡リスクを22%減少させることが報告されている9).生存期間中央値はSTRIDE群で16.4カ月,ソラフェニブ群で13.8カ月であった(P=0.0035).RECIST version1.1による評価ではSTRIDE群の奏功率は20.1%,ソラフェニブ群の奏功率は5.1%であった.RECIST version1.1でPDと判定された症例はSTRIDE群で35.9%,ソラフェニブ群で30.3%であった.Grade3または4の有害事象はSTRIDE群の50.5%に,ソラフェニブ群の52.4%にみられたと報告されている.STRIDE群の頻度が高い有害事象は下痢(26.5%),掻痒症(22.9%),発疹(22.4%)などであった.
STRIDEレジメンは2種類の免疫チェックポイント阻害薬を組み合わせた治療である.肝細胞癌領域では他にそのようなレジメンは承認されておらず,新しい作用機序の治療と言える.投与スケジュールについて,トレメリムマブは初回のみ300mgを投与し,デュルバルマブは4週間ごとに1,500mgの投与を行う.抗CTLA-4抗体トレメリムマブを投与することで活性化された抗腫瘍T細胞が誘導され,免疫記憶により持続的な抗腫瘍免疫を獲得することができるとされている.そのため,トレメリムマブの投与は単回となっている.トレメリムマブ(商品名:イジュド)の発売日は2023年3月15日であり,2023年3月現在,STRIDEレジメンで治療された症例はごく少数にとどまる.免疫チェックポイント阻害薬に特有の有害事象に注意する必要があるが,効果発現や有害事象の特徴などは今後,症例数の蓄積とともに明らかになってくるものと思われる.
V.肝細胞癌に対する術後補助療法と今後の展望
これまで肝細胞癌に対する術後補助療法の有用性を検証するため,様々な試験が行われてきた.ソラフェニブの有用性を検証したSTORM試験10)が有名であるが,それ以外にもUFT11)などの殺細胞性化学療法の有効性が検証されている.いずれの試験においても術後補助療法の有効性は示せず,肝細胞癌に対する術後補助療法は標準治療として確立されていない.一方,最近では免疫チェックポイント阻害薬を用いた術後補助療法の第Ⅲ相試験が積極的に行われている.ニボルマブの有効性を検証するCheckMate 9DX試験,ペンブロリズマブの有効性を検証するKEYNOTE-937試験,デュルバルマブ・ベバシズマブ併用療法およびデュルバルマブ単剤の有効性を検証するEMERALD-2試験,トリパリマブの有効性を検証するJUPITER04試験,アテゾリズマブ・ベバシズマブ併用療法の有効性を検証するIMbrave050試験,などである.IMbrave050試験の中間解析結果が2023年の米国癌学会で発表され,術後補助療法としてのアテゾリズマブ・ベバシズマブ併用療法が無再発生存期間の延長を達成したことが報告された12).近い将来,他の試験結果も公表されることが予想され,肝細胞癌においても有効な術後補助療法が確立されることが期待される.
VI.おわりに
新規薬物療法の登場により,これまで予後不良であった切除不能肝細胞癌の治療選択肢は増加した.レンバチニブやアテゾリズマブ・ベバシズマブ併用療法は使用例が増加しており,効果発現や有害事象の特色も明らかになってきた.デュルバルマブ・トレメリムマブ併用療法も含め,どのように薬物療法を使い分けていくか,また,これらの薬物療法と肝動脈化学塞栓療法や外科的治療を組み合わせることでさらなる治療成績の改善が得られるか,今後の検討が必要である.術後補助療法については免疫チェックポイント阻害薬を用いた第Ⅲ相試験の結果が待たれるところである.
利益相反:なし
文献
1) Kudo M, Finn RS, Qin S, et al.:Lenva tinib versus sorafenib in firstline treat ment of patients with unresectable hepa tocellular carcinoma: a randomised phase 3 noninferiority trial. Lancet, 391: 1163-1173, 2018.
2) エーザイ:レンビマ製品情報概要.2023年3月31日. https://medical2.eisai.jp/fileviewer/pdf_downloader.php?access_key=6sjihbrmca
3) Kazuya T, Ishigami M, Ito T, et al.: Favorable radiological antitumor response at 2 weeks after starting lenvatinib for patients with advanced hepatocellular carcinoma. Hepatol Res, 50: 374-381, 2020.
4) Tada M, Ichida A, Arita J, et al.:Multicenter prospective study to evaluate the efficacy of lenvatinib to achieve conversion surgery for initially unresectable hepatocellular carcinoma: LENS-HCC trial. J Clin Oncol, 40(4 suppl): 458, 2022.
5) Iwamoto H, Suzuki H, Shimose S, et al.: Weekends-Off Lenvatinib for Unresectable Hepatocellular Carcinoma Improves Therapeutic Response and Tolerability toward Adverse Events. Cancers (Basel), 12(4): 1010, 2020.
6) Toshida K, Itoh S, Yoshizumi T, et al.: Retrospective evaluation of the effect of Ninjin’yoeito in hepatocellular carcinoma patients treated with lenvatinib. Surg Today, 52(3): 441-448, 2022.
7) Finn RS, Qin S, Ikeda M, et al.: Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med, 382: 1894-1905, 2020.
8) Kudo M, Tsuchiya K, Shao YY, et al.: IMbrave150: Exploratory analysis to examine the association between Bevacizumab (bev) ever being skipped and bev never being skipped in patients with unresectable hepatocellular carcinoma treated with Atezolizumab + bev in a global phase Ⅲ study. American Society of Clinical Oncology Gastrointestinal Cancers Symposium. J Clin Oncol, 41 (4 suppl): 538, 2023.
9) Abou-Alfa GK, Lau G, Kudo M, et al.: Tremelimumab plus Durvalumab in unresectable Hepatocellular Carcinoma. NEJM Evid, 1 (8): 2022.
10) Bruix J, Takayama T, Mazzaferro V, et al.: Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Oncol, 16(13): 1344-1354, 2015.
11) Hasegawa K, Takayama T, Ijichi M, et al.: Uracil-tegafur as an adjuvant for hepatocellular carcinoma: a randomized trial. Hepatology, 44(4): 891-895, 2006.
12) Chow P, Chen M, Cheng A, et al.: IMbrave050: Phase 3 study of adjuvant atezolizumab + bevacizumab versus active surveillance in patients with hepatocellular carcinoma at high risk of disease recurrence following resection or ablation. AACR2023 #CT003.
PDFを閲覧するためには Adobe Reader が必要です。