日外会誌. 124(2): 172-176, 2023
特集
糖代謝異常と外科医療
5.胃切除後の血糖変動とその意義
|
京都府立医科大学 消化器外科 窪田 健 , 大辻 英吾 |
胃切除後は晩期ダンピング症候群に代表されるように血糖が大きく変動し,インスリン反応性の低血糖を引き起こすことで知られている.われわれは,持続グルコースモニタリング(CGM,continuous glucose monitoring)を用いて,胃切除後の血糖トレンドを明らかにするための臨床研究を行った.
胃切除患者(幽門側胃切除,胃全摘)にCGMを施行するのと同時にPGSAS(Post-gastrectomy Syndrome Assessment Scale)-37を用いてダンピング症状を,術後1 カ月と1年に調査し,その関係を解析した.その結果,特に胃全摘で血糖変動が大きく,低血糖の頻度は増しており,それは1年が経過しても改善していなかった.また,日中無自覚性低血糖や,就寝中の夜間低血糖を呈している患者が存在することも明らかとなった.血糖変動,低血糖は様々な疾患の予後や,心血管系合併症,認知症のリスクファクターであるとの報告は数多くある.従って胃切除後の血糖変動をコントロールすることは予後の改善に寄与する可能性がある.
胃切除後,外来で患者は時間の経過とともに食事摂取量が増え,QOLが改善しているようにみえるが,血糖変動や無自覚性低血糖が隠れているかもしれないことを念頭に置いて,注意深い問診と継続した栄養療法が必要である.
キーワード
胃癌, 胃切除, ダンピング症候群, 持続グルコースモニタリング, 血糖変動
I.はじめに
胃切除後の晩期ダンピング症候群は古くから知られた胃切除後症候群の一つで,血糖が大きく変動し,インスリン反応性の低血糖を引き起こす.従って患者には分割食を指導し,低血糖症状(倦怠感,冷汗,眠気,震えなど)が出現したらブドウ糖を摂取してもらうようにしている.近年,持続グルコースモニタリング(CGM,continuous glucose monitoring)が糖尿病患者の血糖トレンドの把握に用いられるようになり,糖尿病コントロールには空腹時血糖やHbA1cのみならず,血糖変動や低血糖の頻度にも留意することが求められている.本章では,胃切除患者(幽門側胃切除,胃全摘)にCGMを施行するのと同時にPGSAS(Post-gastrectomy Syndrome Assessment Scale)-37を用いてダンピング症状を調査した結果1)2)をもとに,胃切除後の血糖変動の実態とその意義,そして対策について述べる.
なお,CGMは胃切除後患者には保険適応がないため,本研究は京都府立医科大学・医学倫理審査委員会の承認の下,患者から文書で同意を得て行われている(承認番号ERB-C-975–2).
II.CGMによる血糖管理目標
CGMが広く普及することにより,アメリカ糖尿病学会が2019年,糖尿病患者におけるCGMを用いた血糖管理目標に関するコンセンサスレポートが公表された3).その中で,血糖コントロールの治療目標域(70〜180mg/dL)にある時間的割合(TIR,time in range)を70%以上に,高血糖(>180mg/dL)にある時間的割合(TAR,time above range)を25%未満に,低血糖(<70mg/dL)にある時間的割合(TBR,time below range)を5%未満にすることが提唱された(表1).糖尿病がない,もしくはある程度血糖がコントロールされた胃癌手術患者にこれをそのまま適応できるかどうかは不明であるが,コントロール不良の糖尿病患者の管理目標であることを考慮すると,当然これら目標域を大きく逸脱することはないことが予想された.

III.幽門側胃切除,胃全摘術患者の血糖トレンド
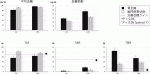
図1に術後1カ月と1年のCGMの結果を示す.平均血糖は幽門側胃切除と胃全摘でさほど変わらず,1年が経過しても大きな変化はなかった(胃全摘82.9±5.3→97.8±3.0 mg/dL,幽門側胃切除93.2±1.5→95.3±1.8 mg/dL).ところが血糖変動の指標である標準偏差は術後1カ月で特に胃全摘で有意に大きく,そしてそれは術後1年が経過してむしろ増悪していることが明らかとなった(胃全摘28.9±2.8→46.8±4.8 mg/dL,幽門側胃切除22.9±0.7→33.2±0.9 mg/dL).また,TIR,TARはおよそ治療目標域内であったが,TBRは特に胃全摘で高く,術後1年が経過しても依然高値で,管理目標を大きく上回っていた(胃全摘42.5±9.4→27.6±5.7%,幽門側胃切除16.1±2.0→18.9±1.5 %).すなわち,胃切除後は血糖変動が大きく,低血糖の頻度は増しており,それは時間が経過しても改善していないことが明らかとなった2).
IV.無自覚性低血糖
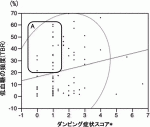
ダンピング症状はインスリン反応性の低血糖と考えられるため,PGSAS-37ダンピング症状スコアと日中(6〜24時)TBRとの相関関係を調査したところ,ダンピング症状スコアと日中TBRに有意な相関は認められなかった(図2).しかしながら注目すべきは,図2内のAの部分,すなわち低血糖が頻繁に起こっているにもかかわらず,低血糖症状を呈していない患者が存在するということである.これは無自覚性低血糖という状態であり,低血糖を繰り返すことにより自律神経が反応しなくなっている(低血糖関連自律神経応答障害)と考えらえる4).
(補足解説)PGSAS-37は「胃癌術後評価を考える」ワーキンググループにおいて策定されたもので,胃切除を受けた患者の自覚症状(食道逆流,腹痛,食事関連愁訴,便秘,ダンピングなど)や生活状況(食事,体重,身体活動など)を評価する胃切除に特化した調査票である.本項で解析に用いているダンピング症状スコアは値が高いと症状が強いことを示している.
V.夜間低血糖
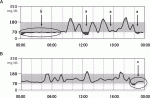
図3Aに胃全摘術後患者の代表的な血糖の日内変動曲線を示す.典型的なダンピング(矢印a)が起こっているのがわかる.また,夜間に持続する低血糖(矢印b)が起こっていることも見て取れる.夜間低血糖が起こると寝汗や歯軋り,悪夢,起床時の倦怠感などの症状が出ることがあるが特異的ではなく,また,患者のみならず医療者もそれを夜間低血糖とは認識していないことが多いため,広い意味で無自覚性低血糖と言ってもよいのかもしれない.一方,図3Bも胃全摘患者であるが,同様にダンピングが起こってはいるが,自然に低血糖が回復しているのがわかる(矢印c).これは低血糖に対する生体反応であり,低血糖に対するカウンターレギュレーションが働いているからである.この図3Bの患者は退院後,外来栄養指導を毎回受け,分割食を継続,間食に栄養剤を摂取していた患者である.従って夜間低血糖が起こっている患者は,慢性的な低栄養から体内(主に肝臓)グリコーゲン貯留が少なくなっており,解糖系や糖新生といった低血糖に対するカウンターレギュレーションが働いていないと考えられる.
VI.血糖変動,低血糖は心血管系合併症,認知症のリスクファクター
血糖変動や低血糖は様々な疾患の予後や,心血管系合併症のリスクファクターであるとの報告は多くある5).Suらは,多変量解析の結果から血糖変動は喫煙や年齢と同等のcoronary artery diseaseのリスクファクターであると述べている6).また,夜間低血糖は不整脈の発生頻度を上昇させることも確認されている7).さらに,低血糖は認知症のリスクファクターとの報告もある8).胃癌患者の多くが高齢者であることを考慮すると,特に血糖変動が大きい胃全摘についてはその適応や周術期管理について慎重になる必要があるのかもしれない.今回われわれの研究で用いたコホートでは追跡期間が短いため,心血管イベントの発症は調査できていないが,心血管イベントのリスクスコアであるFramingham cardiovascular risk scoreとの相関関係を解析したところ,低血糖よりは血糖変動で強い相関を認めた9).従って胃切除後の血糖変動をコントロールすることは予後の改善に寄与する可能性がある.
VII.おわりに
ダンピングは古くから知られている胃切除後症候群の一つであるが,CGMの出現によって明らかとなった胃切除後の血糖変動,そして無自覚性低血糖について述べた.胃切除後,外来で患者は時間の経過とともに食事摂取量が増え,QOLが改善しているようにみえるが,血糖変動や無自覚性低血糖が隠れているかもしれないことを念頭に置いて,注意深い問診と継続した栄養療法が必要であると考える.
利益相反:なし
文献
1) Kubota T, Shoda K, Ushigome E, et al.:Utility of continuous glucose monitoring following gastrectomy. Gastric Cancer, 23: 699-706, 2020.
2) Kubota T, Yubakami M, Ushigome E, et al.:Persistent postgastrectomy hypoglycemia unawareness in patients with gastric cancer unveiled by a prospective study. Ann Surg Open, 3:e135, 2022.
3) Battelino T, Danne T, Bergenstal RM, et al.:Clinical Targets for Continuous Glucose Monitoring Data Interpretation:Recommendations From the International Consensus on Time in Range. Diabetes Care, 42: 1593-1603, 2019.
4) Cryer PE:Mechanisms of hypoglycemia-associated autonomic failure in diabetes. N Engl J Med, 369: 362-372, 2013.
5) International Hypoglycaemia Study Group:Hypoglycaemia, cardiovascular disease, and mortality in diabetes:epidemiology, pathogenesis, and management. Lancet Diabetes Endocrinol, 7: 385-396, 2019.
6) Su G, Mi S, Tao H, et al.:Association of glycemic variability and the presence and severity of coronary artery disease in patients with type 2 diabetes. Cardiovasc Diabetol, 10: 19, 2011.
7) Chow E, Bernjak A, Williams S, et al.:Risk of cardiac arrhythmias during hypoglycemia in patients with type 2 diabetes and cardiovascular risk. Diabetes, 63: 1738-1747, 2014.
8) Whitmer RA, Karter AJ, Yaffe K, et al.:Hypoglycemic episodes and risk of dementia in older patients with type 2 diabetes mellitus. JAMA, 301: 1565-1572, 2009.
9) Shibamoto J, Kubota T, Ohashi T, et al.:Glucose variability and predicted cardiovascular risk after gastrectomy. Surg Today, 52:1634-1644, 2022.
PDFを閲覧するためには Adobe Reader が必要です。