日外会誌. 123(5): 421-428, 2022
特集
低侵襲膵切除術の進歩
8.ロボット支援下膵体尾部切除
|
順天堂大学 肝胆膵外科 三瀬 祥弘 , 齋浦 明夫 |
ロボット支援下膵体尾部切除(Distal pancreatectomy, DP),膵頭十二指腸切除が2020年4月より保険適応となった.精緻な鉗子の動きにより,従来は低侵襲手術(Minimally Invasive Surgery, MIS)が困難だった膵癌症例にも,適応を拡大できる可能性がある.
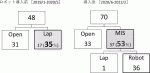
順天堂医院では,2020年6月からロボット膵切除を導入した.ロボット手術の技術向上を目指し,MISの適応となる膵切除は全てロボット支援下で行う方針としている.ロボット導入前は,DPのMIS施行率は35%であったが,ロボット導入後,53%に上昇した.MIS DPにおける膵癌症例の割合も,18%から53%と大幅に上昇した.
ロボットDPに関する研究では,安全面で従来の手法と遜色なく,腹腔鏡手術とくらべMIS完遂率が高いことが示されている.今後,ロボット手術が膵癌症例の長期予後にどう影響を及ぼすか,検証が必要である.
キーワード
ロボット支援下手術, 膵体尾部切除, 低侵襲手術, 膵癌
I.はじめに
高難度とされる膵切除にも,低侵襲手術が適応されてきた.膵体尾部切除(Distal pancreatectomy, DP)に関しては,2012年に腹腔鏡下手術,2020年にはロボット支援下手術が保険収載された.
当院では,肝胆膵領域のロボット手術を推進するために,低侵襲手術の適応となる膵切除は全てロボット支援下で行う方針としている.2022年3月までに50例を超えるロボット支援下膵切除を経験し,特にDPに関しては,手技を定型化し行っている.
本稿では,ロボット支援下DP(RDP)に関するエビデンスを簡単にまとめ,当院におけるRDPの手技を解説する.
II.RDPの歴史とエビデンス
2002年,米国のMelvinらによって1例目のRDPが報告された.2003年には,Giulianottiらが5例のRDPを報告し,その手術時間中央値は270分(210~360分),合併症率20%,手術死亡なし,と良好な成績であった.米国のNational databaseを用いた調査では,膵腫瘍に対するDPのうち,ロボットで行われる割合が,2010年には4%であったのに対し,2016年には16%まで上昇している.RDPを施行する施設も,2010年には全米で45施設であったが,2016年には154施設まで増えている.
本邦では,2020年4月に膵頭十二指腸切除術(Pancreatoduodenectomy, PD)とともにRDPが保険収載された.表1に保険診療を行うための施設基準と,日本肝胆膵外科学会と日本内視鏡外科学会からの導入に際する指針を示す.要点は,「腹腔鏡下PDまたはDPを5例以上経験した医師が常勤」し,「膵切除を年間20例以上行っている」ことである.ロボット支援下PD(RPD)の要件である「膵切除年間50例以上」と比較してハードルは低い.すでに400台を超えるロボットが導入され,世界2位のロボット保有国であるわが国で,今後RDPを行う施設が増えることが予想される.安全性と施行状況のモニターが必須であり,現在,全例術前登録が義務づけられている.
・開腹手術との比較
開腹DP(ODP)とRDPの手術成績について,米国のビッグデータ(ACS-NSQIP)を用いて解析がされている1).2014年にODP:921例,RDP:200例が施行され,RDPはODPより手術時間が長かったが(243分 vs 222分),在院日数は短く(5日 vs 7日),合併症頻度が少なかった(37% vs 45%).2,264症例を対象とした七つの研究のMeta-analysisでは,RDPはODPより出血量や術後死亡率が低く,在院日数も少ない,という結果であった.手術時間,リンパ節郭清個数,R0切除率は両群に差を認めなかった2).219例の良性・低悪性病変を対象としたPropensity-score matching(PSM)解析では,RDPで手術時間が短く,出血量が少なく,術後感染症合併率が低い,という結果であった.本解析では,RDPのほうが木村法によるspleen-preserving DP施行率が高い,という結果も報告されている3).
・腹腔鏡下手術との比較
前述のACS-NSQIPを用いた解析では,LDP:694例とRDP:200例の比較も行われている1).RDPではLDPよりも手術時間が長かったが(243分 vs 205分),開腹移行率が低かった(8% vs 16%).合併症頻度や術後在院日数には差を認めなかった.3,112症例を対象とした20の研究のMeta-analysisでも,RDPのほうがLDPよりも手術時間は長いが,開腹移行率は低い,という結果であった4).欧州の21のHigh-volume centersのPSM解析では,同様にRDPでLDPよりも手術時間が長く(285分 vs 240分),開腹移行率が低く(6.7% vs 15.2%),かつ企図したspleen-preservingの完遂率が高い(81.4% vs 64.2%),と報告されている5).
得られるエビデンスからは,LDPと比べてRDPでは手術時間が長くなるが,内視鏡手術の完遂率が高いことがわかる.現時点までに,ODP,LDPと比較したRDPのランダム化試験は行われていない.また,RDPが膵癌の予後に及ぼす影響に関しては,検証されていない.胃癌の領域では,「進行癌に対する開腹・腹腔鏡下幽門側胃切除の長期成績に差がない」というエビデンスが得られた6).同様の質の高い研究が,低侵襲膵切除の領域でも望まれる.

III.順天堂医院におけるRDP
当院では,2020年6月に最初のRDPを施行した.導入に先がけ,ロボット膵切除を先行して行う国内外の施設でRPDを見学した.RDPを3例経験した後,最初のRPDを2020年9月に行った.膵切除では,低侵襲手術の適応となる症例は全てロボット支援下で行う方針としている.膵癌に関しては,・脾動脈に近接しない,・上腸間膜静脈浸潤なし,・上腹部開腹歴がない症例をRDPの適応としている.腫瘍の後方進展の程度によって,anterior/posterior radical antegrade modular pancreatosplenectomy(RAMPS)の適応としている.
図1にロボット膵切除導入前後のDP施行状況を示す.導入前は低侵襲手術の割合が35%であったが,導入後は53%まで上昇している.他臓器同時手術となった1例でのみ,LDPを行った.表2に導入前後の手術短期成績をまとめた.RDP導入により,膵癌に対する低侵襲DPの適応が18%から53%に拡大したことがわかる.それに伴い,LPDに比べ,手術時間は延長し,出血量は増加している.膵癌に対するRAMPSで1例,出血制御のために開腹手術に移行した.
・RDPの手順
体位は開脚仰臥位,Head-up 10°,左上10°としている.マジックベッドを使用し,右側で側腹部,頭部の2ヶ所を側板で固定する.術中に脾動脈根部が膵に埋もれて処理しづらい場合,頭高位を15°まであげる.デバイスはVessel Sealerを使用し,組織の剥離・離断はdouble bipolar methodsで行っている.spleen-preservingの際には,脾静脈の小枝を処理するためにVessel Sealerの代わりにSynchrosealを用いる.
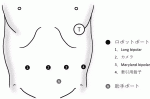
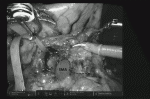
1.ポート挿入(図2)
臍からバルーン付きポートを挿入する.臍右に一つ,臍左に二つほぼ一直線にロボット用ポートを挿入する.ステープラーによる膵切離を想定して,左下腹部に助手用12mmポートを挿入する.肝円索を直針で釣り上げたのち,剣状突起からネイサンソン鉤を挿入し,肝外側区域を牽引する.
2.ドッキング
体位変換後,左頭側からロールインする.臍ポートからPort-in-portでロボットカメラを挿入し,脾門をターゲットとする.
3.大網切離,脾下極剥離
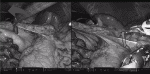
網嚢を解放し,左側に大網切離を進め,脾下極に迫る.この際,4番アームで胃を腹側右側に牽引することで,脾臓・膵尾部が浮く(図3).
4.胃脾間膜切離,脾上極剥離
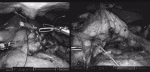
Vessel Sealerを用いて胃脾間膜を切離する.角度が決まらない場合は,1番にVessel Sealerを持ちかえる.胃・脾臓間にスペースがなく脾上極にアプローチしづらい場合,膵体部側を先に剥離するとスペースが得られる.脾上極を尾側に向かって剥離する(図4).3と4の操作で脾臓・膵尾部を十分剥離しておく7).
5.胃吊り上げ
大網を右側に剥離したのち,胃前庭部・体部後壁を直針を用いて腹壁に固定する.4番アームで左胃動静脈を腹側に牽引する.
6.脾動脈処理
総肝動脈尾側をなるべく右側から剥離し,脾動脈根部を確認する.脾動脈の処理を行う前に,左側で膵体尾部を尾側に剥離しておくと,脾動脈を長く露出しやすくなる.トンネリングに備え,膵上縁で門脈を露出し可及的に尾側に剥離する.
RDPでは助手による膵の尾側牽引が難しい.脾動脈根部へのアプローチが難しい場合,頭高位をあげて重力で膵を転がす.それでも難しい場合,膵下縁からアプローチを試みる.
7.膵下縁剥離
膵下縁を剥離し,門脈を露出して膵の離断予定部でテーピングする.膵を離断すると,膵体尾部・脾臓が左側・背側に落ち込んで剥離操作が難しくなるので,3,4の操作と合わせて,膵離断前に左側の剥離を完了しておく.
8.膵離断
ポリグリコール酸(PGA)シートを装着したステープラーを用い,10分かけて膵を離断する.
9.脾静脈処理
脾静脈を切離したのち,残りの膵体部を剥離して標本をバッグに回収する.膵液ろう予防のため,ロールアウト前に膵断端にさらにPGAシートを貼付し,人工のりを塗布している.
10.ロールアウト
ロールアウト後,臍の創を延長して標本を摘出する.同部は閉創し,再気腹後に膵断端から左横隔膜下に向け,ドレーンを挿入する.挿入孔は,ポート挿入部にこだわらず,良い位置に留置できるよう,新しい孔を開けることを厭わない.
・Spleen-preserving DPのコツ
脾動静脈を温存する木村法で行っている.上記4,5は行わないが,脾臓を温存する際にも上記3で脾下極・膵尾部を十分授動しておくと,脾門で膵を脈管から剥離する操作が容易になる.
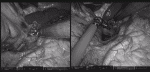
膵をテーピングした綿テープにエンドループをかけ,糸を体外に誘導する.合わせて4番アームで膵尾部を展開することで,脾静脈の剥離が容易になる(図5).脾静脈剥離中の出血に備え,脾動脈をクランプできるようにあらかじめテーピングしておく.
・RAMPSのコツ
上記3の操作の際,脾下極でGerota筋膜の背側に入り,腎を露出する.この深度で頭側,右側へと可及的に剥離しておくことで,膵体部から尾部に剥離を進める際のゴールが設定できる.
門脈直上で膵をテーピングし,spleen-preservingの際と同様に体外に牽引する.この操作によって,SMA腹側が展開され,SMA腹側から左側への剥離,左腎静脈の露出が行いやすくなる(図6).
ロボット手術では,腹腔鏡手術と異なり助手のサポートが難しい.Console surgeon単独の操作で,質の高い手術が行えるよう,体位や体外誘導などを工夫して行っている.

IV.おわりに
RDPに関するエビデンスをまとめ,当科で行っているRDP手順を解説した.LDPよりも精緻な操作が可能であり,進行膵癌に対しても根治性を損なわない手術が行えると実感している.
今後の課題は,RDPを行った膵癌症例の長期成績の検証である.「低侵襲DPのメリットは,術後早期のみで,2年経つと患者QOLは開腹手術と変わらない」というランダム化比較試験の付随報告もされた8).「病気を治す」という手術の本質に,ロボット技術がどのように貢献できるのか,今後さらに検証する必要がある.
利益相反:なし
文献
1) Xourafas D, Ashley SW, Clancy TE: Comparison of Perioperative Outcomes between Open, Laparoscopic, and Robotic Distal Pancreatectomy:an Analysis of 1815 Patients from the ACS-NSQIP Procedure-Targeted Pancreatectomy Database. J Gastrointest Surg, 21(9): 1442-1452, 2017.
2) Zhou J, Lv Z, Zou H, et al.: Up-to-date comparison of robotic-assisted versus open distal pancreatectomy:A PRISMA-compliant meta-analysis. Medicine, 99(23):e20435, 2020.
3) Weng Y, Jin J, Huo Z, et al.: Robotic-assisted versus open distal pancreatectomy for benign and low-grade malignant pancreatic tumors:a propensity score-matched study. Surg Endosc, 35(5): 2255-2264, 2021.
4) Kamarajah SK, Sutandi N, Robinson SR, et al.: Robotic versus conventional laparoscopic distal pancreatic resection:a systematic review and meta-analysis. HPB (Oxford), 21(9): 1107-1118, 2019.
5) Lof S, van der Heijde N, Abuawwad M, et al.: Robotic versus laparoscopic distal pancreatectomy:multicentre analysis. Br J Surg, 108(2): 188-195, 2021.
6) Huang C, Liu H, Hu Y, et al.: Laparoscopic vs Open Distal Gastrectomy for Locally Advanced Gastric Cancer: Five-Year Outcomes From the CLASS-01 Randomized Clinical Trial. JAMA Surg, 157(1): 9-17, 2022.
7) Nagakawa Y, Sahara Y, Hosokawa Y, et al.: The Straightened Splenic Vessels Method Improves Surgical Outcomes of Laparoscopic Distal Pancreatectomy. Dig Surg, 34(4): 289-297, 2017.
8) Korrel M, Roelofs A, van Hilst J, et al.: Long-Term Quality of Life after Minimally Invasive vs Open Distal Pancreatectomy in the LEOPARD Randomized Trial. J Am Coll Surg, 233(6): 730-739. e9, 2021.
PDFを閲覧するためには Adobe Reader が必要です。