日外会誌. 123(3): 247-254, 2022
特集
本邦の大腸癌治療の現状と展望―海外における標準治療と比較して
6.直腸癌に対するWatch and Waitアプローチ
|
公益財団法人がん研究会有明病院消化器センター 大腸外科 秋吉 高志 , 向井 俊貴 , 日吉 幸晴 , 長嵜 寿矢 , 山口 智弘 , 福長 洋介 |
下部直腸癌に対する標準治療は本邦では直腸間膜全切除(TME)+側方郭清であるが,TME後は永久人工造設や排便障害等により患者のQOLは低下する.欧米では進行直腸癌に対して術前化学放射線療法(CRT)が広く行われてきたが,近年CRTの前後に術前全身化学療法を行うtotal neoadjuvant therapyが普及し,治療後に臨床的完全奏効(cCR)が得られる症例が増加している.cCRに対しすぐにTMEを行わずに綿密なサーベイランスを行い,局所再増大した場合はすぐに救済手術を行うWatch and Waitアプローチが直腸温存と患者のQOL向上を可能にするアプローチとして欧米を中心にその存在感が増してきている.一方,cCRの判定に統一された再現性のある基準はなく一定数の局所再増大は避けられない.局所再増大症例の切除遅延による腫瘍学的リスクを最小限にするためにも,適切な時期に救済手術が施行される必要がある.CRTが標準治療として確立していない本邦においては適切な臨床導入が望まれる.
キーワード
進行直腸癌, 術前化学放射線療法, total neoadjuvant therapy, Watch & Wait, 臨床的完全奏効
I.はじめに
日本の大腸癌治療ガイドラインでは,腫瘍下縁が腹膜翻転部にかかる下部進行直腸癌(T3/T4)に対しては直腸間膜全切除(total mesorectal excision;TME)+側方リンパ節郭清が標準治療とされている.一方,欧米ではTMEに術前化学放射線療法(chemoradiotherapy;CRT)を加えることが標準治療とされており,側方郭清はほとんど行われてない.側方郭清という武器を持った本邦では,術前CRTを行わなくともTME+側方郭清で十分良好な局所制御が得られるとの考えから,術前CRTは多くの施設で積極的に行われてこなかった.一方で,側方郭清,術前CRTともに遠隔再発率抑制や生存率向上を示すには至らず,TMEによる永久人工肛門造設や排便障害,排尿性機能障害によるQOLの低下は,たとえがんが根治したとしても,患者にとっては一生涯続く大きな障害となりうる1).
術前CRTにより15%前後の症例では病理学的完全奏効(pathological complete response;pCR)が得られるが,pCR症例の予後は非常に良好であることが報告されている2).また,術前CRTに加え術前に全身化学療法を行うtotal neoadjuvant therapy(TNT)により,pCR率は30%前後にまで上昇することが報告されている3).一方でpCR症例では直腸壁および間膜内に癌は存在しないため,TMEは過大治療であると考えられ,TMEを回避することでTMEに伴う合併症の回避やQOLの向上が期待できる.pCRを術前に完全に予測することはできないが,臨床的に完全奏効(clinical complete response:cCR)と考えられる症例に対しTMEを回避し局所再増大の有無の綿密なサーベイランスを行うことで直腸温存を狙うWatch and Wait(WW)アプローチが治療選択肢の一つとして欧米を中心にその存在感が増してきている.本稿では直腸癌に対するWWアプローチについて概説する.
II.Watch and Waitアプローチの基本コンセプト
内視鏡やMRIなどの現存するモダリティーでは微小な癌の遺残までは診断できないため,cCRと診断しても実際はpCRではなく局所に癌が遺残しており,局所再増大(local regrowth)をきたす症例が一定数存在することは避けられない.しかし,仮に局所再増大をきたしたとしてもサーベイランスの過程で遅延なく発見されれば高率に救済(サルベージ)手術が可能であり,CRT後すぐにTMEを行うのと比較し予後に大きな悪影響がないのであれば,WWアプローチは直腸温存を希望する患者にとって非常に魅力的なオプションになりうる.WW後のサルベージ可能な局所再増大はTME後の骨盤内局所再発やサルベージ不能な局所再増大などのいわゆる「再発」とは区別する必要がある.WWは直腸切断術や括約筋間直腸切除術が必要な症例など,直腸診で腫瘍を十分に触知できる肛門に近接した腫瘍が最もよい適応であると考えられる.また,巨大な腫瘍,全周性の腫瘍,深い潰瘍を伴う腫瘍などは,CRT後に直腸の変形を伴うことが多く,正確な内視鏡診断が困難であるため,WWのあまりよい適応ではない.
III.Watch and Waitアプローチの治療成績
WWアプローチのまとまった治療成績は2004年にHabr-Gamaらによってはじめて報告された4).Habr-Gamaらは下部直腸癌に対し術前CRTを施行した265例を解析し,cCRと診断した71例(26.8%)にWWを実施した.その結果WW施行群の5年全生存率(OS),5年無再発生存率(DFS)はそれぞれ100%,92%と,TME後のpCR症例(22例;5年OS:88%,5年DFS:83%)と同等(あるいはそれ以上)であった.またWW71例のうち局所再増大を2例に認めたが,救済手術が可能であった.局所再増大率が2.8%と極めて低値であるが,これはCRT終了後少なくとも1年間cCRを維持した症例をWW群と定義しているためと考えられる.
その後欧米を中心に多くのWWアプローチの治療成績が報告されており,代表的な報告を表1に示す5)
~
10).cCR率は11%~78%と大きなばらつきがあるが,CRTのレジメンやcT2率が報告により異なること,後方視的研究やレジストリ研究における母集団の選択バイアスなどが原因として考えられる.WW症例の局所再増大率は5%~31%,救済手術率は68%~100%とこちらも報告にばらつきがあるが,遠隔再発率は0~9%と概ね10%以下との報告が多い.15カ国47施設から登録された国際レジストリ研究(International Watch & Wait Database:IWWD)9)がWWにて治療されたコホートとしては最大の報告である.cCRと判定された880例の2年局所再増大率は25.2%,遠隔転移率は8%,5年OSは85%,5年疾患特異的生存率は94%であった.また,局所再増大の88%は最初の2年間に診断され,局所再増大の97%は管腔内に認めた.局所再増大後の手術治療の詳細が明らかな148例のうち,46例(31%)は局所切除を施行され,うち13例はその後TMEを施行された.最終的に115例(78%)でTMEが施行され,うちR0切除は101例(88%)であった.一方,局所再増大症例では遠隔再発を18%に認め(5年OS:75%),cCRを維持した症例の遠隔再発率:5%,5年OS:88%に比べて不良であった.局所再増大症例はもともと局所に癌が遺残していた症例であるため,cCRを維持した症例(≒pCR)と比較し遠隔成績が不良であること自体は当然とも思われるが,WWアプローチの問題点として,局所再増大症例の遠隔再発率や生存率が,すぐにTMEを行った場合と比べ悪くなるリスクがないとはいえないことである.局所再増大症例の遠隔成績がimmediate TMEを行ったnon-pCR症例と比べ特に不良であることを示すデータはないが,ESMOガイドライン11)にも“a small increased oncological risk of uncontrolled pelvic and metastatic disease exists”と記載されている.現時点ではWWアプローチは症例選択に十分な経験を持ち,サーベイランスを適切に行える専門施設で施行されるべきと考えられる.

IV.Watch and Waitアプローチ後のQOL
WWアプロ―チ後のQOLをEORTC QLQ-CR29を用いて経時的に調査した報告では,cCRを維持した症例の患者報告アウトカム(patient reported outcome)は治療前と比較して悪化することなく安定しており,5年経過観察した20例では,便失禁(fecal incontinence)や夜間の排便回数が非常に多いとの報告は1例もなく,13%が日中の排便回数が非常に多いと報告した12).WW症例とTME症例の排便機能をMSK-BFIを用いて比較した後方視的研究では,WW症例ではdiet,frequency,urgency/soilage,overall score全てにおいてTME症例よりも良好であった13).一方,WW症例とTME症例を比較した別の後方視的研究では,WW症例はTME症例に比べ排便障害や排尿性機能障害が少なかったものの,WW症例の1/3は重度(major)直腸低位前方切除症候群(low anterior resection syndrome;LARS)を認めたと報告されている(TME症例では67%)14).
V.治療レジメン
最近,短期放射線(5×5 Gy)+強化化学療法(CAPOX 6コースあるいはFOLFOX4 9コース),いわゆるTNTが通常のCRTと比較し疾患特異的治療不成功(disease-related treatment failure)を有意に改善し(23.7% vs 30.4%),pCRも有意に改善した(28% vs 14%)とするRAPIDO試験の結果が報告された15)が,これまでのWWアプローチに関する報告の多くはCRTが用いられており,短期放射線のWWアプローチにおける有用性は不明な点が多く,最初からWWを念頭に置いてレジメンを選択する場合はCRTを選択する方がよいと考えられる.TNT後のWWに関する前向き試験のデータは現時点でほとんどないが,2020年のASCOでTNT+WWの前向き第Ⅱ相試験であるOPRA Trial(NCT02008656)の中間解析の結果が報告された16).OPRA Trialは二つの異なるTNTレジメン(術前CRTに加えて導入化学療法としてFOLFOX/CAPOX4カ月あるいは強化化学療法としてFOLFOX/CAPOX4カ月)にランダム化し,cCRあるいはnear cCRに対してはWWを行うTNT+WWに関する初の前向き第Ⅱ相試験である.Preliminaryな結果ではあるが,3年TME回避率は導入化学療法群に比べ強化化学療法群で有意に高く(43% vs 59%),3年無再発生存率は両群間で有意差はなかった(77% vs 78%).現時点では,CRT+強化化学療法が最もWWアプローチの恩恵を受ける可能性が高いレジメンであると考えられる.
VI.治療効果判定
WWアプローチの成功のために正確なcCR症例の同定は非常に重要なステップであるが,現時点では統一された治療効果判定基準はなく,非常に難しいと感じるステップでもある.
CRT終了から効果判定までの期間の長さとpCR率は相関することが知られており17),最終効果判定まではCRT終了から少なくとも8週の待機期間を置くことが望ましい.Habr-Gamaらは,直腸診で壁不整・腫瘤・潰瘍・狭窄のいずれも認めないこと,内視鏡で潰瘍・腫瘤・狭窄のいずれも認めず,粘膜の白色瘢痕や毛細血管拡張を認めることをcCRの基準としている17).
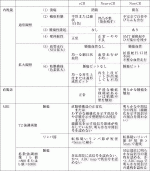
治療効果は直腸診・内視鏡・MRIの三つを組み合わせて総合的に判定する.先述のOPRA試験では表2に示す基準で効果判定を行い,cCRあるいはnear cCRと判定された症例がWWの対象となっている18).一方,non CRと判定されても,15%はpCRであったとの報告もある19).特にCRT終了から効果判定までの期間が比較的短い症例ではnon CRでも縮小の過程をみている可能性があり,さらに待機期間を設けることでcCRが得られる場合もあると考えられるが,WWの基準を緩くすると局所再増大率が上昇することが懸念されるため,特にWWの経験の浅いうちは対象を広げすぎることには慎重であるべきと考えられる.
がん研有明病院では色素拡大観察による腫瘍性ピットの有無やnarrow band imagingによる不整な腫瘍性血管の有無を効果判定基準に取り入れ,その有用性を報告してきた20).当院における効果判定基準を表3に示す.
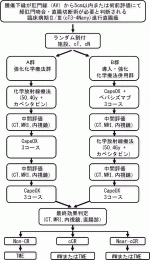
近年,進行直腸癌に対するTNT+WWの前向き試験が先述のOPRA試験,TRIGGER試験21),CAO/ARO/AIO-16など世界中で行われており,今後WWに関する質の高い前向きデータが蓄積されてくると考えられる.一方,CRTがガイドラインで推奨されていない本邦では,CRTおよびWWに関する十分な経験を持った施設は少なく,そのためWWのまとまったデータはほとんどないのが現状である.そこでがん研有明病院では,腫瘍の下縁が肛門縁から5cm以内または術前評価にて経肛門吻合・直腸切断術が必要と判断される臨床病期Ⅱ/Ⅲ(cT3-4Nany)進行直腸癌患者を対象に,「CRT+強化化学療法+手術またはcCR/near-cCRに対するWW」および「CRT+導入・強化化学療法併用+手術またはcCR/near-cCRに対するWW」をランダム化選択デザインにて比較し,有効性と安全性を評価するNOMINATE試験を開始した(図1).プライマリーエンドポイントは「pCR+2年以上cCRを維持した症例の割合」とし,66名の患者登録を予定している.表3の効果判定基準に従いcCR,near-cCRを判定し,セカンダリーエンドポイントとしてcCR率,near-cCR率,WW率,局所再増大率などを評価する.

VII.おわりに
WWアプローチは永久人工肛門や排便障害を避けたいと願う患者にとっては非常に魅力的なオプションではあるが,頻回のサーベイランスの必要性や腫瘍学的リスクを十分患者に説明の上行う必要がある.また,本邦では手術治療が優先されてきた歴史的経緯から,術前CRTやその後の効果判定,WWに十分な経験を持った外科医,放射線治療医,画像診断医,内視鏡診断医からなるmultidisciplinary teamは少ないと考えられ,WWの安全な普及のためには慎重な導入が望まれる.
利益相反:なし
文献
1) Pieniowski EHA, Nordenvall C, Palmer G, et al.: Prevalence of low anterior resection syndrome and impact on quality of life after rectal cancer surgery:population-based study. BJS open, 4: 935-942, 2020.
2) Maas M, Nelemans PJ, Valentini V, et al.: Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer:a pooled analysis of individual patient data. Lancet Oncol, 11: 835-844, 2010.
3) Petrelli F, Trevisan F, Cabiddu M, et al.: Total Neoadjuvant Therapy in Rectal Cancer:A Systematic Review and Meta-analysis of Treatment Outcomes. Ann Surg, 271: 440-448, 2020.
4) Habr-Gama A, Perez RO, Nadalin W, et al.: Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy:long-term results. Ann Surg, 240: 711-717, 2004.
5) Habr-Gama A, Gama-Rodrigues J, São Julião GP, et al.: Local recurrence after complete clinical response and watch and wait in rectal cancer after neoadjuvant chemoradiation:impact of salvage therapy on local disease control. Int J Radiat Oncol Biol Phys, 88: 822-828, 2014.
6) Maas M, Beets-Tan RG, Lambregts DM, et al.: Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol, 29: 4633-4640, 2011.
7) Appelt AL, Pløen J, Harling H, et al.: High-dose chemoradiotherapy and watchful waiting for distal rectal cancer:a prospective observational study. Lancet Oncol, 16: 919-927, 2015.
8) Renehan AG, Malcomson L, Emsley R, et al.: Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project):a propensity-score matched cohort analysis. Lancet Oncol, 17: 174-183, 2016.
9) van der Valk MJM, Hilling DE, Bastiaannet E, et al.: Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD):an international multicentre registry study. Lancet, 391: 2537-2545, 2018.
10) Smith JJ, Strombom P, Chow OS, et al.: Assessment of a Watch-and-Wait Strategy for Rectal Cancer in Patients With a Complete Response After Neoadjuvant Therapy. JAMA Oncol, 5:e185896, 2019.
11) Glynne-Jones R, Wyrwicz L, Tiret E, et al.: Rectal cancer:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 28(suppl_4):iv22-iv40,2017.
12) Dizdarevic E, Frøstrup Hansen T, Pløen J, et al.: Long-Term Patient-Reported Outcomes After High-Dose Chemoradiation Therapy for Nonsurgical Management of Distal Rectal Cancer. Int J Radiat Oncol Biol Phys, 106: 556-563, 2020.
13) Quezada-Diaz FF, Smith JJ, Jimenez-Rodriguez RM, et al.: Patient-Reported Bowel Function in Patients With Rectal Cancer Managed by a Watch-and-Wait Strategy After Neoadjuvant Therapy:A Case-Control Study. Dis Colon Rectum, 63: 897-902, 2020.
14) Hupkens BJP, Martens MH, Stoot JH, et al.: Quality of Life in Rectal Cancer Patients After Chemoradiation:Watch-and-Wait Policy Versus Standard Resection - A Matched-Controlled Study. Dis Colon Rectum, 60: 1032-1040, 2017.
15) Bahadoer RR, Dijkstra EA, van Etten B, et al.: Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO):a randomised, open-label, phase 3 trial. Lancet Oncol, 22: 29-42, 2021.
16) Garcia-Aguilar J, Patil S, Kim JK, et al.: Preliminary results of the organ preservation of rectal adenocarcinoma (OPRA) trial. J Clin Oncol, 38(15_suppl): 4008, 2020.
17) Habr-Gama A, São Julião GP, Perez RO: Nonoperative management of rectal cancer:identifying the ideal patients. Hematol Oncol Clin North Am, 29: 135-151, 2015.
18) Smith JJ, Chow OS, Gollub MJ, et al.: Organ Preservation in Rectal Adenocarcinoma:a phase II randomized controlled trial evaluating 3-year disease-free survival in patients with locally advanced rectal cancer treated with chemoradiation plus induction or consolidation chemotherapy, and total mesorectal excision or nonoperative management. BMC Cancer, 15: 767, 2015.
19) Maas M, Lambregts DM, Nelemans PJ, et al.: Assessment of Clinical Complete Response After Chemoradiation for Rectal Cancer with Digital Rectal Examination, Endoscopy, and MRI:Selection for Organ-Saving Treatment. Ann Surg Oncol, 22: 3873-3880, 2015.
20) Ishioka M, Chino A, Ide D, et al.: Adding Narrow-Band Imaging to Chromoendoscopy for the Evaluation of Tumor Response to Neoadjuvant Therapy in Rectal Cancer. Dis Colon Rectum, 64: 53-59, 2021.
21) Battersby NJ, Dattani M, Rao S, et al.: A rectal cancer feasibility study with an embedded phase III trial design assessing magnetic resonance tumour regression grade (mrTRG) as a novel biomarker to stratify management by good and poor response to chemoradiotherapy (TRIGGER):study protocol for a randomised controlled trial. Trials, 18: 394, 2017.
PDFを閲覧するためには Adobe Reader が必要です。