日外会誌. 122(5): 476-483, 2021
特集
大動脈弁疾患に対する外科的治療の現況
7.TAV in SAV導入後の大動脈弁再手術の治療戦略
|
大阪大学 低侵襲循環器医療学 倉谷 徹 |
外科生体弁を用いた大動脈弁置換術後,生体弁機能不全を来した症例に対して,これまで再弁置換術(redo-SAVR)が行われてきた.しかしTAVI主流の時代の中,新しい術式として外科生体弁にTAVIを行うTAV in SAVが導入された.この術式は,低侵襲手術のためredo-SAVRに比較して,早期,中期成績が良好であり,TAV in SAVの方が入院および手術費用を安く行えることが示唆された.ただこの術式は狭小外科生体弁に対しては,圧格差が残り成績が不良であるとともに,TAVI弁の耐久年数が不明であり,また適応制限を十分考えなくてはいけない術式と思われる.まだTAVIデバイス自体が外科生体弁のように完成されてない状況で,外科医はSAVR,TAVI両術式を術者として行えるスキルを習得し,その上で患者にとって最良の治療戦略を行えるようになることが,将来の弁膜症治療にとって極めて重要なことである.
キーワード
TAVI, 大動脈弁再手術, TAV in SAV, TAV in TAV
I.はじめに
大動脈弁狭窄症に対する経カテーテル的大動脈弁植込み術(Transcatheter aortic valve implantation(TAVI))は,低侵襲手術としてまず大動脈弁置換術困難やハイリスク症例に対して導入され,全世界的にその症例数を拡大してきた.またこの数年間にintermediate riskさらにはlow risk症例まで適応拡大が進んでいるが,術後1年の成績だけでAVRに対する非劣性もしくは有用性を証明したとされる報告が散見されるが,遠隔期成績を重要視するわれわれ外科医にとって,時期尚早ではないかと言わざるを得ない.
一方,平均余命が延長し続けている現状で,外科的生体弁の耐久年数は当然ながら限界がある.そのため再弁置換術が必要なるわけであるが,再開胸手術は癒着などによる煩雑さのため,再手術年齢が高いにもかかわらず,手術侵襲度はさらに高くなる.このような高齢者患者に対しては,低侵襲手術は導入を検討される余地がある.
そこで,その低侵襲手術として大動脈弁置換術後の生体弁機能障害に対する経カテーテル的大動脈弁植込み術(TAV in SAV)が保険適用となったが,この術式についてその適応と限界について検討するとともに,弁膜症治療における今後の外科医の立ち位置について言及する.
II.TAV in SAVとは
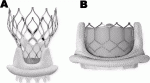
外科医にとって再手術は,手術自体が初回手術と比べて侵襲度が高く,さらに術後合併症も多くなる.特に再人工弁置換術は患者の年齢も高くなり,あまりやりたくない手術の一つである.2002年にTAVIがAlan Cribierによって世界に導入されてから1),当然の方向性として外科的生体弁に対するTAVI,つまりTAV in SAVという術式が考案された.この術式は,外科的生体弁による大動脈弁置換術後,弁機能不全となり再弁置換術が必要な場合,それをTAVI弁にて行う術式である.本邦においてはEvolut R(Medtronic Inc., Minneapolis, MN, USA)が2018年7月に,Sapien 3(Edwards Lifesciences, Irvine, CA, USA)が2020年1月に保険適用となった(図1).現在,使用可能施設は限定的であるが,今後使用症例および施設は拡大すると考えられる.
III.TAV in SAVの成績
TAV in SAVの成績に関しては,すでに多くの論文が報告している.STS/ACC registryを用いTAV in SAV(n=1,150)とnative valveに対するTAVI(n=2,259)の早期成績を比較した論文では,30日死亡率(2.9% vs. 4.8%),脳卒中(1.7% vs. 3.0%),心不全による入院(2.4% vs. 4.6%)が,通常のTAVIと比較してTAV in SAV群で有意に低かった.またPropensity score matching解析を行っても同様にTAV in SAVの優位性が示された.しかしTAV in SAV群の患者はTAVI後の圧較差が高かったが(16 vs. 9mm Hg;p < 0.001),中等度または重度の大動脈弁閉鎖不全症は少なかった(3.5% vs 6.6%,p<0.001).TAVI後の圧較差は,小さなもしくは高度狭窄した外科生体弁で高かった2).TAV in SAVの安全性は証明されたが圧較差は問題であり,特に小さな外科弁では圧格差が大きくなる.そのことから考えてsupra-annular typeのTAVI弁の方がいいと考えられる.
Self-Expanding deviceを用いた23施設,202名TAV in SAVの1年成績の報告では3),平均年齢79.9歳で,患者の41.8%は21mmの外科生体弁を使用していた.大動脈弁の圧格差は,術前35.0±16.3 mm Hgから退院時17.5±8.5 mm Hgまでに顕著に改善している.30日死亡率は2.5%,脳梗塞はなく,急性腎障害は0.5%,ペースメーカーの新規植込み率は8.0%であった.1年後の死亡率は8.8%であり,5人の患者(2.5%)が冠動脈の閉塞を経験した.そのうち3名は手術中に,1名は手術直後に,1名は数カ月後に冠動脈閉塞を起こした.早期成績では圧較差においても良好な成績を得ているが,冠動脈閉塞は通常のTAVIと比べても起こりやすい合併症である.
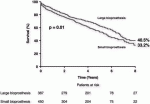
さて弁の長期成績を含めたTAV in SAVの遠隔期成績はどうなのか?5年以上前に行われた大動脈TAV in SAV手術1,006例,平均年齢77.7±9.7歳,男性58.8%,STS 7.3%を対象とした報告がある4).内訳はメドトロニック社製の自己拡張型弁(n = 523, 52.0%),エドワーズバルーン拡張型弁(n = 435, 43.2%).その他のデバイス(n=48,4.8%)であった.8年後の生存率は,図のように外科弁内径(ID)≦20mmの患者は,内径(ID)>20mmの患者に比べて低かった(33.2% vs. 40.5%, P = 0.01)(図2).死亡率の独立因子には,外科人工弁が小さいことおよびalternative approachであった.外科生体弁のサイズは,長期的な死亡率に影響を与える可能性があり,年齢から考えて再手術としてTAV in SAVを考慮する場合,初回外科手術(SAVR)は,できるだけ大きいサイズの弁を挿入する必要があると考えられる.
IV.無理矢理のTAV in SAV(fractureやBASILICA)
Valve-in-Valve International Data Registryの大規模研究により,21mm以下の外科生体弁にTAV in SAVを行うと,1年死亡率が2倍になることが示された5).このような狭小弁に対してかなり無謀であるがvalve fractureという方法が考案された.この方法は高圧バルーンを用いて弁座部分の金属を破壊する新しい技術である.小さな生体弁に対しても弁開口部の面積が改善され,圧較差が減少する可能性がある6)
7).初期の報告でも弁座部分がfractureしたときに,急激に膨張圧が低下し,しばしばスナップ音を伴ったなどと恐ろしい記載もあるが,平均経弁圧較差は減少し,弁の有効弁口面積も拡大したが明らかな合併症は報告されていない.
最近エドワーズからINSPIRIS RESILIA大動脈弁が保険償還された.この生体弁の大きな特徴は低圧バルーンにて弁輪のfractureが可能であるとのことである.しかし容易にfractureできるのなら,TAV in SAV時,特に同一会社であるエドワーズのバルーン拡張型TAVI弁でTAV in SAVを行った場合,容易にvalve fractureが生じてしまい,TAVI弁サイズ選択が逆に困難になるのではと危惧される.このままではこの弁に対するTAV in TAVには同社のTAVI弁は使えないなどという皮肉な話になる可能性がある(お節介すぎる話ではあるが).
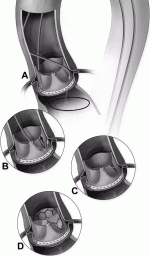
またTAV in SAVでは,冠動脈閉塞が通常のTAVIに比べて3〜4倍多く発生し,VIVID(Valve-in-Valve International Data)レジストリーでは3.5%と報告されている8).閉塞のリスクを高める解剖学的要因としては,冠動脈が低い位置にあること,valsalvaが狭いこと,そして弁尖の高さが高いこと,外巻き弁であることなどがある.そこでリスクの高い患者の冠動脈閉塞を予防するために,生体大動脈弁自体を意図的にカットする手法として BASILICA法が報告されている9).Wireに電気通電させ冠動脈口付近の弁をカットするわけであるが(図3),ハイリスク,手術困難症例へのTAV in SAVでは,意義のある手技と思うが,通常の症例に対しては外科的再弁置換術を選択すべき手ある.
V.TAV in SAVとredo AVRの比較検討
TAV in SAV自体の成績が良好であるなら,外科医としてはredo-SAVRとの比較が興味ある点である.2010年から2019年の間に,外科的生体弁不全に対して,単独のTAV in SAVまたはredo-SAVRで治療を受けた患者をpropensity score matchingを用いて比較検討した報告がある10).4,327名の患者の中matchingにて717人の患者で検討された.TAV in SAVは,30日時点で,全死亡,全脳卒中,心筋梗塞,大出血の発生率がredo-SAVRに比し低かった.また観察期間(中央値516日)では,心血管死,全死亡,脳卒中,心筋梗塞,心不全による再入院は2群間で差がなかった.以上によりTAV in SAVはredo SAVRと比較して,短期的には良好な結果が得られることが確認されたが,長期成績では二つの治療法に違いはなかった.
またカナダにおいてpropensity score matchingにて TAV in SAV(n=214)とredo SAVR(n=344)を術後5年間の追跡調査を行っている11).主な結果は以下の通りである.
1)周術期の死亡率はTAV in SAVで有意に低かった.2)術後合併症の発生率は,ペースメーカーの植え込み,輸血,入院期間,術後合併症発生率もTAV in SAVで有意に低かった.3)TAV in SAVでは5年後も全生存率が改善していた(76.8% vs. 66.8%).3)は単純に初期の死亡率が低いので5年後の生存率もよくなったと考えられるであろう.つまり手術成績にすべて影響されているといえる.
STS Adult Cardiac Surgery Databaseの2011年から2013年までの解析結果によると,redo-SAVRの死亡率は4.6%で,5人に1人において主要な病的・死亡的イベントを認めた.またSTSが予測したredo-SAVR死亡率は5.4%であり,初回の大動脈弁置換術では2.7%であった12).つまり初回弁膜症の手術を受けた患者に比べて予測死亡率が高いと推定される.このように再手術のリスクが高い中,TAV in SAVの安全性がredo-SAVRより高いとの報告によりTAV in SAVはredo-SAVRのalternative procedureとなる可能性が高い.ただ解剖学的に前述の通り21mm以下の外科生体弁へのTAV in SAVは圧較差が残る.本邦において21mm弁の使用は非常に高いので,弁輪拡大も考慮して大きな生体弁を初回手術で使用することを検討する必要があると思う.前述したとおり,私的にはvalve fractureを行ってまでTAVI弁を挿入することに対しては,その安全性と成績が明らかでない現状ですべきではないと考える.今後TAVI弁の圧格差軽減のデバイス改良が積極的に進むことを切に望む.
VI.TAV in SAVとredo-SAVRの入院,手術費用の比較
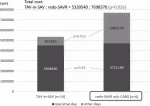
現在の保険医療ひっ迫の状況下で両術式の手術,入院費用の比較は重要である.これは本邦のみで検討する必要があるため(保険制度が各国で違う),大阪大学の症例を用いて検討を行った.当科前田孝一医師の検討では,グラフのように術中の費用はほぼ同じであった(SAVRの輸血などの費用がかんでいる)が,術後の諸費用においては有意にredo-SAVRの方が高かった.当然合計でもredo-SAVRが有意に高額であった(図4).症例数が少なく今後さらなる検討は必要であるが,この症例数でこの有意な差が明らかになったのは驚きである.初回のTAVIとSAVRの費用比較は以前に行ったが,TAVIデバイスが極めて高額であり,術中ではTAVIが有意に高額であった.術後SAVRの方が高額であったが,全体的には現在のデバイス価格ではTAVI治療の方が高額であった.しかし今回の結果を見ると,TAV in SAVの方が安価で,かつ低侵襲であることから費用対効果は,TAV in SAVに有利であることが示唆された.
VII.TAVI in TAVI
TAVIがこれほど普及した中,長寿国の本邦ではTAVIデバイスに対するTAVIを考慮せざるを得ない.このTAV in TAVの保険適応はlow riskに対する保険適用が検討される前に,考慮されるべきであったと思う.またTAVI弁の耐久性に関する確かなデータでは8年ぐらいかと考えられている中,TAV in TAVがTAVI後の弁機能不全に対する治療において重要な戦略となる13)
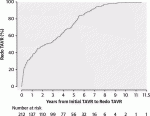
14).63,876例のTAVR手術のうち,212例の連続したredo-TAVR手術における検討では,74件は初回のTAVRから1年以内,138件は1年以上経過している(図5).早期に機能不全が生じる症例があることが分かるのと,やはりTAVI弁の耐久年数としては8年程度であることがこの図からも分かる.1年後の追跡調査では,TAV in TAV後の圧格差は12.9±9.0mmHg,弁面積は1.51±0.57cm2であった.術後の合併症脳卒中3例[1.4%],弁の位置異常7例[3.3%],冠動脈閉塞2例[0.9%],永久ペースメーカー20例[9.6%].術後30日の生存率は94.6%であった15).以上よりRedo-TAVRはTAVR後に弁機能障害を有する患者にとって比較的安全で効果的な選択肢である.これらの結果は,TAVI弁の耐久性が懸念される寿命の長い患者にTAVIを適用する上で重要である.長期成績は必要であるが,TAVIの若年化,low riskへの導入を考える上で,非常に重要な術式と考える.
VIII.おわりに
TAV in SAVは,今後外科生体弁機能不全に対して第一選択手術になる可能性があると思われる.ただそのためにはTAVI弁の耐久年数を明確にする必要があると同時に,TAV in TAVの手技も早々に導入する必要がある.以上のような治療戦略が構築できれば,抗凝固療法を強く考慮しなくてはならない機械弁を使う機会がさらに減少させることができるのではないかと思われる.
今後,外科医として以下の2点を十分に検討する必要がある.一つは,外科医としてこれまで半世紀の間行われてきたSAVRを,TAVIが導入されたからと言って,外科医自らTAVIに譲る必要はない.遠隔期成績を含め,あらゆる観点からSAVRを検討してきたわれわれ外科医としてTAVI主流の流れの中,外科医がTAVI治療を行わず,SAVRに固守することは,どんどん手術できる機会を減らし,自分で自分の首を絞めることになる.外科医がSAVRとTAVIの両方の手技を持ち,再手術も考慮した治療戦略を構築できるようにすることが極めて肝要であると考え,これからの外科医に切に希望する.
利益相反:
奨学(奨励)寄附金:日本メドトロニック株式会社,エドワーズライフサイエンス株式会社
文献
1) Cribier A , Eltchaninoff H , Leon MB , et al.: MDPercutaneous Transcatheter Implantation of an Aortic Valve Prosthesis for Calcific Aortic Stenosis First Human Case Description. Circulation, 106: 3006-3008, 2002.
2) Tuzcu EM , Kapadia SR , Svensson LG , et al.: Transcatheter Aortic Valve Replacement of Failed Surgically Implanted Bioprostheses. The STS/ACC Registry. J Am Coll Cardiol, 72: 370–382, 2018.
3) Tchétché D , Chevalier B , Holzhey D , et al.: TAVR for Failed Surgical Aortic Bioprostheses Using a Self-Expanding Device. 1-Year Results From the Prospective VIVA Postmarket Study. J Am Coll Cardiol Intv, 12: 923–932, 2019.
4) Bleiziffer S , Simonato M , Webb JG , et al.: Long-term outcomes after transcatheter aortic valve implantation in failed bioprosthetic valves. Eur Heart J, 41: 2731–2742, 2020.
5) Dvir D , Webb JG , Bleiziffer S , et al.: Transcatheter aortic valve implantation in failed bioprosthetic surgical valves. JAMA, 312: 162, 2014.
6) Chhatriwalla AK , Allen KB , Saxon JT , et al.: Bioprosthetic valve fracture improves the hemodynamic results of valve-in-valve transcatheter aortic valve replacement. Circ Cardiovasc Interv, 10:e005216, 2017.
7) Allen KB , Chhatriwalla AK , Cohen DJ , et al.: Bioprosthetic valve fracture to facilitate transcatheter valve-in-valve implantation. Ann Thorac Surg, 104: 1501–1508, 2017.
8) Dvir D , Leipsic J , Blanke P , et al.: Coronary obstruction in transcatheter aortic valve-in-valve implantation: preprocedural evaluation, device selection, protection, and treatment. Circ Cardiovasc Interv, 8:e002079, 2015.
9) Khan JM , Dvir D , Greenbaum AB , et al.: Transcatheter laceration of aortic leaflets to prevent coronary obstruction during transcatheter aortic valve replacement: concept to first-in-human. J Am Coll Cardiol Intv, 11: 677–689, 2018.
10) Deharo P , Bisson A , Herbert J , at al.: Transcatheter Valve-in-Valve Aortic Valve Replacement as an Alternative to Surgical Re-Replacement. J Am Coll Cardiol, 76: 489–499, 2020.
11) Tam DY , Dharma C , Rocha RV , et al.: Transcatheter ViV Versus Redo Surgical AVR for the Management of Failed Biological Prosthesis. Early and Late Outcomes in a Propensity-Matched Cohort. J Am Coll Cardiol Intv, 13: 765–774, 2020.
12) Kaneko T , Vassileva CM , Englum B , et al.: Contemporary outcomes of repeat aortic valve replacement: a benchmark for transcatheter valve-in-valve procedures. Ann Thorac Surg, 100: 1298–1304, 2015.
13) Mack MJ , Leon MB , Smith CR , et al.: 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1):a randomised controlled trial. Lancet, 385: 2477–2484, 2015.
14) Vemulapalli S , Holmes DR Jr , Dai D , et al.: Valve hemodynamic deterioration and cardiovascular outcomes in TAVR: a report from the STS/ ACC TVT registry. Am Heart J, 195: 1–13, 2018.
15) Landes U , Webb JG , Backer OD , et al.: Repeat Transcatheter Aortic Valve Replacement for Transcatheter Prosthesis Dysfunction. J Am Coll Cardiol, 75: 1882–1893, 2020.
PDFを閲覧するためには Adobe Reader が必要です。