日外会誌. 122(5): 456-461, 2021
特集
大動脈弁疾患に対する外科的治療の現況
4.狭小弁輪への対応
|
熊本大学病院 心臓血管外科 高木 淳 , 西川 幸作 , 吉永 隆 , 岡本 健 , 福井 寿啓 |
本邦では近年,人口の高齢化に伴い加齢による大動脈弁狭窄症(AS)の症例が増加しているが,欧米に比べ体格の小さい患者が多い本邦では大動脈弁輪径の小さい狭小弁輪症例が多い.ASに対する外科的大動脈弁置換術(SAVR)における問題の一つに術後の患者-人工弁不均衡(patient-prosthesis mismatch:PPM)の発生があるが,狭小弁輪症例においては至適サイズの人工弁を植え込むことが難しい場合や,最小径の人工弁が入らない場合も多く,PPMの発生がより問題となってくる.PPMは術後に高い圧較差を残し,SAVR後の遠隔成績を悪化させる因子である.術前の弁輪径から術後PPMの発生が懸念される症例では,それを回避すべく,術後の有効弁口面積を広く取れる外巻き生体弁の使用や,単結節縫合による人工弁の植え込み,大動脈弁輪拡大術の併施などを考慮する必要がある.
キーワード
大動脈弁狭窄症, 狭小弁輪, Patient-prosthesis mismatch
I.はじめに
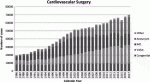
2017年に発表された日本胸部外科学会の年次報告によると,本邦における心臓弁膜症手術の症例数は年々増加の一途をたどっている(図1)1).その理由の一つとして,人口の高齢化に伴い,加齢による大動脈弁弁尖の硬化変性を病因とする大動脈弁狭窄症(AS)が増加していることが挙げられる.欧米諸国と比較して体格の小さい患者の多い本邦では,必然的に大動脈弁輪径の小さい,狭小弁輪症例の割合が高くなる.ASに対する根治的治療として,外科的大動脈弁置換術(SAVR)が長らく標準治療として行われてきたが,狭小弁輪症例に対するSAVRにおいては,患者の体格に見合った有効弁口面積(EOA)が得られない,いわゆる患者-人工弁不均衡(patient-prosthesis mismatch:PPM)の発生が問題となる.PPMを回避することは,SAVRの早期・遠隔成績の向上のために不可欠であり,種々の治療法が報告されている.本稿では,狭小弁輪症例におけるPPMを回避するための外科的治療戦略について述べたい.
II.狭小弁輪の定義
狭小弁輪について,ガイドライン等で明文化された定義はないものの,従来,狭小弁輪は①大動脈弁輪径21mm以下あるいは②術後PPMの発生が予想される大動脈弁輪径,とされてきた.近年では,小口径人工弁の登場により,弁輪径に関しては,既存の最小の人工弁が入らない,もしくは弁輪径19mm以下とするのが一般的である.なお,近年の海外の文献では大動脈弁輪径が20mm以下のものを狭小弁輪と定義しているものが多く,SAVRと経カテーテル大動脈弁置換術(TAVR)を比較した大規模無作為試験であるPARTNER試験においても,弁輪径20mm未満を狭小弁輪としている2).しかしながら,これらの文献と本邦におけるAS症例とは体格が異なっており,同様の定義を本邦の症例に適応すべきかについては議論の余地がある.
III.狭小弁輪と術後PPM
SAVR術後のPPMは,患者の体格に比して人工弁のサイズが生理的に小さいことにより,術後に圧較差が異常高値を示す状態3)とされる.2000年Pibarotらは,術後のEOAを患者の体表面積(BSA)で除した有効弁口面積係数(EOAI)が0.85cm2/m2以下の症例では,術後臨床症状の改善が得られにくく,左室肥大の改善や長期生存に悪影響を及ぼすことを報告した4).現在ではEOAIが0.85cm2/m2以下のものをPPMと定義し,SAVRにおいては,このPPMを回避すべくEOAI>0.85cm2/m2が人工弁の選択基準の一つとなっている.
狭小弁輪症例においては,EOAI>0.85cm2/m2を満たす十分なサイズの人工弁の植え込みが困難な場合があり,弁輪径の大きい症例に比べてPPMが発生しやすいと言える.また,市販されている現行の生体弁で最も小さなサイズのものは19mmであるが,そもそも19mmの生体弁を植え込むことが困難な症例も存在するため,PPMを回避するためには,狭小弁輪症例に適した人工弁・手術手技を用いる必要がある.
IV.人工弁の選択
現在市販されている人工弁は,外径がより小さい割により大きなEOAを有するデザインのものが多いため,従来の人工弁に比べ十分なEOAを有する人工弁を留置することは難しくない.なお,前述の如く,市販されている現行の生体弁で最も小さいサイズは19mmであるが,メドトロニック社のAvalusには17mmのサイズが存在し,臨床使用が開始されつつあり,狭小弁輪症例における応用が期待される.また,2012年より本邦で臨床使用が開始されたTrifecta(セント・ジュード・メディカル社)は,ウシ心嚢膜をステントポストの外側に固定することで,より大きなEOAを得られる構造になっており,PPMの回避に有用と考えられる.実際に,Ugurらは,TrifectaがMagna(エドワーズライフサイエンス社)に比べ,術後のEOAIが有意に大きく,またEOAI<0.60cm2/m2と定義される重度PPMの発生も有意に少なかったことを報告している5).しかしながら一方で,TrifectaがMagna Easeに比べ,構造的劣化(SVD)による再置換を要する頻度が高いことも報告されており6),長期成績についてはさらなる研究の結果が待たれる.また,一般に生体弁は同径の機械弁に比べてEOAが小さいため,最小口径の生体弁を植え込むことができない場合には,機械弁のhigh performance valveを用いることも選択肢の一つである.
V.狭小弁輪症例に対する手術手技
1.縫着術式
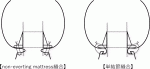
SAVRにおける人工弁の縫着術式には,①everting mattress縫合,②non-everting mattress縫合,③単結節縫合の3種類がある7).everting mattress縫合では,縫合糸を大動脈側から左室側にかけるため,術者が縫合糸を確認しやすいというメリットがある一方,人工弁が弁輪内(intra-annular position)に固定されるため,患者本来の弁口に比して,やや小さい人工弁を選択せざるを得ないというデメリットがある.non-everting mattress縫合では,縫合糸を左室側から大動脈側にかけることで人工弁を弁輪上に固定(supra-annular position)できるため,弁輪内に固定する場合に比べ,大きめの人工弁を選択することができる.しかしながら,いずれの方法でもmattress縫合では,弁輪に対して水平方向に縫合糸をかけるため,弁輪を縫縮する方向に力が働く.このため,縫合糸をかける前に通過したサイザーが糸をかけた後には通過しない,という現象にしばしば遭遇する.一方,単結節縫合では,縫合糸を弁輪に対して放射状にかけるため,弁輪を縫縮することなく患者本来の弁口を損なうことのない人工弁を植え込むことができる.また,non-everting mattress縫合では,弁輪部の余剰組織(remnant)が弁下部に張り出してくるため左室流出路での血流障害を引き起こすことが懸念されるが,単結節縫合では余剰組織は人工弁のソーイングカフと弁輪との縫合内に巻き込まれる形になるため左室流出路での血流障害を引き起こすことなく,かつ人工弁のEOAを最大限に活かすことができる(図2).Tabataらは,19mmないし21mmの小口径生体弁を用いたSAVRにおいて,単結節縫合を用いた場合,non-everting mattress縫合に比べて術後のEOAIが大きく,PPMの発生が少なかったことを報告している8).よって,狭小弁輪症例に対するSAVRにおいて,患者本来の弁口を損なうことなく,人工弁のEOAを最大限に活かすには,単結節縫合を用いることが望ましいと言える.しかし,単結節縫合の欠点は,糸数が多く結紮する回数が増えることと,強く結紮すると弁輪をカッティングしてしまう可能性があることである.そのため単結節縫合の糸を結紮する際にはmattress縫合糸よりも若干弱めに結紮する必要がある.
2.弁輪拡大術
近年,人工弁の性能向上に伴い頻度は低くなったものの,上記の縫着術式ではEOAI>0.85cm2/m2を確保できる人工弁を植え込むことができない場合や,そもそも最小口径の人工弁を縫着できないほどの狭小弁輪症例に対しては,弁輪拡大術の併施を考慮する必要がある.
弁輪拡大術には後方拡大法であるNicks法9)とManouguian法10),および前方拡大法であるKonno法11)がある(図3).Nicks法は,大動脈切開を左・無冠尖の交連からやや無冠尖側から弁間線維三角に延長し,切開部にパッチをあてて大動脈弁輪を拡大する方法で,Manouguian法は,大動脈切開を左・無冠尖の交連部から弁間線維三角に進めた切開を,左房上壁の一部と僧帽弁前尖に延長し,左房切開部と僧帽弁前尖にパッチをあてて大動脈弁輪を拡大する方法である.一般にNicks法は1サイズ,Manouguian法は2サイズアップの人工弁留置が可能である.一方,Konno法は,大動脈を縦切開し,切開線を右冠尖の左・右冠尖の交連部寄りに延長し,弁輪,心室中隔に切開を加えるとともに,右室前壁にも切開をおく方法である.後方拡大に比べ,弁輪の拡大効果は大きいが,ここまでの弁輪拡大を要する症例は稀である.われわれは,高齢者で19mm生体弁が通常の方法で挿入できない場合,19mm以下の機械弁を選択するよりNicks法などの弁輪拡大術を行って生体弁を挿入するほうが患者のQOLには良いと考えている.

VI.経カテーテル大動脈弁置換術(TAVR)
2013年より,本邦においてもASに対するTAVRが保険適応となり超高齢者やfrailtyの高い症例を中心に盛んに行われるようになった.その症例数は2017年の時点で既に年間6,000例を越え,現在ではその適応も拡大してきており急速に普及していると言える.TAVRの詳細については他の章に譲るが,TAVRで使用されている生体弁はSAVRに用いられるものと異なり,ソーイングカフをもたず,ステント部分が薄い人工弁が用いられるため,SAVRに比べ術後EOAIが大きく,PPMの発生率が低いとされる12).現在のところ外科的リスクの高い症例が主な対象となっているが,今後は狭小弁輪症例に対するTAVRの適応も拡大していくものと思われる.
VII.おわりに
狭小弁輪症例における外科的治療戦略について述べた.高齢化が進む本邦では,今後もAS症例の増加が予想されるが,欧米に比べ体格の小さい患者の多い本邦では,狭小弁輪症例に遭遇する頻度も比較的高く,SAVRを行う上で,術後PPMの回避は重要な課題である.今後はTAVRの適応拡大により,狭小弁輪症例に対するSAVRの症例数は減少することも予想されるが,患者の体格を考慮した至適EOAの人工弁選択や,より大きな人工弁を植え込むための単結節縫合の使用や弁輪拡大術は,狭小弁輪症例に対するSAVRを行うにあたり,考慮すべき手術戦略であると考えられる.
利益相反:なし
文献
1) Shimizu H , Okada M , Tangoku A , et al.: Thoracic and cardiovascular surgeries in Japan during 2017:Annual report by the Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg, 68: 414-449, 2020.
2) Pibarot P , Weissman NJ , Stewart WJ , et al.: Incidence and sequelae of prosthesis patient mismatch in transcatheter versus surgical valve replacement in high-risk patients with severe aortic stenosis:a PARTNER trial cohort-A analysis. J Am Coll Cardiol, 64: 1323-1334, 2014.
3) Rahimtoola SH : The problem of valve prosthesis-patient mismatch. Circulation, 58: 20-24, 1978.
4) Pibarot P , Dumesnil JG : Hemodynamic and clinical impact of prosthesis-patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol, 36: 1131-1141, 2000.
5) Ugur M , Suri RM , Daly RC , et al.: Comparison of early hemodynamic performance of 3 aortic valve bioprostheses. J Thorac Cardiovasc Surg, 148: 1940-1946, 2014.
6) Biancari F , Valtola A , Juvonen T , et al.: Trifecta versus Perimount Magna Ease aortic valve prostheses. Ann Thorac Surg, 110: 879-888, 2020.
7) 日本循環器学会/日本胸部外科学会/日本血管外科学会/日本心臓血管外科学会合同ガイドライン.弁膜症治療のガイドライン(2020年改訂版).2020.
8) Tabata M , Shibayama K , Watanabe H , et al.: Simple interrupted suturing increases valve performance after aortic valve replacement with a small supra-annular bioprosthesis. J Thorac Cardiovasc Surg, 147: 321-325, 2014.
9) Nicks R , Cartmill T , Bernstein L : Hypoplasia of the aortic root. The problem of aortic valve replacement. Thorax, 25: 339-346, 1970.
10) Manouguian S , Seybold-Epting W : Patch enlargement of the aortic valve ring by extending the aortic incision into the anterior mitral leaflet. New operative technique. J Thorac Cardiovasc Surg, 78: 402-412, 1979.
11) Konno S , Imai Y , Iida Y , et al.: A new method for prosthetic valve replacement in congenital aortic stenosis associated with hypoplasia of the aortic valve ring. J Thorac Cardiovasc Surg, 70: 909-917, 1975.
12) Takagi H , Umemoto T : Prosthesis-patient mismatch after transcatheter aortic valve implantation. Ann Thorac Surg, 101: 872-880, 2016.
PDFを閲覧するためには Adobe Reader が必要です。