日外会誌. 122(1): 32-37, 2021
特集
肺・胸腺神経内分泌腫瘍の治療
5.大細胞神経内分泌癌の治療
|
東邦大学医学部 外科学講座呼吸器外科学分野 佐野 厚 , 伊豫田 明 |
肺大細胞神経内分泌癌は神経内分泌腫瘍の一つであり,非小細胞肺癌と比較して予後は不良である.治療選択についても腺癌や扁平上皮癌とは異なる.
切除可能な病期の場合には根治切除の対象となる.標準術式は肺葉切除とリンパ節郭清であり,積極的縮小手術の対象とはならない.根治切除後には病理病期ⅠA期であっても術後補助化学療法が有効である.術後補助化学療法には小細胞肺癌のレジメンが有効との報告が多い.定位放射線治療は手術と比較して治療効果は低く,手術に適さない例にのみ対象とすべきである.
進行・再発例に対する化学療法は非小細胞肺癌のレジメンと小細胞肺癌のレジメンの両方が選択肢となる.頻度は低いがEGFR遺伝子変異やALK融合遺伝子を検出した例では,EGFRチロシンキナーゼ阻害剤・ALK阻害剤の有効例が報告されている.免疫チェックポイント阻害剤についても一定の有効例が報告されている.
キーワード
肺大細胞神経内分泌癌, 化学療法, 手術, 補助化学療法
I.はじめに
肺大細胞神経内分泌癌(Large cell neuroendocrine carcinoma-以下LCNEC)はWHO分類第3版(1999年)で肺大細胞癌の一亜型として定義づけられた.WHO分類第4版(2015年)では神経内分泌腫瘍の一つとして分類され,小細胞癌と同じカテゴリーに変更された.肺癌取扱い規約第8版(2017年)でもWHO分類第4版に準拠し,上皮性腫瘍の中の神経内分泌腫瘍の一つとしてLCNECが分類されている.治療方針についても,かつては非小細胞肺癌として治療が行われていたが,小細胞肺癌で使われる化学療法のレジメンの有効性が報告されるなど腺癌や扁平上皮癌とは異なった治療が有効であることがわかってきた1).
日本胸部外科学会の学術調査によると2017年の本邦での原発性肺癌手術例44,563例のうち肺LCNECに対する手術例は601例(1.3%)のみである2).肺LCNECは頻度が低いことから大規模臨床試験が行われず,肺癌診療ガイドラインでも現在のところ肺LCNECの治療方針については記載されていない.
本稿では肺LCNECの治療について,外科治療・放射線治療から薬物療法までを総説する.
II.外科治療
腺癌や扁平上皮癌と同様に肺LCNECでも手術が唯一の根治的治療である.従って臨床病期Ⅰ期からⅡ期の肺LCNECでは手術を行うことが勧められ,ⅢA期については集学的治療グループで検討を行うべきと考えられる.小細胞肺癌では外科治療の対象となるのは臨床病期ⅠからⅡA期であるが,肺LCNECでは現在までのところ小細胞肺癌と同様の適応とすべきという報告はなく,Ⅲ期まで含めた手術例の成績が報告がされている.非小細胞肺癌と同様にⅠ期からⅢA期が手術の対象となりうると考えて良いであろう.
術式については非小細胞肺癌と同様に肺葉切除とリンパ節郭清が標準とされる.小型肺腺癌のような縮小手術の対象となりうるかについてはLutfiが病理病期ⅠA期の肺LCNECに対する肺葉切除と縮小手術(肺区域切除・肺楔状切除)の長期予後をプロペンシティスコアマッチングを用いて比較したデータを報告している3).この報告によると肺葉切除群の5年生存率60.3%に対して縮小手術群の5年生存率は41.5%であり,縮小手術群は肺葉切除群と比較して有意に長期予後が劣っているため,肺LCNECでは早期であっても肺葉切除を行うべきと結論づけている.従って,肺LCNECは積極的縮小手術の対象とはならず,可能な限り肺葉切除・リンパ節郭清を行うべきと考えられる.
III.術後補助化学療法
非小細胞肺癌では腫瘍全体径2cmを超える病理病期ⅠA~ⅡA期でテガフール・ウラシル配合剤の術後補助化学療法の適応となり,病理病期Ⅱ~ⅢA期ではシスプラチン併用化学療法による術後補助化学療法の適応となる.小細胞肺癌では手術後も化学療法を行うことが推奨されている.
肺LCNECは腺癌や扁平上皮癌と比較すると切除後の予後は悪く,肺LCNECでも根治切除後の予後を改善する手段として術後補助化学療法の有効性が報告されている.
2001年にretrospective studyにおいてⅠ期肺LCNECに対する術後補助化学療法の有効性が示された4).その後も術後補助化学療法を行った群が行わない群に対して良好な予後を示すという報告がされている(表1)5)
~
11).
術後補助化学療法の有効性を前向きに検討した報告では,小細胞肺癌のレジメンであるシスプラチンとVP-16を用い,対照群(historical control)と比較して有意に生存率および無再発生存率が良好であった5).使用するレジメンについては小細胞肺癌のレジメンと非小細胞肺癌のレジメンを用いた術後補助化学療法の比較で,小細胞肺癌のレジメンを用いた方が予後は良好であったと報告されている6).
以上のことから,肺LCNECではⅠ期を含めて小細胞肺癌のレジメンを用いた術後補助化学療法が勧められている12).

IV.放射線治療
Loによって肺LCNECに対する手術と体幹部定位放射線治療の比較が報告されている13).National Cancer Databaseの症例での比較であるが,プロペンシティスコアマッチングを用いた解析で手術群の平均生存期間は57カ月,体幹部定位放射線治療群の平均生存期間は35カ月で有意に手術群の生存期間が長かった.そのため肺LCNECに対する体幹部定位放射線治療は手術適応でない例のみが対象になるとしている.
Caoは放射線治療の肺LCNECの予後に与える影響についてSurveillance, Epidemiology, and End Results(SEER)datasetから1,480例の肺LCNECのデータをプロペンシティスコアマッチングを用いて解析している14).多変量解析で放射線治療の施行が独立した予後良好な因子であった.サブグループ解析では,Ⅱ期およびⅢ期,非手術群,化学療法を行った群,腫瘍径が5~10cmの群で放射線治療施行群が放射線治療非施行群と比較して有意に予後が良好であった.
肺LCNECは頻度の低さから大規模比較試験が行えないため,放射線治療についてもエビデンスレベルの高い報告はない.これまでの報告から切除可能例では放射線治療は手術より治療効果は劣る一方で,Ⅱ,Ⅲ期例や非切除例などで放射線治療によって予後延長の効果がみられるというのが現在の知見である.切除可能例では手術を優先するが,手術に適さない例では放射線治療も治療選択肢としていくのが良いであろう.
V.進行・再発例に対する化学療法
従来,肺LCNECは非小細胞肺癌に分類され,治療薬の選択も非小細胞肺癌と同様に行われていた.しかしながら,本邦を含めて小細胞肺癌のレジメンの有効性も報告されている.肺癌診療ガイドラインには肺LCNECのレジメンの選択についての記載はないが,American Society of Clinical OncologyのClinical Practice Guidelineでは肺LCNECには非小細胞肺癌のレジメンもしくは白金製剤+VP-16をファーストラインとして行うことを推奨している.非小細胞肺癌・小細胞肺癌いずれのレジメンも肺LCNECでは治療選択肢となる.
VI.分子標的治療薬
進行・再発非小細胞肺癌ではepidermal growth factor receptor(EGFR)遺伝子変異やanaplastic lymphoma kinase(ALK)融合遺伝子などのドライバー遺伝子変異/転座の有無を治療前に検索し,陽性であった場合にはそれぞれに対するキナーゼ阻害剤を一次治療として用いる.肺LCNECについても少数例であるがドライバー遺伝子について報告されている.
肺LCNECでEGFR遺伝子変異が陽性となる症例が報告されているが,頻度は腺癌と比べて低い(表2)15)
~
17).陽性頻度は低いもののEGFR遺伝子変異陽性に対してEGFRチロシンキナーゼ阻害剤を使用して奏功した例が報告されており,肺LCNECでもEGFR遺伝子変異陽性例にはEGFRチロシンキナーゼ阻害剤は有効と考えられる18).肺LCNECについてもEGFR遺伝子変異がみられる場合にはEGFRチロシンキナーゼ阻害剤は治療の選択肢となる.
肺LCNECでALK融合遺伝子を認め,ALK阻害剤が奏功した例も報告されており,ALK融合遺伝子陽性の肺LCNECにもALK阻害剤は有効と考えられる19).報告例が少ないため頻度は不明であるが,肺LCNECにおいてもALK融合遺伝子が検出されればALK阻害剤は治療の選択肢となる.
このように,肺LCNECでも頻度は低いながらドライバー遺伝子変異/転座陽性例が存在し,キナーゼ阻害剤が有効であることから,治療前にはドライバー遺伝子変異/転座の有無を検索しておく価値はあると考えられる.

VII.免疫チェックポイント阻害剤
非小細胞肺癌ではドライバー遺伝子変異/転座の有無やprogrammed death-1(PD-L1)陽性細胞割合によって免疫チェックポイント阻害剤は一次治療もしくは二次治療以降で使用することが推奨・提案されている.また最近は化学療法(殺細胞性抗癌剤)と免疫チェックポイント阻害剤の併用も行われている.小細胞肺癌においても従来のカルボプラチン+VP-16にPD-L1阻害剤のアテゾリズマブの上乗せ効果が報告され,プラチナ製剤併用+アテゾリズマブ療法が行われるようになった.
Shermanが進行肺LCNECに対する免疫チェックポイント阻害剤の治療例の報告を行っている20).免疫チェックポイント阻害剤単剤の治療を受けた18例のうち,2例(11%)がCR,4例(22%)がPR,1例(6%)がSDであったと報告している20).PD-L1陽性細胞数は半数以上の例で測定されておらず,どのような症例に効果があるかは不明である.他にも肺LCNECに対する免疫チェックポイント阻害剤の有効例の症例報告が散見される.
現在のところ肺LCNECに対する免疫チェックポイント阻害剤の効果についての報告は限られているが,非小細胞肺癌や小細胞肺癌と同様に肺LCNECでも免疫チェックポイント阻害剤が治療の選択肢となりうる可能性がある.免疫チェックポイント阻害剤のバイオマーカーとしてPD-L1の他に腫瘍変異負荷(tumor mutation burden)やマイクロサテライト不安定性(microsatellite instability)が報告されており,肺LCNECでのこれらのバイオマーカーの検討も報告されていくことが期待される.今後の症例の集積を注視する必要がある.
VIII.治療方法の選択
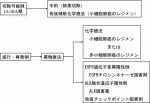
肺LCNECの治療法選択の樹形図を示した(図1).
切除可能例については,全身状態や呼吸機能から標準手術が可能ならば肺葉切除・リンパ節郭清を行い,術後には小細胞肺癌のレジメンによる補助化学療法を行う.全身状態や呼吸機能から標準手術が不可能な場合には縮小手術や定位放射線治療が選択肢となる.
進行・再発例については薬物療法が中心となる.局所進行例では放射線治療の併用が選択肢となる.薬物療法の選択についてはEGFR遺伝子変異やALK融合遺伝子が陽性の場合にはそれぞれのキナーゼ阻害剤を用いる.その他の場合には小細胞肺癌もしくは非小細胞肺癌のレジメンを用いる.免疫チェックポイント阻害剤も治療選択肢の一つである.
IX.おわりに
肺LCNECは非小細胞肺癌より予後が悪く,予後改善のためには切除例では術後補助化学療法を加え,進行・再発例では小細胞肺癌のレジメンも選択肢とするなどの治療戦略の向上が行われてきた.分子標的治療薬や免疫チェックポイント阻害剤といった新しい治療薬については頻度が低い腫瘍であるために有効性についての報告が限られているが,今後も症例を集積して治療選択肢の可能性について見出していく必要がある.
利益相反:なし
文献
1) Iyoda A, Hiroshima K, Toyozaki T, et al.: Clinical characterization of pulmonary large cell neuroendocrine carcinoma and large cell carcinoma with neuroendocrine morphology. Cancer, 91(11): 1992-2000, 2001.
2) Shimizu H, Okada M, Tangoku A, et al.: Thoracic and cardiovascular surgeries in Japan during 2017:Annual report by the Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg, 68(4): 414-449, 2020.
3) Lutfi W, Schuchert MJ, Dhupar R, et al.: Sublobar resection is associated with decreased survival for patients with early stage large-cell neuroendocrine carcinoma of the lung. Interact Cardiovasc Thorac Surg, 29(4): 517-524, 2019.
4) Iyoda A, Hiroshima K, Toyozaki T, et al.: Adjuvant chemotherapy for large cell carcinoma with neuroendocrine features. Cancer, 92(5): 1108-1112, 2001.
5) Iyoda A, Hiroshima K, Moriya Y, et al.: Prospective study of adjuvant chemotherapy for pulmonary large cell neuroendocrine carcinoma. Ann Thorac Surg, 82(5): 1802-1807, 2006.
6) Rossi G, Cavazza A, Marchioni A, et al.:Role of chemotherapy and the receptor tyrosine kinases KIT, PDGFRalpha, PDGFRbeta, and Met in large-cell neuroendocrine carcinoma of the lung. J Clin Oncol, 23(34): 8774-8785, 2005.
7) Sarkaria IS, Iyoda A, Roh MS, et al.: Neoadjuvant and adjuvant chemotherapy in resected pulmonary large cell neuroendocrine carcinomas:a single institution experience. Ann Thorac Surg, 92(4): 1180-1186, 2011.
8) Kim KW, Kim HK, Kim J, et al.: Outcomes of Curative-Intent Surgery and Adjuvant Treatment for Pulmonary Large Cell Neuroendocrine Carcinoma. World J Surg, 41(7): 1820-1827, 2017.
9) Filosso PL, Guerrera F, Evangelista A, et al.: Adjuvant chemotherapy for large-cell neuroendocrine lung carcinoma:results from the European Society for Thoracic Surgeons Lung Neuroendocrine Tumours Retrospective Database. Eur J Cardiothorac Surg, 52(2): 339-345, 2017.
10) Raman V, Jawitz OK, Yang CJ, et al.: Adjuvant Therapy for Patients With Early Large Cell Lung Neuroendocrine Cancer:A National Analysis. Ann Thorac Surg, 108(2): 377-383, 2019.
11) Wakeam E, Adibfar A, Stokes S, et al.: Defining the role of adjuvant therapy for early-stage large cell neuroendocrine carcinoma. J Thorac Cardiovasc Surg, 159(5):2043-2054, 2020.
12) Iyoda A, Azuma Y, Sano A: Neuroendocrine tumors of the lung:clinicopathological and molecular features. Surg Today, 2020 Mar 19. doi:10.1007/s00595-020-01988-7. Epub ahead of print.
13) Lo H, Abel S, Finley G, et al.: Surgical resection versus stereotactic body radiation therapy in early stage bronchopulmonary large cell neuroendocrine carcinoma. Thorac Cancer, 11(2): 305-310, 2020.
14) Cao L, Wu HF, Zhao L, et al.: The role of radiotherapy in pulmonary large cell neuroendocrine carcinoma:propensity score matching analysis. J Radiat Res, 61(4): 594-601, 2020.
15) Iyoda A, Travis WD, Sarkaria IS, et al.: Expression profiling and identification of potential molecular targets for therapy in pulmonary large-cell neuroendocrine carcinoma. Exp Ther Med, 2(6): 1041-1045, 2011.
16) Miyoshi T, Umemura S, Matsumura Y, et al.: Genomic Profiling of Large-Cell Neuroendocrine Carcinoma of the Lung. Clin Cancer Res, 23(3): 757-765, 2017.
17) Makino T, Mikami T, Hata Y, et al.: Comprehensive Biomarkers for Personalized Treatment in Pulmonary Large Cell Neuroendocrine Carcinoma:A Comparative Analysis With Adenocarcinoma. Ann Thorac Surg, 102(5): 1694-1701, 2016.
18) De Pas TM, Giovannini M, Manzotti M, et al.: Large-cell neuroendocrine carcinoma of the lung harboring EGFR mutation and responding to gefitinib. J Clin Oncol, 29(34):e819-822, 2011.
19) Hayashi N, Fujita A, Saikai T, et al.: Large Cell Neuroendocrine Carcinoma Harboring an Anaplastic Lymphoma Kinase (ALK) Rearrangement with Response to Alectinib. Intern Med, 57(5): 713-716, 2018.
20) Sherman S, Rotem O, Shochat T, et al.: Efficacy of immune check-point inhibitors (ICPi) in large cell neuroendocrine tumors of lung (LCNEC). Lung Cancer, 143: 40-46, 2020.
PDFを閲覧するためには Adobe Reader が必要です。