日外会誌. 122(1): 18-25, 2021
特集
肺・胸腺神経内分泌腫瘍の治療
3.定型カルチノイドの治療
|
1) 北海道大学 循環器・呼吸器外科 氏家 秀樹1) , 樋田 泰浩1) , 大塚 慎也1) , 佐々木 明洋1) , 山崎 洋1) , 藤原 晶1) , 加藤 達哉1) , 加賀 基知三1) , 若狭 哲1) , 松野 吉宏2) |
定型カルチノイドは低悪性度(高分化型)な肺神経内分泌腫瘍(Neuroendocrine neoplasms,NEN)であり,比較的緩徐に増大し,胸部外の臓器に転移することはほとんどないとされている.本邦の2018年度肺癌診療ガイドライン,およびNational Comprehensive Cancer Network(NCCN)ガイドラインによると,カルチノイドの治療は,カルチノイドの種類(定型,異型)および腫瘍の進展度(切除可否)に大きく依存する.一般的に,切除可能な限局型のカルチノイド腫瘍は,非小細胞肺癌と同様に肺葉切除術および縦隔リンパ節郭清術で治癒し,他の治療を必要としない.定型カルチノイドでは,異型カルチノイドと比べてリンパ節転移の可能性も低く,十分な切除断端が確保できれば,気管支管状切除などの肺温存手術を試みることができる.稀に切除不能な定型カルチノイドが存在するが,緩徐に成長する傾向があり,化学療法と放射線治療の利点は不明であるため,経過観察になることも多い.ソマトスタチンレセプター陽性例に対しては,ソマトスタチンアナログによる治療を考慮する.以上より,カルチノイドの治療は,カルチノイドの種類,および腫瘍の進展度に大きく依存するため,適切な病期・病理診断が重要である.
キーワード
定型カルチノイド, Typical carcinoid, 神経内分泌腫瘍, Neuroendocrine neoplasms(NEN), Neuroendocrine tumors(NET)
I.はじめに
神経内分泌腫瘍(neuroendocrine neoplasms,NEN)は,神経内分泌性を有する細胞から成る腫瘍であり,膵臓や消化管をはじめ,全身の様々な部位に発生する.胸部では,肺および縦隔に発生し,縦隔NENのほとんどは胸腺原発である.NENの分類は,神経内分泌性の証明法として用いられる免疫染色の進歩とともに変遷してきたが,2015年のWHO分類改訂により,肺NENの組織型は,小細胞癌(small cell lung cancer,SCLC),大細胞神経内分泌癌(large cell neuroendocrine carcinomas,LCNEC),定型および異型カルチノイド,前浸潤性病変であるびまん性特発性肺神経内分泌細胞過形成(diffuse idiopathic pulmonary neuroendocrine cell hyperplasia,DIPNECH)に分別された.さらにWHO分類の次回改訂では他臓器のNENとの統一的理解や対応関係の明記が進められるという.定型カルチノイドは,他臓器の神経内分泌腫瘍(neuroendocrine tumors, NET)G1に相当する,高分化かつ低悪性度で緩徐に成長する新生物であり,胸部外臓器に転移することは稀とされている.一方,SCLCやLCNECは急速に腫瘍が成長し,早期に播種する低分化で高悪性度のNENであり,神経内分泌癌(neuroendocrine carcinomas,NEC)に相当する.異型カルチノイドは低悪性度の定型カルチノイドと小細胞肺癌の中間に位置し,ほぼNET G2に相当する.以上のように,NENは著しく多様な生物学的特徴を有しており,治療に関しては各々に特性に見合った選択肢が必要となる.本稿では,定型カルチノイド腫瘍の診断,臨床的特徴,特に治療と予後について解説する.
II.疫学
肺NENは成人の肺悪性腫瘍の約1〜2%を占める1).米国Surveillance,Epidemiology,and End Results(SEER)データベースによると,発症頻度は近年増加しており,人口10万人あたりの年間発症頻度は1.49人であった2).肺NENの大部分はSCLCであり,新規肺癌患者の約13%を占める.一方,カルチノイドの頻度は低く,全肺癌の1%未満を占めるに過ぎない3).定型カルチノイドは60歳未満の若年者にも発症し,男性と比較して,女性患者に多いとされている1)
2)
4).肺NENの予後は組織型で大きく異なり,カルチノイドは比較的予後良好とされるが,SCLCおよびLCNECなどのNECの予後は不良である.本邦の多施設共同研究によると,全ステージを合わせた肺NEN切除後の5年生存率は,定型カルチノイドで96.2%,異型カルチノイドで77.8%であるのに対し,LCNECでは40.3%,SCLCでは35.7%と報告されている5).
III.病理診断
2015年に改訂されたWHO分類第4版で,肺NENは,SCLC,LCNEC,定型/異型カルチノイドおよびDIPNECHに大別された3).低悪性度であるカルチノイド(NET)と高悪性度であるNECとの間で,臨床的特徴や遺伝子学的背景,治療反応性が大きく異なるため,両者の鑑別がきわめて重要である.その分類は,細胞形態,核分裂像数(mitosis),壊死像(Necrosis)の有無に基づいて行われる.膵・消化管NENの診断に用いられている,増殖能を示すKi-67指数はカルチノイドとNECとの鑑別に有用であるが,肺NENの診断基準には採用されていない.
(1)組織学的特徴―定型カルチノイドは,細かく分散したクロマチンと目立たない小さな核小体を備えた規則的な円形から楕円形の核を含む細胞学的に穏やかな細胞で構成されており,細胞は多角形であり,繊細な血管間質を伴う明確なオルガノイド,小柱,または島の成長パターンで配置される(図1).核分裂像は少なく(<2mitoses/2mm2(10HPFs)),壊死を認めない,5mm以上の腫瘍とされている.一方,異型カルチノイドは核分裂像(2~10mitoses/2mm2(10HPFs)),壊死を認めると定義されている3).
(2)免疫組織化学的特徴―クロモグラニン,シナプトフィジン,NCAM(CD56)などにより,神経内分泌分化を確認できる(図2).肺NENの約50%がTTF1陽性に染色されるが,染色はしばしば弱く局所的であると報告されている.
(3)分子病理学的特徴―肺NENにおける治療標的分子としては,ソマトスタチン受容体(somatostatin receptor,SSTR)とmTORが挙げられる.ソマトスタチンアナログの標的であるSSTR2Aの発現率は,カルチノイドに比べてNECで低いことが示されている.また,AKT/mTOR経路の活性化については,リン酸化AKTおよびリン酸化mTORを高発現している割合がカルチノイドで60~73%であるのに対し,NECでは30%前後であった.したがって,カルチノイドではソマトスタチンアナログ,mTOR阻害薬の効果が期待される.


IV.臨床的特徴
腫瘍の大部分は近位気道に発生し,多くは腫瘍塊の閉塞または血管過多による出血などの症状を認める.気管支閉塞のために,咳や喘鳴,胸痛や再発性肺炎を起こすことがある.ただし,これらは偶発的に診断されることが多くなっており,胸部CTは最も有用な画像検査である.診断は一般に気管支鏡生検が行われるが,末梢病変の場合に経胸腔針生検によって診断されることがある.針生検による気胸や播種のリスクを考慮して,直接外科的切除を行うことも少なくない.稀に,腫瘍によるホルモン産生に関連する皮膚紅潮,腹部痙攣,下痢などのカルチノイド症候群の症状を呈することがあるが(約8%程度),消化管のNETに比べて発生率ははるかに低い(19~56%)6).
(1)画像所見―胸部X線写真では,ほとんどの腫瘍は2~5cmの範囲の円形または卵形の結節影として現れ,肺門周囲に認めることが多い.腫瘍により気管支閉塞を引き起こす場合,無気肺とムコイド沈着がレントゲン写真で見える場合がある.閉塞性肺炎で胸水を伴うこともある.X線写真と比較して,CT画像は腫瘍の範囲,位置,および縦隔リンパ節腫脹の有無の描出に優れている.特に中心部に位置する病変に有用である.しばしば,管腔内のポリープ状腫瘤の描出に役立つ.また,腫瘍による閉塞性無気肺または気管支閉塞に関連するムコイド沈着と区別するのに役立つ.腫瘍の形態は,葉状または不規則な境界と,点状または偏心性の石灰化を認める.
(2)その他の画像所見―定型カルチノイドの約80%は,免疫組織化学によってSSTRを発現し,SSTRシンチグラフィーを用いたイメージングが可能である7).SSTR画像法の利点の一つは,全身を画像化し,特に肺外の転移性疾患を特定できることとされている.
(3)気管支鏡検査と生検―肺NENの約4分の3が中枢気道に存在し,気管支鏡検査時の生検に適している.外観は,気管支上皮に覆われた,ポリープ状の腫瘤として認める.しばしば,血管に富んでおり,生検では出血に注意が必要である.
(4)病期分類システム―肺NENは,肺癌に使用される米国癌合同委員会(AJCC)/国際癌管理連合(UICC)を組み合わせたものと同じTNM分類を使用して病期分類される(第8版,2017).
V.定型カルチノイドの治療
本邦の肺癌診療ガイドライン(2018年版),およびNCCNガイドラインでは,肺気管支・胸腺カルチノイドに対する治療方針として,局所/局所領域病変で切除可能な症例に対しては外科切除を第一選択としている.局所切除不能例に対しては全身療法または放射線療法±全身療法,局所進行例や遠隔転移例に対しては全身療法を選択肢に挙げている.
(1)外科的切除―肺NENの患者では,病状と肺予備能がそれを許容する場合は肺葉切除と縦隔リンパ節のサンプリングまたは郭清が推奨されている6)
8).定型カルチノイドでは,小さな末梢腫瘍の場合,肺温存を試みることができるが,部分切除に比べ,区域切除などの解剖学的切除は,腫瘍の再発防止において優れていると報告されている9).しかし,SEERデータベースを用いた解析では,十分なマージンが得られる場合は,部分切除が許容できるとの報告もある10).リンパ節郭清の役割に関しては定型カルチノイドの5~20%と異型カルチノイドの30~70%がリンパ節に転移するという報告があり,定型カルチノイドではリンパ節郭清は必ずしも必須ではないという報告がある7)
11).また,定型カルチノイドでリンパ節転移を有する症例でも,5年生存率が100%であったとの報告もあり,リンパ節郭清の利点は必ずしも証明されていない12).一方,可能であればリンパ節郭清が行った方が良いとの見解もあり13),一定のコンセンサスはないのが現状である.異型カルチノイドでは,リンパ節転移の可能性も高く,肺癌に準じて,解剖学的な肺葉切除およびリンパ節郭清が推奨されている12).定型カルチノイドと異型カルチノイドの鑑別は,腫瘍を完全に切除しないと難しく,術前診断や術中迅速診断で両者を鑑別することは容易ではない.そのため,術式を事前に決める際は,基本的には,異型カルチノイドに準じ,解剖学的な肺葉切除およびリンパ節郭清が推奨されている.以上より,解剖学的な外科的切除およびリンパ節郭清を行った方が良いが,その他の身体的要因などを総合的に判断して,縮小手術も許容されており,治療方法を決定する必要がある.
(2)中枢腫瘍に対する外科的切除―主気管支または中間気管支幹のポリープ状定型カルチノイドの場合,気管支壁の楔状またはスリーブ切除を伴う気管支切開術および遠位肺実質の完全な保存を行うことができる.断端陰性の患者において長期生存が報告されおり6),術中の腫瘍断端に対する凍結切片診断は断端を評価する上で重要である.断端陽性例には,追加切除などの完全切除が望ましい8).
(3)治療後の経過観察―治療後の経過観察に関して一定のコンセンサスはないが,非小細胞肺癌と同様の経過観察が推奨される.
(4)完全切除後の補助療法―定型カルチノイドに対する,完全切除後の補助療法の役割は,前向き無作為化試験がなく,不明確である.リンパ節転移のある場合でも,全身補助療法の恩恵を受けることはないとされている11).
(5)気管支内治療―根治的外科的切除が好ましいが,気管支内レーザー切除は中枢気道閉塞の症例や外科手術に耐えられない高齢者などの緩和治療に有用である.また,気管支内治療のみで42%の患者が再発を認めず手術を回避できたとの報告もある.
レーザー治療―管腔内に露出する気管支鏡下切除が可能なポリープ状の腫瘍に対し,Nd:YAGレーザーが有効であり,長期の無再発生存を認めたという報告が散見される14)
15).閉塞性病変に対するレーザーによる除去は,術前の可及的な処置として有用であるという報告もある16).
クライオセラピー(冷却療法)―経気管支クライオセラピーの有用性が報告されている17).レーザー治療と同様に,クライオセラピーは,外科的切除が困難な中枢気道閉塞患者の緩和的管理に有用である可能性がある.
(6)局所的に進行する切除不可能な腫瘍―局所に対する放射線治療は,効果的な緩和を提供する可能性があるが,根治的治療法ではない.
(7)進行例に対する全身療法―全身療法の選択肢としては,オクレオチドやランレオチドなどのソマトスタチンアナログ,エベロリムス,peptide receptor radionuclide therapy(本邦未承認)があり,異型カルチノイドの一部では化学療法も選択肢になる.しかし,どの薬剤を第一選択とするかについては,エビデンスが十分にないことから言及されていない.一方,European Neuroendocrine Tumor Society(ENETS)のガイドラインでは,進行/切除不能カルチノイドの治療に関して,細胞形態(定型,異型),Ki-67,SSTRの発現状況,増殖速度などに基づく薬剤選択方針が示されており,Ki-67<10%で増殖が遅く,SSTR強陽性であればソマトスタチンアナログ,それ以外の場合はエベロリムスを第一選択とし,Ki-67>15%の異型カルチノイドについては,ソマトスタチンアナログやエベロリムスが無効であれば化学療法を考慮するとしている18).
VI.定型カルチノイドの予後
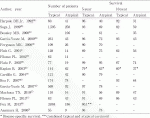
定型カルチノイドは,切除後の5年生存率は89~96%と良好であり(表1),10年生存率でも82~93%である4)
5)
7)
11)
14)
15)
19)
~
27).長期の経過観察を行った大規模シリーズでは,再発率が3%と非常に良好であると報告されている28).
定型カルチノイドのリンパ節転移症例の予後への影響については議論の余地があるが,ほとんどの研究はリンパ節転移のない症例と比較してより悪い結果を示している11)
15)
24)
28).リンパ節転移の有無に加えて,不完全切除は,予後に最も影響する28).低悪性度肺NENの生存率を予測するためのノモグラムの報告があり,これは,年齢,性別,悪性腫瘍の有無,腫瘍部位(中枢,末梢),TNM分類,およびパフォーマンスステータスに基づいている29).
VII.おわりに
本稿では,定型カルチノイドの疫学,病理診断および治療について概説した.定型カルチノイドは,転移することが稀で,良好な予後を示す.外科的切除が第一選択となり,充分なマージンを確保した切除が行えれば必ずしも肺葉切除が必要ではないが,病状と肺予備能が許容する場合には非小細胞肺癌と同様に解剖学的な肺切除術を考慮するのが妥当である.
利益相反:なし
文献
1) Modlin IM , Lye KD , Kidd M : A 5-decade analysis of 13,715 carcinoid tumors. Cancer, 97(4): 934-959, 2003.
2) Dasari A , Shen C , Halperin D , et al.: Trends in the incidence, prevalence, and survival outcomes in patients with neuroendocrine tumors in the united states. JAMA Oncol, 3(10): 1335-1342, 2017.
3) Travis WD , Brambilla E , Nicholson AG , et al.: The 2015 world health organization classification of lung tumors:Impact of genetic, clinical and radiologic advances since the 2004 classification. J Thorac Oncol, 10(9): 1243-1260, 2015.
4) Fink G , Krelbaum T , Yellin A , et al.: Pulmonary carcinoid:Presentation, diagnosis, and outcome in 142 cases in israel and review of 640 cases from the literature. Chest, 119(6): 1647-1651, 2001.
5) Asamura H , Kameya T , Matsuno Y , et al.: Neuroendocrine neoplasms of the lung:A prognostic spectrum. J Clin Oncol, 24(1): 70-76, 2006.
6) Gustafsson BI , Kidd M , Chan A , et al.: Bronchopulmonary neuroendocrine tumors. Cancer, 113(1): 5-21, 2008.
7) Terzi A , Lonardoni A , Feil B , et al.: Bronchoplastic procedures for central carcinoid tumors:Clinical experience. Eur J Cardiothorac Surg, 26(6): 1196-1199, 2004.
8) El Jamal M , Nicholson AG , Goldstraw P .: The feasibility of conservative resection for carcinoid tumours:Is pneumonectomy ever necessary for uncomplicated cases? Eur J Cardiothorac Surg, 18(3): 301-306, 2000.
9) Filosso PL , Guerrera F , Falco NR , et al.: Anatomical resections are superior to wedge resections for overall survival in patients with stage 1 typical carcinoids. Eur J Cardiothorac Surg, 55(2): 273-279, 2019.
10) Cattoni M , Vallieres E , Brown LM , et al.: Sublobar resection in the treatment of peripheral typical carcinoid tumors of the lung. Ann Thorac Surg, 108(3): 859-865, 2019.
11) Filosso PL , Oliaro A , Ruffini E , et al.: Outcome and prognostic factors in bronchial carcinoids:A single-center experience. J Thorac Oncol, 8(10): 1282-1288, 2013.
12) García-Yuste M , Matilla JM , Cueto A , et al.: Typical and atypical carcinoid tumours:Analysis of the experience of the spanish multi-centric study of neuroendocrine tumours of the lung. Eur J Cardiothorac Surg, 31(2): 192-197, 2007.
13) Darling GE , Allen MS , Decker PA , et al.: Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with n0 or n1 (less than hilar) non-small cell carcinoma:Results of the american college of surgery oncology group z0030 trial. J Thorac Cardiovasc Surg, 141(3): 662-670, 2011.
14) Cardillo G , Sera F , Di Martino M , et al.: Bronchial carcinoid tumors:Nodal status and long-term survival after resection. Ann Thorac Surg, 77(5): 1781-1785, 2004.
15) Harpole DH Jr , Feldman JM , Buchanan S , et al.: Bronchial carcinoid tumors:A retrospective analysis of 126 patients. Ann Thorac Surg, 54(1): 50-55, 1992.
16) Schreurs AJ , Westermann CJ , van den Bosch JM , et al.: A twenty-five-year follow-up of ninety-three resected typical carcinoid tumors of the lung. J Thorac Cardiovasc Surg, 104(5): 1470-1475, 1992.
17) Bertoletti L , Elleuch R , Kaczmarek D , et al.: Bronchoscopic cryotherapy treatment of isolated endoluminal typical carcinoid tumor. Chest, 130(5): 1405-1411, 2006.
18) Wolin EM : Advances in the diagnosis and management of well-differentiated and intermediate-differentiated neuroendocrine tumors of the lung. Chest, 151(5): 1141-1146, 2017.
19) Ferguson MK , Landreneau RJ , Hazelrigg SR , et al.: Long-term outcome after resection for bronchial carcinoid tumors. Eur J Cardiothorac Surg, 18(2): 156-161, 2000.
20) Soga J , Yakuwa Y : Bronchopulmonary carcinoids: An analysis of 1,875 reported cases with special reference to a comparison between typical carcinoids and atypical varieties. Ann Thorac Cardiovasc Surg, 5(4): 211-219, 1999.
21) Beasley MB , Thunnissen FB , Brambilla E , et al.:Pulmonary atypical carcinoid:Predictors of survival in 106 cases. Human pathology, 31(10): 1255-1265, 2000.
22) Garcia-Yuste M , Matilla JM , Alvarez-Gago T , et al.: Prognostic factors in neuroendocrine lung tumors:A spanish multicenter study. Spanish multicenter study of neuroendocrine tumors of the lung of the spanish society of pneumonology and thoracic surgery (emetne-separ). Ann Thorac Surg, 70(1): 258-263, 2000.
23) Filosso PL , Rena O , Donati G , et al.: Bronchial carcinoid tumors:Surgical management and long-term outcome. J Thorac Cardiovasc Surg, 123(2): 303-309, 2002.
24) Fiala P , Petraskova K , Cernohorsky S , et al.: Bronchial carcinoid tumors:Long-term outcome after surgery. Neoplasma, 50(1): 60-65, 2003.
25) Kaplan B , Stevens CW , Allen P , et al.: Outcomes and patterns of failure in bronchial carcinoid tumors. Int J Radiat Oncol Biol Phys, 55(1): 125-131, 2003.
26) Rea F , Rizzardi G , Zuin A , et al.: Outcome and surgical strategy in bronchial carcinoid tumors:Single institution experience with 252 patients. Eur J Cardiothorac Surg, 31(2): 186-191, 2007.
27) Machuca TN , Cardoso PF , Camargo SM , et al.: Surgical treatment of bronchial carcinoid tumors:A single-center experience. Lung Cancer, 70(2): 158-162, 2010.
28) Lou F , Sarkaria I , Pietanza C , et al.: Recurrence of pulmonary carcinoid tumors after resection:Implications for postoperative surveillance. Ann Thorac Surg, 96(4): 1156-1162, 2013.
29) Filosso PL , Guerrera F , Evangelista A , et al.: Prognostic model of survival for typical bronchial carcinoid tumours:Analysis of 1109 patients on behalf of the european association of thoracic surgeons (ests) neuroendocrine tumours working group. Eur J Cardiothorac Surg, 48(3): 441-447; discussion 447, 2015.
30) Fox M , Van Berkel V , Bousamra M 2nd , et al.: Surgical management of pulmonary carcinoid tumors:Sublobar resection versus lobectomy. American journal of surgery, 205(2): 200-208, 2013.
PDFを閲覧するためには Adobe Reader が必要です。