日外会誌. 121(2): 202-209, 2020
特集
臓器移植の現状と展望
9.移植免疫と免疫寛容
|
1) 順天堂大学 健康総合科学先端研究機構,肝胆膵外科 内田 浩一郎1) , 奥村 康2) |
免疫抑制剤の生涯内服による併発合併症は,現在の臓器移植最大の課題である.生体の維持に必要な免疫反応は維持しながら,ドナー抗原に対する免疫応答を抑える免疫寛容の誘導は理想的な治療となりえる.臓器移植における免疫寛容誘導のアプローチは,造血幹細胞移植を併用するキメリズム誘導と生体内でドナー抗原に選択的な制御性T細胞を増幅させる方法で実現されているものの,寛容の誘導と維持にかかわるメカニズムや診断のバイオマーカーなど普及に向けて解決すべき課題は多い.本邦発の臨床試験にてCD80/86抗体によるドナー抗原選択的な抑制性T細胞を用いることで免疫寛容を誘導することが可能となった.この免疫寛容誘導法のさらなる普及にむけて,アカデミア中心の医師主導治験が準備されている.
キーワード
移植免疫, 免疫寛容, キメリズム, 制御性T細胞, 免疫モニタリング診断法
I.はじめに―移植医療における免疫寛容の意義とその歴史―
免疫寛容の研究の歴史は自己-非自己の免疫学研究と同じく1940年代から始まり,Owen1)とBillingham・Brent・Medawarら2)がそれぞれ報告したフリーマーチンとNeonatal Toleranceがある.すなわち,胎児・新生児期にドナー抗原への感作により,抗原特異的な免疫寛容が成立する,そしてその機構は胎児期の共通胎盤によるcross-circulationに伴うキメリズムが関係すると提唱された.このMedawarの免疫寛容誘導の方法論はマウスや霊長類そして臨床で,ドナー由来の骨髄細胞輸注法として,レシピエントT細胞除去下に実施され,グラフトの長期生着を獲得している3).上記のドナー由来骨髄細胞輸注の臨床試験は,腎臓移植から始まり4),有効な症例も認められた.その後,Starzlらが免疫抑制剤を中断している患者においてマイクロキメリズムが生じている報告がなされている5).その後,マイクロキメリズム誘導による免疫抑制効果を期待して,骨髄移植併用の臓器移植の臨床試験が実施され6),グラフト生存率が高く慢性拒絶のリスクは少ない傾向が認められた.しかし,同時期の比較コントロールがないこと,キメリズムや診断法の差異から,研究は終息した.このキメリズム誘導による方法論は2000年以降様々なプレコンディショニング法で臨床試験され,免疫寛容が誘導可能な三つのプロトコールが確立された.すなわち,ドナー由来の骨髄細胞もしくは造血幹細胞の輸注により,一過性キメリズム7),混合キメリズム8),持続性キメリズム9)を誘導し免疫寛容を高率に実現する方法である.興味深いことは,免疫寛容の誘導にはそれぞれのキメリズム状態になることが必須であるものの,免疫寛容の維持にキメリズムは必ずしも重要でなく,むしろ宿主由来の抗ドナー選択的な制御性T細胞を生体内で増幅させるような末梢性免疫寛容が相関する可能性がある点である10).またドナー幹細胞輸注に伴うキメリズムとは別に近年,制御性T細胞11)や制御性樹状細胞12)など免疫制御系のリンパ球治療による免疫寛容誘導の新しいアプローチが報告されている.さらに肝臓という免疫学的に寛容臓器の移植においては,レシピエントの原疾患や年齢,移植後の時期を調整することで,免疫抑制剤を減量・中断できることが可能とも報告されている13).本稿では,臓器移植後の免疫寛容誘導法とそのメカニズム,さらにバイオマーカーについてレビューしていく.
II.幹細胞輸注によるキメリズム誘導と免疫寛容
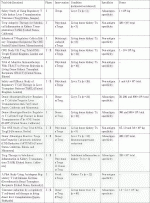
造血幹細胞輸注によるキメリズムにて免疫寛容誘導法はMedawarやStarzlから始まり,現在世界で主にその臨床試験を行っている施設は,ハーバード大学マサチューセッツ総合病院(MGH),スタンフォード大学病院,ノースウェスタン(NW)大学病院であり,いずれも腎移植を対象としている(表1).免疫寛容誘導のためのキメリズムとして,MGHは一過性混合キメラ,スタンフォードは持続性混合キメラ,NWはフルキメラを目標としている.骨髄移植分野におけるミニ移植が持続性混合キメラに,フル移植がフルキメラにあたり,その移植前処置も類似する.
1.MGHプロトコール
1989年にSachsらに提唱され14),当初はマウス骨髄移植モデルに胸腺・全身放射線照射と抗CD4/CD8抗体投与により誘導された持続性混合キメラによる寛容誘導法であった.その後非ヒト霊長類腎移植モデルでの検証で持続性混合キメラよりは一過性混合キメラによる免疫寛容アプローチに変更され15),臨床試験の際には,移植前治療が骨髄破壊性の放射線全身照射からサイクロフォスファミドによる薬剤的骨髄抑制に変更され,5症例中4症例で免疫抑制剤を移植後6~14カ月で中断可能という結果を報告する7).その後抗CD20抗体併用プロトコールで10例施行され,4例が免疫抑制剤なしで安定,3症例が原疾患再発や抗体関連拒絶で免疫抑制剤再開,3例が慢性拒絶や血栓性微小血管障害の免疫関連合併症でグラフト不全であった16).この寛容誘導のメカニズムは,ドナー反応性T細胞レパトアを追跡することで検討され,そのレパトアの特異的除去(クローナルデリーション)による可能性を報告されている17).さらに,非ヒト霊長類腎移植モデルでCTLA4-Ig(ベラタセプト)によるアナジー状態を誘導するプロトコールも開発されている.
2.スタンフォード大学プロトコール
Stroberらが1978年に発表した全身リンパ節照射法を併用した混合キメラによる免疫寛容誘導法である18).混合キメラの誘導は,抗胸腺細胞免疫グロブリン(サイモグロブリン)と全身リンパ節照射によるT細胞除去の前処置によるドナー末梢血造血幹細胞移植で確立させた19).この前処置は,スタンフォード大学病院で臨床骨髄移植でのGVHD予防で実施されており20),臓器移植への適応拡大とも解釈できる.臨床試験は対象を分けて3期に渡って実施され,2000~2003年の期間ではHLA非適合のペアで,2005年からはHLA適合,2010年からはHLAハプロ適合のペアを対象とした.対象はいずれも生体腎臓移植で,ドナーは移植の6週間前に5日間の顆粒球コロニー刺激因子(granulocyte-colony stimulating factor:G-CSF)治療後,白血球除去装置を用いて末梢血単核球を採取し,CD34陽性造血幹細胞を選定抽出し(8×106cell/kg),1-50×106/kgのCD3陽性T細胞と共に移入する.HLA適合移植では,25例中22例で6カ月以上の混合キメラが誘導可能で,18例で免疫抑制剤が中断可能であった.HLAハプロ適合ペアでは,ドナーT細胞数の増加試験を併用し,10例中5例で6カ月以上混合キメラ誘導に成功したが,12カ月以上続いたのは2例であり,さらには免疫抑制剤を中断できた症例はいなかった.混合キメラの誘導効率には,末梢血造血幹細胞(CD34)とCD3T細胞が多いほうが有利であった.スタンフォード大学での2001~2013年までの合計45症例の臨床試験において,安全性はグラフトロスは1例も存在せず,発癌は2症例(甲状腺癌と乳癌)であった.細胞移入後1年以内の短中期安全性については,5例で好中球減少性発熱による再入院を要し,細胞障害性拒絶反応が5例,抗体関連拒絶反応もしくは生着症候群(engraftment syndrome)が1例であり,GVHDは認めなかった.
3.NW大学プロトコール
2012年にジョンズホプキンズから提唱されたHLAミスマッチ骨髄移植プロトコール21)を,臓器移植に適応拡大したものである.その特徴は,厳しい骨髄非破壊的前処置ののちに,腎臓移植を施行し,その後末梢血造血幹細胞(CD34)とtolerogenic CD8+/TCR- graft facilitating cellsを移入することで,完全なドナーキメリズムを誘導し免疫寛容を目指したものである9).前処置として,フルダラビン(30mg/kg days -4,-3,-2)とサイクロフォスファミド(50mg/kg days -3),放射線全身照射(200cGy)を行う.さらに造血幹細胞移植後にサイクロフォスファミドをGVHD予防として再投与する.facilitating cellsとはαβ/γδ T細胞受容体を持たないCD8細胞であり,造血幹細胞とは異なる細胞とされている.それらは寛容原性形質細胞様樹状細胞(B220+/CD11c+)を65%含むとされ,造血幹細胞の生着促進やGVHD予防さらには,抗原特異的制御性T細胞を誘導すると報告されている.これらの治療薬はアメリカFDAにPhase Ⅱ臨床試験(NCT00497926)として承認され22),42例が登録され,うち移植は37例実施された.1年以上経過観察した31症例において,持続的ドナーフルキメラの誘導は23/31例,T細胞とそれ以外の血球系細胞の多系統キメリズムが得られたのはうち20/23例であった.免疫抑制剤から完全離脱できた症例は22例であった.一方で2症例GVHDが発症し,高いoperational tolerance誘導率から魅力的な方法論である一方で,腎不全患者にはより侵襲的な前処置方法でもある.このプロトコールは,現在Phase Ⅲ臨床試験として実施されている.

III.免疫調整細胞療法による末梢性免疫寛容の誘導
造血幹細胞移植によるキメリズム誘導アプローチとは別に,近年様々な免疫調整細胞を用いた免疫寛容誘導の臨床試験が進んでいる.その治療コンセプトは主に制御性T細胞を生体内で増幅・維持させることで,グラフトに発現するドナーHLA抗原に対しての免疫反応を抑制性に調整することを目的としている.これらは,1980年代後半からT細胞のアナジ―(免疫不応答性)という概念23)と,それらを定義できるFOXP3という転写因子の発見から,制御性T細胞基礎研究が急速に発展したことを契機に24),制御性T細胞そのものの細胞治療や生体内で制御性T細胞を増幅させる制御性単球(regulatory monocyte)や寛容系樹状細胞(tolerogenic dendritic cells),間葉系幹細胞(Mesenchymal stem cell)などの細胞治療が臨床応用されている.
1.制御性T細胞治療
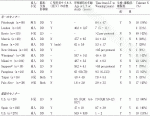
CD4陽性CD25陽性FOXP3陽性の制御性T細胞は純化/非純化に分かれる.免疫研究の時代背景が影響しており,アナジ―T細胞の時代には定義マーカーがないため,純化する発想はなかった.一方で,制御性T細胞の時代においては,FOXP3という具体的なマーカーを用いることによって,純化増幅させる研究が発展した.またこの純化選択vs非選択の細胞治療薬デザインについては,有効成分と目的外不純物を仕分けるというquality by designという臨床薬事の各国規制の温度差によるものと考えられる.臨床試験の細胞ソースは末梢血単核球が主で,臍帯血や脾臓細胞の使用は少なく,適応疾患は,臓器・骨髄移植の拒絶・GVHD予防,自己免疫疾患やⅠ型糖尿病に対して実施された.制御性T細胞移植には,様々な抗原に対する免疫応答を制御する汎用性の高いpolyclonal Tregと抗原選択的に抑制する抗原特異的Tregがある.臓器移植における制御性T細胞の臨床試験のまとめを表2に示す.未だ臓器移植後の免疫寛容誘導を実現した臨床試験は,制御性T細胞治療プロトコールは本邦の生体肝移植の臨床試験のみ11)であり,単一施設のエビデンスでしかない.しかし,この本邦臨床試験が示した移植後早期の免疫寛容が7/10例という高い誘導率は,世界の制御性T細胞治療の研究を加速させ,特に肝・腎移植において移植後早期と晩期において様々なトライアルが始まっている.将来新しい免疫治療としての可能性がある一方で,一緒に使用する免疫抑制剤との相互関係,その特異性,安定性,抑制メカニズムをさらに詳しく研究開発を進めていく必要がある.
2.骨髄ミエロイド系抑制性細胞治療
骨髄由来Mesenchymal Stem Cell(MSC)は非特異的に免疫抑制をかける不均一な細胞で,ドナー抗原反応性CD4・CD8T細胞の抑制作用をもち,生体腎移植で初めて実施された25).当初は移植後7日目に投与されていたものの,移植後早期で炎症が治まっていないグラフトへMSCが浸潤(engraftment syndrome)し過剰に活性化し好中球を介したさらなる炎症を惹起させ腎機能を悪化させる結果であった.その後,移植前投与と,導入療法を強化し移植後投与する施設に分かれ,MSCも自己もしくはドナー由来のもので臨床研究が実施された.腎移植においては移植後の免疫抑制剤の低量化を実現できている一方で,肝移植においては第3者ドナー由来のMSCが用いられ,その安全性は確認されていたものの,免疫抑制剤から離脱できた症例は報告されていない.
生体内で新たに制御性T細胞を誘導するMreg,DCregの臨床研究も進んでいる.Mregはレーゲンスブルク大学を中心に研究開発され26),ドナー末梢血単核球をM-CSFとIFNgで培養することで誘導される.このMregは主に腎臓移植で移植5日目に投与される形で臨床試験され,安全性とさらなる臨床応用が期待されている.DCregは,抗原提示する古典的な樹状細胞と比較して,MHC-classⅠおよびclassⅡ,共刺激分子のCD80,CD86分子の発現が弱く,PD-L1やFasLのような抑制性分子が発現している樹状細胞と定義され,免疫活性をあげるIL-12p70は放出せず,IL-10やTGF-βなどの抑制性サイトカインを産生する27).このDCregはリウマチなどの自己免疫疾患や1型糖尿病,クローン病などにも臨床試験されており,その安全性と有効性が報告されている28).臓器移植においては,現在ピッツバーグ大学にてPhase Ⅰ/Ⅱ試験が生体肝移植にて安全性と免疫抑制剤からの離脱を目標に実施されている.
IV.肝移植における免疫寛容誘導
50年以上前,Calneは肝臓は他の臓器と異なり免疫学的に移植しても生着しやすいと報告している29).その主メカニズムとして,肝臓内には免疫反応を強く引き起こす抗原提示細胞や共刺激分子が少ない,免疫抑制性分子を発現している細胞集団が多く存在する,Donor Specific Antibody(DSA)の機能を低下させる,臓器容積(ドナー抗原)の量が大きくimmune exhaustionを誘導しやすい,MHCクラス2の発現が低い,抑制機能をもつ造血幹細胞の存在が報告されている.表3に示す通り,この肝臓抑制機構を活用して免疫寛容誘導の臨床試験が実施されてきた.従来は単一移植施設毎の臨床研究で,適応や診断も非常にバラツキが多く再現性に乏しいものであった.近年は,欧米を中心に多施設・前向き研究が始まり,小児,移植後の年数,患者年齢,HCV感染の有無が免疫寛容の誘導率を上げるものと報告されている13)30).また移植後2年以内の免疫寛容の誘導率は13%前後と低いことが再認識された.今後の普及に向けて,拒絶や寛容を診断・予測するバイオマーカーが必須である.
V.免疫寛容診断のためのバイオマーカー探索研究
現在,免疫寛容は,臨床的・病理学的に拒絶反応がないという除外項目で診断されている.唯一キメリズムによる免疫寛容の誘導においては,キメリズムの持続性が免疫寛容の維持を示唆する診断ツールとされている.制御性T細胞などの細胞治療によりレシピエントの抗ドナー免疫応答性を調整する治療法は大きな将来性があるものの,免疫寛容と診断・予測できるバイオマーカーがあって初めて普及していくものである.報告されているバイオマーカーの手法はすべて探索段階のシーズであり,再現性がとられたものはない.免疫寛容を診断するアプローチは,全身もしくは局所(グラフト)の免疫反応に分けられる.すなわちグラフトの蛍光多重組織免疫染色法による抑制性細胞の浸潤の有無,RNAシークエンスによる遺伝子発現プロファイルをはじめ,フローサイトメーター法による末梢血リンパ球の解析,抗ドナーHLA抗体のサブタイプ解析,リンパ球刺激試験による抗ドナー免疫応答性を評価することで,多角的検査データを集積することにより免疫寛容を診断するツールが開発されることが期待されている.
VI.おわりに
現在,日本移植学会からの学術的支援を受けながら,当研究室を中心として,誘導型抑制性T細胞を再生医療等製品としての薬事承認を目指した臨床開発が進んでいる.この学会後援の医師主導治験は,免疫寛容の誘導というアカデミアや移植患者の強い思いが募ったものである.
利益相反:なし
文献
1) Owen RD: Immunogenetic Consequences of Vascular Anastomoses between Bovine Twins. Science, 102(2651): 400-401, 1945
2) Billingham RE, Brent L, Medawar PB: Actively acquired tolerance of foreign cells. Nature, 172(4379): 603-606, 1953
3) Opelz G, Terasaki PI: Improvement of kidney-graft survival with increased numbers of blood transfusions. N Engl J Med, 299(15): 799-803, 1978
4) Monaco AP, Clark AW, Wood ML, et al.: Possible active enhancement of a human cadaver renal allograft with antilymphocyte serum (ALS) and donor bone marrow:case report of an initial attempt. Surgery, 79(4): 384-392, 1976
5) Starzl TE, Demetris AJ, Trucco M, et al.: Chimerism and donor-specific nonreactivity 27 to 29 years after kidney allotransplantation. Transplantation, 55(6): 1272-1277, 1993
6) Fontes P, Rao AS, Demetris AJ, et al.: Bone marrow augmentation of donor-cell chimerism in kidney, liver, heart, and pancreas islet transplantation. Lancet, 344(8916): 151-155, 1994
7) Kawai T, Cosimi AB, Spitzer TR, et al.: HLA-mismatched renal transplantation without maintenance immunosuppression. N Engl J Med, 358(4): 353-361, 2008
8) Scandling JD, Busque S, Dejbakhsh-Jones S, et al.: Tolerance and chimerism after renal and hematopoietic-cell transplantation. N Engl J Med, 358(4): 362-368, 2008
9) Leventhal J, Abecassis M, Miller J, et al.: Chimerism and tolerance without GVHD or engraftment syndrome in HLA-mismatched combined kidney and hematopoietic stem cell transplantation. Sci Transl Med, 4(124): 124ra28, 2012
10) Leventhal JR, Miller J, Mathew JM, et al.: Updated follow-up of a tolerance protocol in HLA-identical renal transplant pairs given donor hematopoietic stem cells. Hum Immunol, 79(5): 277-282, 2018
11) Todo S, Yamashita K, Goto R, et al.: A pilot study of operational tolerance with a regulatory T-cell-based cell therapy in living donor liver transplantation. Hepatology, 64(2): 632-643, 2016
12) Thomson AW, Humar A, Lakkis FG, et al.: Regulatory dendritic cells for promotion of liver transplant operational tolerance:Rationale for a clinical trial and accompanying mechanistic studies. Hum Immunol, 79(5): 314-321, 2018
13) Benitez C, Londono MC, Miquel R, et al.: Prospective multicenter clinical trial of immunosuppressive drug withdrawal in stable adult liver transplant recipients. Hepatology, 58(5): 1824-1835, 2013
14) Sharabi Y, Sachs DH: Mixed chimerism and permanent specific transplantation tolerance induced by a nonlethal preparative regimen. J Exp Med, 169(2): 493-502, 1989
15) Kawai T, Poncelet A, Sachs DH, et al.: Long-term outcome and alloantibody production in a non-myeloablative regimen for induction of renal allograft tolerance. Transplantation, 68(11): 1767-1775, 1999
16) Kawai T, Sachs DH, Sprangers B, et al.: Long-term results in recipients of combined HLA-mismatched kidney and bone marrow transplantation without maintenance immunosuppression. Am J Transplant, 14(7): 1599-1611, 2014
17) Morris H, DeWolf S, Robins H, et al.: Tracking donor-reactive T cells:Evidence for clonal deletion in tolerant kidney transplant patients. Sci Transl Med, 7(272): 272ra10, 2015
18) Slavin S, Reitz B, Bieber CP, et al.: Transplantation tolerance in adult rats using total lymphoid irradiation: permanent survival of skin, heart, and marrow allografts. J Exp Med, 147(3): 700-707, 1978
19) Strober S, Modry DL, Hoppe RT, et al.: Induction of specific unresponsiveness to heart allografts in mongrel dogs treated with total lymphoid irradiation and antithymocyte globulin. J Immunol, 132(2): 1013-1018, 1984
20) Kohrt HE, Turnbull BB, Heydari K, et al.: TLI and ATG conditioning with low risk of graft-versus-host disease retains antitumor reactions after allogeneic hematopoietic cell transplantation from related and unrelated donors. Blood, 114(5): 1099-1109, 2009
21) Bolanos-Meade J, Fuchs EJ, Luznik L, et al.:HLA-haploidentical bone marrow transplantation with posttransplant cyclophosphamide expands the donor pool for patients with sickle cell disease. Blood, 120(22): 4285-4291, 2012
22) Leventhal JR, Elliott MJ, Yolcu ES, et al.:Immune reconstitution/immunocompetence in recipients of kidney plus hematopoietic stem/facilitating cell transplants. Transplantation, 99(2): 288-298, 2015
23) Chappert P, Schwartz RH: Induction of T cell anergy:integration of environmental cues and infectious tolerance. Curr Opin Immunol, 22(5): 552-559, 2010
24) Hori S, Nomura T, Sakaguchi S: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299(5609): 1057-1061, 2003
25) Perico N, Casiraghi F, Introna M, et al.: Autologous mesenchymal stromal cells and kidney transplantation:a pilot study of safety and clinical feasibility. Clin J Am Soc Nephrol, 6(2): 412-422, 2011
26) Hutchinson JA, Riquelme P, Sawitzki B, et al.: Cutting Edge:Immunological consequences and trafficking of human regulatory macrophages administered to renal transplant recipients. J Immunol, 187(5): 2072-2078, 2011
27) Morelli AE, Thomson AW: Tolerogenic dendritic cells and the quest for transplant tolerance. Nat Rev Immunol, 7(8): 610-621, 2007
28) Giannoukakis N, Phillips B, Finegold D, et al.: Phase I (safety) study of autologous tolerogenic dendritic cells in type 1 diabetic patients. Diabetes Care, 34(9): 2026-2032, 2011
29) Calne RY, Sells RA, Pena JR, et al.: Induction of immunological tolerance by porcine liver allografts. Nature, 223(5205): 472-476, 1969
30) Shaked A, DesMarais MR, Kopetskie H, et al.: Outcomes of immunosuppression minimization and withdrawal early after liver transplantation. Am J Transplant, 19(5): 1397-1409, 2019
PDFを閲覧するためには Adobe Reader が必要です。