日外会誌. 121(2): 177-183, 2020
特集
臓器移植の現状と展望
5.腎移植
|
九州大学 臨床・腫瘍外科(第一外科) 岡部 安博 , 中村 雅史 |
現在は約33万人の末期腎不全による透析患者が存在し,わが国は人口当たりの透析患者数において世界第1位である.腎移植は日本全国で年間1,800件を超え,臓器別の移植件数としては最多であり年々増加傾向であるためより身近な医療となりつつある.しかし,約9割が生体ドナーからの腎移植であり,世界と比較すると献腎移植および臓器提供が非常に少ない.腎移植後は長期生着・長期生存が期待できるようになった反面,腎移植患者の悪性腫瘍が増加していくと考えられる.今後は,①既存抗体陽性患者への腎移植,②2次移植/3次移植といった多次移植,③膵腎同時,肝腎同時,心腎同時移植といった腎移植を含む多臓器移植も増加していくと考えられる.免疫抑制剤を内服しているからと敬遠するのではなく,少しでも多くの一般外科医に腎移植について理解していただきたく,わが国の腎移植の現状と今後の展望について述べてみたい.
キーワード
腎移植, 臓器提供, 長期生着, 既存抗体陽性, 多臓器移植
I.はじめに―腎移植の歴史―
腎移植に関する記述では,1902年にUllmanがイヌを用いた腎移植実験を発表したのが最初の報告1)と言われている.最初の同種腎移植の成功例は米国において1953年にMerrill, Murrayらが行った一卵性双生児間の生体腎移植である2).一方,わが国では1956年に新潟大学において,急性腎不全患者に対して腎臓を移植したのが最初の症例として報告されている3).当初の腎移植の成績は良くなかったが,1980年代からCyclospolineA(CyA),Tacrolimus(TAC)などの優れた免疫抑制剤の開発や手術術式の確立によって成績が飛躍的に向上してきている.
II.腎移植の現状
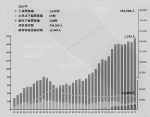
腎移植は臓器移植としては国内では最多の移植件数となっており,すでに最も身近な移植医療であるといえる.WHOによると4),2010年には世界中で約262万人が透析治療をうけているがそのうちの30万人は日本人である.今後2030年までに世界の透析人口は倍増するであろうと言われている.また世界では年間約7万人の腎移植手術が行われているが,そのうちの54%が献腎移植であり,生体ドナーによる腎移植は46%に過ぎない.一方で日本では図1に示すように5),徐々に腎移植症例数は増加傾向であり,2018年は初めて1,800例を超え1,855例であった(第55回日本移植学会報告より).しかしながら献腎移植は脳死下/心停止下を合わせても約200例であり,残りの約9割は生体ドナーからの腎移植であり生体ドナーの占める割合が非常に高い.これは世界的にみると脳死/心停止下でのドナー提供が少ないからであり,腎移植の多くを生体ドナーに依存したかなりいびつな腎移植形態となっている.ちなみに2018年の米国では人口3.27億人に対して21,167件の腎移植が行われており,そのうち生体腎移植は約3割の6,442件であり,約7割の14,725件が献腎移植である.わが国の人口が1.27億人として,人口100万人あたりの腎移植数で比較すると14.2名であるのに対し,米国では64.7名と腎移植数では約4.5倍の開きがあることが分かる.
以下にわが国の腎移植成績を示す(表1)6).今回は日本移植学会の分類を引用し,年代別生存率,生着率を1983~2000年,2001~2009年,2010~2016年の3期に分けている.生体腎移植の患者生存率は1983~2000年で1年97.0%,5年93.5%であったが,2010~2016年では99.2%,97.1%に改善している.献腎移植の患者生存率は1983~2000年で1年92.5%,5年85.8%であったが,2010~2016年では98.0%,93.1%とこちらも大いに改善している.生体腎移植のグラフト生着率は1983~2000年で1年92.9%,5年82.0%であったが2010~2016年では98.7%,94.3%に改善している.献腎移植のグラフト生着率では1983~2000年で1年81.6%,5年64.8%であったが2010~2016年では96.7%,88.0%に著明に改善している.このように腎移植成績は年代とともに著明に改善しており,これは1980年代から使用が可能となったCyAやTACが開発され,拒絶反応の抑制に非常に有効であったことが挙げられる.その後も代謝拮抗薬としてAzathioprin, Mizoribin, Mycophenorate mofetil(MMF)が使用可能となり,また抗体製剤としてBasiliximab,Rituximab,Anti-thymoglobulinが使用可能となり,最近ではmTOR阻害薬であるEverolimus(EVR)が使用可能となったことなどが成績向上につながっている.

III.先行的腎移植(Preemptive kidney transplantation:PEKT)
2000年前後からPEKTの優位性に関する報告がなされた7).PEKTは患者生存率,移植腎生着率に優れ,腎移植後の腎機能発現遅延が減少し,拒絶反応の発生率も低いことなどが報告され増加するようになった.またシャント/腹膜カテーテル手術の回避や術後の早期社会復帰の点において優れることも強調されている.最近では2018年に人工腎臓に対する導入期加算として腎代替療法/腎移植に対して十分に説明することが保険収載されてから先行的腎移植を目的とした紹介が増加している.当院でも半数以上が先行的腎移植を希望し,透析未導入の状態で紹介されてくるようになり,腎臓内科医や患者家族にも先行的腎移植が徐々に浸透し受入れられてきたと感じる.PEKTには透析を全くしない狭義のPEKTと腎移植直前に短期間透析を行う広義のPEKTがある.狭義のPEKTを希望され,透析未導入で紹介を受けても,術前検査が間に合わず,一時的な透析療法を経て腎移植を行う広義のPEKTとなる場合もありうるが,狭義,広義PEKTの両者に臨床的な差はないと言われている.今後は更にPEKTが周知されるようになれば慢性腎不全(Chronic Kidney Disease:CKD)のかなり早い段階からの紹介が増えると考えられる.しかし,あまりに早すぎる検査を行うと腎移植までの期間が開いてしまい,やり直す必要があるため,無駄を無くすには腎臓内科医との連携と計画的な術前検査と腎移植手術が必要となる.また現状ではCKD stage5で腎移植を行うのが妥当と考えられているため,残腎機能がまだ十分に残っている段階での早すぎる腎移植は慎むべきである.しかし検査がすべて終了しているにも関わらず,手術枠がないから透析導入することは避けるべきであり,移植外科やコーディネーターをはじめ,腎臓内科,麻酔科,ICUなど病院全体で腎移植治療を検討すべきである.
IV.血液型不適合生体腎移植
1989年に脾臓摘出と血漿交換を組み合わせて日本初の血液型不適合生体腎移植が行われたが8),2016年2月より抗CD20抗体であるリツキシマブが使用できるようになった.現在では脾臓摘出することなくリツキシマブと血漿交換の組み合わせで血液型不適合生体腎移植を行うことが主流となっている.また日本での血液型不適合腎移植の成績はそれ以外の血液型適合移植と遜色ないが,海外からの報告では血液型不適合移植の生存率,生着率は低いという報告もある9).わが国では血液型不適合腎移植は2017年には397例(27.7%)が行われており,献腎ドナー不足を反映し血液型不適合移植の割合が高くなっている.今後も日本から血液型不適合腎移植の成績を発信し,海外と何が違うのかを明らかにしていく必要がある.
V.献腎移植ドナー
脳死下での臓器提供が増え,他臓器ともに摘出の機会も増えている.しかし心停止下での臓器提供は腎提供がほとんどであり,レスピレーターオフを行わないために,いつ心停止となるか分からない状況となり,摘出医やドナー提供病院側は長期間の待機を強いられることがある.心停止下ではドナーのバイタルが低下した段階で大腿動静脈からカニュレーションをする施設も多いが,カニュレーション後もすぐに心停止とならず,下肢が壊死して敗血症となり提供を断念した症例や挿入していたチューブが血栓で閉塞したことも経験しており,デメリットもあることを知る必要がある.
VI.生体腎移植ドナー
最近は開腹によるドナー腎採取術は減少し,内視鏡下腎ドナー腎採取術が増加している.また日本内視鏡外科学会による技術認定制度により,技術認定医が増加している.特に2018年では完全腹腔鏡下は8.5%,完全後腹膜鏡下は15.4%であった6).ドナーの入院期間が短縮できるため今後も完全内視鏡下での手術が増加していくと考えられる.
VII.腎移植レシピエントの手術手技
初回の腎移植手術手技は確立しており,詳細は成書に譲る.最近では腎移植患者の生存率改善に伴い,2次移植,3次移植症例が増加している.通常は右腸骨窩に移植することが多く,2次移植は反対側である左腸骨窩に移植することが多い.しかし3次移植以上の場合や前回の移植腎が悪影響を来す場合は前回移植腎を摘出して同じ場所に吻合を行う必要も出てくるため,造影CTなどで動静脈の走行を慎重に確認をしてから手術計画を立てて準備する必要がある.前回の移植腎を摘出してから行う多次移植では吻合する動静脈の剥離,出血のコントロール,術後のリンパ漏に難渋することがある.
VIII.免疫抑制剤
現在はカルシニューリン阻害剤,代謝拮抗薬,ステロイドの3剤併用療法が主流である.それ以外にmTOR阻害剤を使う場合や,4剤併用の報告もある.またステロイドオフを目的としてカルシニューリン阻害剤,代謝拮抗薬,mTOR阻害剤という組み合わせの報告も散見される.最適な免疫抑制療法は確立していないが現在は病態に合わせた免疫抑制剤の選択肢の幅が広がっている.
妊娠を検討する場合は移植後1年以上経過した上で,腎機能が安定し,尿蛋白が陰性であり,高血圧や糖尿病などの合併症がコントロール可能であることを確認した上で免疫抑制剤をカルシニューリン阻害剤,アザチオプリン,ステロイドの3剤に変更し,拒絶反応がないこと,コントロール困難な高血圧,蛋白尿,糖尿病などがないことを確認してから妊娠を許可する.
IX.合併症について
1.拒絶反応
拒絶反応については術後3カ月,12カ月での定期腎生検およびエピソード腎生検を行っている.当院では腎臓内科医がBanff分類に従って,移植腎の病理標本を診断する.また週に1回は腎臓内科が移植外科,小児科の担当科と腎生検カンファレンスを行い,治療内容の検討をしている.急性T細胞性拒絶反応であればステロイドパルスかATGを,急性抗体関連型拒絶反応であれば血漿交換およびRituximabによる治療となる.よって特に拒絶反応を疑う場合,腎生検では迅速性が重要である.以前は腎生検をして診断がでるまでに数日かかっていたが,最近では腎臓内科と検査部の協力で検体処理時間が短くなった.午後に腎生検をしても特殊染色以外であれば,翌日には迅速標本ではなく永久標本による診断が可能となった.関連病院での腎生検標本は以前郵送していたが,現在ではテレパソロジーによる診断も可能となった.沖縄の関連病院などとのテレパソロジーを実際に行っているが,先方病院には腎生検標本をスキャンする設備が必要となる.
2.感染症
サイトメガロウイルス感染症:サイトメガロウイルス感染症は日和見感染症であり,免疫抑制剤が過剰であると増殖し,肺炎,網膜症などの全身の臓器障害を来す.ガンシクロビルの点滴,もしくはバルガンシクロビルの内服にて治療が可能となった.治療中にガンシクロビル耐性ウイルスとなる可能性があり,治療に難渋することがある.
BKウイルス感染症:BKウイルスは尿路に既往感染していることが多く,過剰免疫状態で尿中,血中に増殖し,BKウイルス腎症を来す.BKウイルス腎症となれば約半数がグラフトロスになると言われているため,過剰免疫抑制には注意が必要であるが,BKウイルスのDNA測定は保険適応ではないために頻繁に検査することができない.現状では尿細胞診を提出し,デコイ細胞が強陽性となれば腎生検を行うか,BKウイルスのDNAを自費での測定が必要である.一旦BKウイルス腎症となれば治療薬は存在せず,免疫抑制剤の減量や変更をするしかない.当院では検尿で尿中ウイルス感染細胞を毎回チェックしており,当日外来中に判明し,細胞診のデコイ細胞数とも相関するため免疫抑制剤の調整の参考に利用している.
3.悪性腫瘍
悪性腫瘍は2000年以降,感染症に次いで腎移植レシピエントの死亡率第2位である.悪性腫瘍のスクリーニングについては移植外科医のみでは対応できない.レシピエント本人の教育も重要であり定期検診を受けて頂く必要がある.更に,腎移植コーディネーター,メディカルアシスタント,薬剤師,腎移植内科医,小児科医,腎臓内科,透析医など,さまざまな分野の関係者が対応し,長期にわたって監視と管理していくこととなる.
X.長期予後
日本移植学会からの報告では感染症,悪性腫瘍,心疾患が3大死因であり,脳血管障害がこれに続く.最近認可されたmTOR阻害剤であるEVRは抗がん剤であるとともに,サイトメガロウイルスやBKウイルスなどの増殖を抑制するためウイルス感染症にも強いと言われている.今後長期予後の改善を達成するためには拒絶反応や感染症のコントロールのみでなく,悪性腫瘍のスクリーニングや治療,心疾患の早期発見と介入が必要となってくる.
XI.臓器提供啓発活動について
脳死は増加しているが,心停止下での臓器提供は減少しているため,腎単独の待機患者の腎移植数は減少傾向である.更に多臓器移植が優先されるようになれば脳死患者からの腎単独提供はますます減少する.最近,20歳未満のドナーは20歳未満のレシピエントに配分されるようルール改正があり,20歳未満の小児には早期の献腎移植の可能性があり,当院でもPre-emptiveでの献腎移植を2件経験した.しかしそれは20歳以上の成人の待機患者にとっては益々献腎移植が遠のくことになる.現在の臓器移植ネットワークが発表している平均待機年数は約15年となっているが,これは献腎移植を受けられた患者の平均待機年数であって,それ以外の多くの患者の待機年数は反映されていない.臓器提供はすべての臓器移植において重要であるが,特に腎移植については心停止下での臓器提供を増やしていかなければ今後の献腎移植は増えていかないであろう.臓器提供については2017年で脳死76例,心停止35例の合計111例と微増していたが2018年には脳死68例,心停止29例の合計97例と脳死,心停止ともに逆に減少してしまった.献腎移植待機患者が献腎移植を受けるためには脳死/心停止にかかわらず,地道な臓器提供啓発活動が必要である.
XII.今後の展望
これからも腎移植は増加すると考えられ,今後も移植腎の長期生着を目指すことに異論はないであろう.そのためには現在はハイリスク患者とされる既存抗体陽性患者に対する腎移植と抗体関連型拒絶反応を克服する必要がある.抗体とはドナー特異的抗体(Donor specific antibody:DSA)のことであり,既存のDSA(Preformed DSA)と新規DSA(de novo DSA)への対策が急務である.現在はまだ保険適応は無いが,既存抗体陽性レシピエントの術前脱感作療法や抗体関連型急性拒絶反応(AMR)に対するRituximabの治験が行われており,結果が期待される.また高容量免疫グロブリン療法も保険収載される可能性があり,術前脱感作療法やAMRの治療にとっては朗報であり治療の選択肢も広がる.また臨床研究として形質細胞をターゲットとしたプロテアーゼ阻害剤であるBortezomibを使用した脱感作療法の報告もあり,今後は脱感作療法やAMRの治療に対する選択肢が広がると考えられる.これまでクロスマッチ陽性で移植を断念していた患者やAMRでグラフトロスしていた患者にとって,新しい治療薬の保険収載は大いなる福音と言えるだろう.
途中でも述べたが,長期生存,生着するようになり,2次移植,3次移植の機会が増えてきた.10数年後の多次移植を考慮して移植部位や血管を決定する必要がある.また腎移植を含む多臓器移植も増えており,以前から膵腎同時移植は行われていたが,肝腎同時移植も増加してきているため対応できるように準備が必要である.さらに現在は透析患者への心臓移植の適応は無いが,海外では心腎同時移植も行われており10),成績も良好であるため,日本でも適応拡大される可能性がある.
XIII.おわりに
ブタの腎臓を使用した異種移植,ドナーの臓器にだけ拒絶反応を起こさないトレランスの誘導と免疫抑制剤の中止,iPS細胞で作成した自己遺伝子と同じ移植腎による免疫抑制剤フリーの腎移植の実現など,夢は膨らむがもうしばらくは時間がかかりそうである.
利益相反:なし
文献
1) Ullman E: Experimentelle Nierentransplantation. Wien Klin Wschr, 15: 281, 1902.
2) Merrill JP, Murray JE, Harrison JH, et al.: Successful homotransplantation of the human kidney between identical twins. JAMA, 160: 277-282, 1955.
3) 楠 隆光,井上 彦八郎:同種腎移植の臨床.日臨,14:1149,1956.
4) Liyanage T, Ninomiya T, Jha V, et al.: Worldwide access to treatment for end-stage kidney disease:a systematic review. Lancet, 385(9981): 1975-1982, 2015.
5) Fact book 2018 of organ transplantation in Japan: http://www.asas.or.jp/jst/pdf/factbook/factbook2018.pdf
6) 八木 澤隆:腎移植臨床登録集計報告(2018)2017年実施症例の集計報告と追跡調査結果.移植,53(2/3): 89-108,2018.
7) Meier-Kriesche HU, Kaplan B: Waiting time on dialysis as the strongest modifiable risk factor for renal transplant outcomes:a paired donor kidney analysis. Transplantation, 74(10): 1377-1381, 2002.
8) Takahashi K, Agishi T, Oba S, et al.: Extracorporeal plasma treatment for extending indication of kidney transplantation:ABO-incompatible and performed antibody-positive kidney transplantation.:Therapeutic Plasmapheresis IX. Cleveland:ESAO Press, 61-63, 1990.
9) Scurt FG, Ewert L, Mertens PR, et al.: Clinical outcomes after ABO-incompatible renal transplantation:a systematic review and meta-analysis. Lancet, 393(10185): 2059-2072, 2019.
10) Awad M, Czer LS, Esmailian F, et al.: Combined Heart and Kidney Transplantation:A 23-Year Experience. Transplant Proc, 49(2): 348-353, 2017.
PDFを閲覧するためには Adobe Reader が必要です。