日外会誌. 121(1): 19-26, 2020
特集
蛍光ガイド手術の現状と展望
3.消化管腫瘍に対する蛍光ガイド手術の進展
|
国際医療福祉大学病院 外科 吉田 昌 , 大平 寛典 , 星本 相淳 , 鈴木 範彦 , 成廣 哲史 , 丸口 塁 , 鎌田 哲平 , 竹内 秀之 , 鈴木 裕 |
近赤外蛍光の特徴は,組織透過性であり,深部に隠れた構造物を可視化することができる.最も汎用されるのは,Indocyanine green(ICG)である.消化管における血流評価では,虚血域を評価して切除範囲の判断をナビゲーションする場合や,食道癌・大腸癌切除後に再建時の血流評価に用いられてきた.胃癌におけるセンチネルノードマッピングにおいては,投与方法は統一されていないが,検出されるセンチネルノードの数がおおむね5~7個となる方法での成績が良好である.一方,近赤外蛍光を利用した消耗品の開発が待たれていたが,腫瘍位置のマーキングに用いる蛍光クリップが近日中に発売可能な状態にある.可視光を利用した蛍光ガイド手術としては,5-アミノレブリン酸(5-ALA)を用いた光力学診断法がある.手術前に5-ALAを投与すると,腫瘍にprotoporphyrin Ⅸ(PpⅨ)が蓄積するため,405nmの励起光を当てると,腫瘍は635nmの波長をもつ赤い蛍光を発する.もう一つの可視蛍光としては,Fluorescein蛍光があり,臓器表面の組織血流を評価するのにICGよりも優れている可能性がある.本稿では,現在起きつつある変化と,近い将来,すぐにでも使用可能なことについて概説した.
キーワード
Indocyanine green, fluorescent clip, 5-aminolevulinic acid, protoporphyrin Ⅸ, fluorescein
I.はじめに
血管・血流・リンパ管・リンパ節・胆管・腫瘍などの構造物や機能(病態)を蛍光ラベルし,蛍光をナビゲーションとして活用する蛍光ガイド手術は,ラベルされる構造・機能,蛍光プローブ,蛍光カメラの組み合わせで様々な応用が試みられている.これまでの発展には蛍光カメラの開発に依存するところが大きかった.最も貢献してきたのは,浜松ホトニクス株式会社のPhotodynamic Eye(PDE)のシリーズである.2010年にミズホ株式会社が明視野・フルカラーのHyperEye Medical System(HEMS)を発売すると,蛍光を確認しながら手術を同時進行することが可能となったばかりか,蛍光の評価方法にも変化が生まれてきている.2016年12月に明視野・フルカラーの腹腔鏡(外科手術用内視鏡システム)であるPINPOINTが発売されると,HEMSの特性が完全腹腔鏡手術でも活かされるようになった.さらに,オリンパス株式会社が,フルカラーではないが,明視野観察可能な外科手術用内視鏡システム(Visera Elite Ⅱ)を発売するに至り,蛍光ガイド手術が一般化してきている.
現在,蛍光ガイド手術に最も汎用されているのは,前述のカメラを用いた,近赤外蛍光である.近赤外蛍光は組織透過性があり,1cm程度であれば,深部に隠れた構造物を可視化することができるからである.一方,可視蛍光による蛍光ガイド手術も,技術的にはすぐに利用可能な状態にあり,その臨床応用・普及に期待したい.本稿では,まず近赤外蛍光,次に可視蛍光について言及する.
II.近赤外蛍光
蛍光とは,物質が励起光を吸収し,吸収した光の波長と異なる波長の光を放射することであり,通常,励起光よりも蛍光の波長は長くなり,エネルギーはより小さい.したがって,組織透過性のある深部蛍光を得るためには,励起光も蛍光もともに近赤外線である必要がある.ICGは励起光のピークはおよそ805nm,蛍光のピークはおよそ830nmであり,組織透過性に優れている.
II-1.ICG蛍光によるセンチネルリンパ節の検出
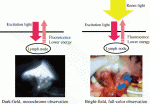
赤外線カメラを用いた報告はNimura,Mitsumoriら1)のセンチネルノード検出での2004年の報告が最初である.東京慈恵会医科大学にいた仁村先生が,手術中に使用する内視鏡システムを内視鏡室に取りに行った際,内科の先生から,ICGでリンパをみるのであれば,赤外線カメラでみたらどうか,と提案されたのが始まりと伺っている.また,Kusanoら2)は2008年(3月)に,ICG蛍光法によるSNの検出を,胃癌22例と大腸癌26例での検討を報告した.この時のSNの数は1患者あたり,3.6±4.5であり,accuracy88.9%,false-negative は33.3%であった.その後,Ohdaira ら3), Takahashi ら4)5)により,ICG吸光法・蛍光法の正診率が高いことが報告されている.ICG蛍光法以外での,胃癌におけるセンチネルノードの報告は,蛍光カメラを使用しない,ICG色素法単独の多施設共同研究においては,false negativeが46%と高く,この共同研究は途中で中止された6).この時の検出されたセンチネルノードの1例あたりの中央値は4個であった.一方,Technetium 99m tin colloid solution(0.5 mL×4 points)と1%isosulfan blue dyeによるDual tracer methodを用いた多施設共同研究におけるKitagawaら7)の報告では,Sentinel nodeの正診率99%と良好な結果となり,これを根拠にSentinel node navigationによる縮小手術の多施設共同研究が行われている.したがって,この報告が胃癌におけるsentinel node mappingの基準となっており,一人当たりのsentinel nodeの数は平均で5.6個であった.ICG蛍光法は放射線管理区域内に内視鏡を常備する必要がない方法である.より簡便な方法で,Dual tracer methodと同等の成績を目指していることになる.Kinamiら8)は72例の胃癌患者における検討を報告している.手術前日に50μg/mlのICGを0.5mlずつ4箇所腫瘍部粘膜下層に局所注射する方法が良く,正診率98.6%(71/72)とDual tracer methodと同等の結果を報告した.この報告ではPDEを用いてBright nodesを検出しているが,術中検出における患者一人あたりの個数(中央値)が5個(術後のみに検出した14例),または6個(術中・術後に検出)であり,Dual tracer methodと同等であった.筆者らは,世界初の明視野・フルカラー蛍光カメラであるHyperEye Medical System(HEMS)の佐藤隆幸教授(高知大学)による開発9)に参加し,2008年から臨床使用してきた.明視野・フルカラーで観察し,ICGの投与濃度と局注のタイミングを検討すると,Kinamiら8)の方法と同じ50μg/mlの術前日投与であった9).この条件で,HEMSの励起光を点滅させる機能を使用すると,概ねSentinel Nodeのみが光って見える.Room lightにより,暗いICG蛍光が見にくくなるため(図1),Bright nodeの選択がしやすくなる.さらに,2014年から明視野・フルカラーの蛍光腹腔鏡PINPOINT(stryker, Kalamazoo,MI,USA:2016年11月日本薬事承認取得)を個人輸入して使用してきた11).Scopeの開発経過に伴い,条件は多少変化したが,現在は,同様に50μg/mlの術前日投与を行っている.
この投与条件でも図2Aのように原発巣からリンパ管・リンパ節が描出されるので,1日かけて少しずつICGがセンチネルリンパ節に流入するため,2次以降のリンパ節との濃度差が出やすいと推察している.Back tableでのリンパ節の観察においてもHEMS同様に,room light下での明視野・フルカラー観察の利点がある(図2B).HEMSとPINPOINTを合わせて86例で全例Sentinel nodeが検出され,一人当たりのSentinel nodeの数は平均で5.5個であった.また,転移例全てでSentinel nodeに転移を認めている.現在,ICG蛍光法のICG投与濃度とタイミングは,施設によって統一されているわけではない.筆者らは,投与濃度とタイミングにかかわらず,蛍光強度が高いリンパ節から平均6~7個のリンパ節を検出できればよいのではないかと考えている.前述のDual tracer methodで平均5.6個であったこと,ICG蛍光法で良好な成績の報告は同等の個数であったこと,過去にfalse negativeが多かった報告では4個以下であったからである.一方で,10個以上のSentinel nodeが頻繁に出るようであると,迅速診断に適さないので,一定数以内に収まることが望ましい.Okubo,Uenosono らは,Technetium 99m tin colloid solutionと同時にICG蛍光法を行い,ICG蛍光強度の高いものから6個を選べば,RIで選んだsentinel nodeの92.1%をカバーできると報告している12).現在注目しているのは,VISIONSENCE(Medtronic, Minneapolis)の励起光強度調節機能である.励起光の強度を上げるとICG蛍光強度の低いリンパ節も光ることから,リンパ節の蛍光強度の違いを確認しながら一定数のリンパ節を選択することができる.また,蛍光強度の比を観察しながらその場で数値化できることも強みである.現在使用を開始した状況で,この機能の利点を検証してゆく.
II-2.ICG蛍光による血流評価
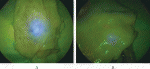
ICGは静注すると,アルブミンと結合し,血流によって運搬される.したがって,静注の後,蛍光カメラで観察すると血管・血流を観察することができる.筆者らもnon-occlusive mesenteric ischemia(NOMI)での切除範囲の決定13)や,食道切除術後の再建胃管や結腸の血流評価などで使用してきた14).Koyanagi,Ozawa らは,食道癌患者における食道切除後挙上胃管の胃壁血流と胃大網動静脈の血流を比較し,胃壁血流が遅いと有意に縫合不全が起きやすいと報告している15).ICG蛍光による血流評価が世界的に普及する契機の一つとなった報告は,JafariらのPILLARⅡ(Perfusion Assessment in Laparoscopic Left-Sided/Anterior Resection)Study16)と言える.この検討では,左半結腸切除術または前方切除術において,通常の判断で切除線を決め,マークしておき,口側切除前にICG蛍光法で血流評価をし,さらに,吻合終了後にもう一度ICG蛍光法で,経肛門的に血流評価をした.口側切除前のICG蛍光法評価で通常観察での判断よりも血流が悪く,切除線を変更した場合が9/139例(6.5%),吻合後に経肛門的血流評価をして,吻合をやり直すなどの変更を加えた症例が2例あった.したがって,ICG蛍光法による血流評価で手術方針変更をした症例が,11/139例(7.9%)存在した.このICG蛍光法による経肛門評価であるが,筆者らは,腹腔鏡手術の12mmのトラカールを肛門に挿入し,注意深く送気して観察している(図3).また,切除範囲の決定に,切除側主幹動脈からICG造影を行い,還流域を切除する方法も行っている17)(図4).
II-3.近赤外蛍光:蛍光クリップの開発
消化管手術では腹腔鏡下に手術されることが年々増加してきており,腫瘍の位置を触覚に頼らずに正確に把握することが求められている.筆者らは,高知大学の佐藤隆幸教授を発端とする蛍光クリップの開発に協力してきた.図5Aは,開発途中の蛍光クリップをブタ大腸の内腔に置き,Karl Storzの外科手術用蛍光内視鏡システムで観察した画像である.近赤外線の組織透過性により,内腔に置かれたクリップの位置を漿膜側から確認可能である.図5Bは同じくブタの胃である.ブタの胃壁はヒトよりも厚いが,内腔に置かれたクリップの位置を漿膜側から確認可能であった.この近赤外線蛍光クリップであるが,その後改良が加えられ,近日中に発売可能な状態にある.



III.可視蛍光
III-1.5-aminolevulinic acid induced protoporphyrin Ⅸ蛍光によるPhotodynamic diagnosis
5-ALAを用いた光力学診断法(photodynamic diagnostics:PDD)は安全性と有用性を兼ね備えており,悪性神経膠腫および膀胱癌において臨床使用されている.5-ALAは生体内に存在するアミノ酸で,有核細胞でのヘム合成に密接に係わっている.特に癌細胞ではヘム合成経路の酵素活性に異状を呈している.すなわち,5-ALAを分解し,PpⅨを合成する酵素の一つであるporphobilinogenの活性亢進と,PpⅨを分解する酵素の一つであるferrochelataseの活性低下などにより,PpⅨが癌細胞内に蓄積する.5-ALAは蛍光を発しないが,PpⅨに405nmの青紫の励起光を当てると,PpⅨは635nmの赤い蛍光を発する.したがって,手術前に5-ALAを蛍光投与すると,腫瘍を光らせながら手術を行うことができる.特徴的なのは,励起光も蛍光も可視光の範囲にあることである.消化管腫瘍では,現在,進行胃癌の腹膜播種性転移などの診断で多施設共同研究が進行中である18).
一般に,5-ALAによるPpⅨ蛍光によるPDDには特殊な外科手術用蛍光内視鏡システムが必要と感じられている場合が多いようである.ところが,PpⅨの励起光と蛍光は可視光であり,近赤外線蛍光のように,レンズなどの光学機器によって減衰する要素を考える必要がない.実際,安価な(数百円)405nmの波長を出すLEDを購入すれば,観察可能であった(図6).図6Aは,通常のルームライトによるPpⅨの観察,図6Bは405nmの波長を出すLEDライトを当てた状況である.さらに,図6Cのように405nmの光をカットするフィルターを使用すると,余分な光が消えて,PpⅨの蛍光のみを鮮明に観察することができる.このような光学的な工夫に加えて,デジタル技術で最適化すれば,生体内で観察しやすいカメラは,数多く開発可能と考える.今後の展開は,技術的にはすぐにでも発展できるものである.
III-2.Fluorescein蛍光
Fluoresceinの蛍光は眼科や脳外科で使用されている蛍光で,励起光のピークは約480nm,蛍光のピークは約525nmと可視蛍光である.血流・血管を観察するために使用される.特に励起光に組織透過性がないために,少し太い血管になると,血管壁を透過せずに蛍光を観察できない.脳神経外科で手術用顕微鏡を用いた検討では,径0.5mmの血管はICGもFluoresceinも描出可能であるが,0.1mmの細動脈はFluoresceinの方が鮮明に描出されている19).臓器表層の組織血流(微小循環)はFluoresceinの方が,鮮明に描出できる可能性がある.筆者らがブタで行ったPreliminaryな検討では,ICG蛍光法よりもFluoresceinのほうが漿膜還流を判断しやすい場合と,腸管の虚血域境界がより鮮明に描出できる場合があった.

IV.おわりに
本稿では,現在起きつつある変化と,近い将来,すぐにでも使用可能なことについて概説した.これに加えて,腫瘍蛍光などで新規プローブの開発が行われているため,蛍光ガイド手術の進展は大きな可能性を秘めている.さらに,イメージ技術やロボット手術と統合して,日常診療にルーチン化してゆく方向性を持っている.今後の進展に期待したい.
利益相反:なし
文献
1) Nimura H, Narimiya N, Mitsumori N, et al.: Infrared ray electronic endoscopy combined with indocyanine green injection for detection of sentinel nodes of patients with gastric cancer. Br J Surg, 9: 575-579, 2004.
2) Kusano M, Tajima Y, Yamazaki K, et al.: Sentinel node mapping guided by indocyanine green fluorescence imaging:a new method for sentinel node navigation surgery in gastrointestinal cancer. Dig Surg, 25: 103-108, 2008.
3) Ohdaira H, Nimura H, Fujita T, et al.: Tailoring treatment for early gastric cancer after endoscopic resection using sentinel node navigation with infrared ray electronic endoscopy combined with indocyanine green injection. Dig Surg, 26: 276-281, 2009.
4) Takahashi N, Nimura H, Fujita T, et al.: Laparoscopic sentinel node navigation surgery for early gastric cancer:a prospective multicenter trial. Langenbecks Arch Surg, 402: 27-32, 2017.
5) Takahashi N, Nimura H, Fujisaki M, et al.: A dual infrared ray imaging system for sentinel node mapping against gastric cancer:absorption and fluorescence methods by infrared ray laparoscopy system combined with indocyanine green. in Fluorescence Imaging for Surgeons. In:Dip FD, Ishizawa T, Kokudo N, Rosental RJ (eds), Springer, New York, pp237-241, 2015.
6) Miyashiro I, Hiratsuka M, Sasako M, et al.: High false-negative proportion of intraoperative histological examination as a serious problem for clinical application of sentinel node biopsy for early gastric cancer:Final results of the Japan Clinical Oncology Group multicenter trial JCOG0302. Gastric Cancer, 17: 316-323, 2014.
7) Kitagawa Y, Takeuchi H, Takagi Y, et al.: Sentinel Node Mapping for Gastric Cancer:A Prospective Multicenter Trial in Japan. J Clin Oncol, 31: 3704-3710, 2013.
8) Kinami S, Oonishi T, Fujita J: Optimal settings and accuracy of indocyanine green fluorescence imaging for sentinel node biopsy in early gastric cancer. ONCOLOGY LETTERS, 11: 4055-4062, 2016.
9) 佐藤 隆幸:近赤外蛍光を利用した血管・血流,リンパ管・リンパ流・リンパ節のカラーイメージング装置の開発.Medical Photonics, 2: 45-47, 2010.
10) Yoshida M, Kubota K, Kuroda J, et al.: Indocyanine green injection for detecting sentinel nodes using color fluorescence camera in the laparoscopy-assisted gastrectomy. J Gastroenterol Hepatol, 27(Suppl 3): 29-33, 2012.
11) Ohdaira H, Yoshida M, Okada S, et al.: New method of indocyanine green fluorescence sentinel node mapping for early gastric cancer. Annals Med Surg, 20: 61-65, 2017.
12) Okubo K, Uenosono Y, Arigami T, et al.: Quantitative assessment of fluorescence intensity of ICG in sentinel nodes in early gastric cancer. Gastric Cancer, 21: 776-781, 2018.
13) Nitori N, Deguchi T, Kubota K, et al.: Successful treatment of non-occlusive mesenteric ischemia (NOMI) using the HyperEye Medical SystemTM for intraoperative visualization of the mesenteric and bowel circulation:report of a case. Surg Today, 44: 359-362, 2014.
14) Kubota K, Yoshida M, Kuroda J, et al.: Application of the HyperEye Medical System for esophageal cancer surgery:a preliminary report. Surg Today, 43: 215-220, 2013.
15) Koyanagi K, Ozawa S, Oguma J, et al.: Blood flow speed of the gastric conduit assessed by indocyanine green fluorescence New predictive evaluation of anastomotic leakage after esophagectomy. Medicine, 95: 30(e4386), 2016.
16) Jafari M, Wexner S, Martz J, et al.: Perfusion Assessment in Laparoscopic Left-Sided/Anterior Resection (PILLAR II):A Multi-Institutional Study. J Am Coll Surg, 220: 82-92, 2015.
17) Ryu S, Yoshida M, Ohdaira H, et al.: Intraoperative ICG fluorescence contrast imaging of the main arterywatershed area in colorectal cancer surgery:Report of a case. International Journal of Surgery Case Reports, 26: 176-178, 2016.
18) Namikawa T, Iwabu J, Munekage M, et al.: Evolution of photodynamic medicine based on fluorescence image-guided diagnosis using indocyanine green and 5-aminolevulinic acid. Surg Today, 2019. doi:10.1007/s00595-019-01851-4. [Epub ahead of print]
19) 鈴木 恭一,渡部 洋一,市川 剛:Fluorescein sodiumを用いた術中蛍光脳血管撮影による脳血流の評価.脳卒中の外,37: 240-245, 2009.
PDFを閲覧するためには Adobe Reader が必要です。