日外会誌. 121(1): 11-18, 2020
特集
蛍光ガイド手術の現状と展望
2.肝胆膵領域における蛍光ガイド手術の進展
|
東京大学大学院 医学系研究科外科学専攻肝胆膵外科 石沢 武彰 , 市田 晃彦 , 赤松 延久 , 金子 順一 , 有田 淳一 , 長谷川 潔 |
肝胆膵外科では,indocyanine green(ICG)が持つ蛍光特性と胆汁排泄性の両者を利用することにより,本剤を蛍光プローブとして用いた術中イメージングを1)肝外胆管の描出(蛍光胆道造影),2)肝癌の同定,3)肝区域の描出,4)組織血流評価,などの多様な用途に応用することができる.これらの方法はいずれも簡便かつ高感度であり,特に触診による情報が得られにくい腹腔鏡下手術における術中ナビゲーション技術として国内外で普及しつつある.同時に,標的特異性の高い新規蛍光プローブや,高画質化や蛍光強度の測定に対応した新型の撮像装置も盛んに開発されている.さらに,腫瘍に蛍光プローブが集積する現象を術中診断だけでなく光線力学的療法などの治療に応用する技術の検討も進んでいる.今後,外科医と研究者,エンジニアが積極的に情報交換を行うことにより,術中蛍光イメージングが「簡便で便利」な診断法に留まらず,肝胆膵手術の治療成績向上に直結する技術に発展することが期待されている.
キーワード
蛍光胆道造影, インドシアニングリーン, 肝切除, 肝腫瘍, 胆嚢摘出術
I.はじめに
近年,ICGなどの蛍光プローブを用いて手術中に生体構造を描出する技術(術中蛍光イメージング)が様々な術式で活用されつつある.本邦の肝胆膵外科では,ICGは長らく「肝機能検査用試薬」として広く用いられて来たためか,心臓血管外科や乳腺外科領域と比べて,本剤の蛍光特性がなかなか注目されず手術への応用が遅れた印象がある.しかし,肝胆膵外科ではICGの蛍光特性に加えて胆汁排泄性を利用することができるので,蛍光イメージングの対象としては最適であり潜在的な適用範囲は広いと考えられる.実際,Aokiらによる肝区域同定法の報告1)を端緒として,ICGを用いた蛍光イメージングが胆道造影や肝癌の同定など様々な用途に利用されるようになり,この10年間で臨床応用が急速に進展した.
本章では,まず術中蛍光イメージングを用いた肝胆膵外科手術(蛍光ガイド手術)の実際を概説する.また,ICGを用いた蛍光イメージングの課題を解決するための新しい技術や,光線力学療法などの治療への発展性についても紹介したい.
II.蛍光胆道造影法
「手術中にICGを静注すると近赤外光照射下に胆汁が光る」ことは,蛍光イメージングを肝移植術中のグラフト評価に応用したKubotaらの論文(2006年2))で紹介されている.2008年には,Mitsuhashiら3)がこの現象を胆管解剖の描出に応用できることを示した.筆者らは,希釈したICG溶液(0.025mg/mL)を造影用カテーテルから胆管内に注入する,あるいはICG(2.5mg)を静注して胆汁排泄を待つことにより,開腹手術4)や腹腔鏡下手術5)の術中に肝外胆管を描出する技術を報告し,これを「fluorescent (fluorescence) cholangiography(蛍光胆道造影)」と名付けた.
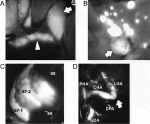
X線を用いた従来の術中胆道造影法と比較した場合の蛍光胆道造影法の最大の利点は,胆管内にカニュレーションすることなく,条件が良ければ肝十二指腸間膜を剥離する前から胆管像が得られる点である(図1A).この観点から,本法の最も良い適応は腹腔鏡下胆摘術であると考えられる.事実,本邦からの初例報告6)以来,欧米を中心に蛍光胆道造影法が腹腔鏡あるいはロボット支援下胆摘術に積極的に応用され,その有効性を示唆する論文報告もすでに1,000例を超える症例が集積している(表1).そして昨年(2019年),蛍光胆道造影の方が白色光カラー光による通常観察よりも肝外胆管の同定率が優れることを示す国際多施設RCTの結果が公表された7).本技術の意義については,胆摘術中の胆道損傷回避を目指した国際コンセンサス会議でもクリニカルクエスチョンとして取り上げられている(https://www.preventbdi.org/wp-content/uploads/2019/02/Presentations-PICO-4-5-6-7-and-9-Recommendations.pdf).2018年の時点では,「ルーチンな手技として推奨するには根拠が不十分であり,RCTの結果が待たれる」と結論されたが,先に述べたようなRCTの結果を受け,今後の検討を経てどのように位置づけられるか注目される.
III.肝癌同定法
筆者は2007年のある日,術中蛍光胆道造影のために胆管内にICG溶液を注入しようとした際,肝被膜下にある腫瘍(肝細胞癌)がすでに蛍光を呈していることに気が付いた4).その患者は肝機能評価のために術前にICG15分停滞率の測定を受けていたため,この時に静注されたICG(0.5mg/kg)が何かしらの機序で癌組織に蓄積したものと推測し,その後の肝切除症例で標本の腫瘍割面を赤外観察装置で撮影してICGの分布を調査した.結果,静注後のICGは分化型の肝細胞癌では腫瘍組織内部に,低分化肝細胞癌や転移性肝癌では腫瘍周囲の非癌部肝実質に滞留する傾向が認められた8).さらに免疫染色や遺伝子発現解析を追加することで,ICGが肝細胞癌の内部または周囲に集積する機序が明らかになった.すなわち,分化度の高い肝細胞癌組織では,ICG取り込みに関与するトランスポーター(NTCP, Na+/taurocholate cotransporting polypeptideとOATP8, organic aniontransporting polypeptide 8)の発現が比較的保たれているが,胆汁排泄過程に機能的あるいは形態的な異常があるために,ICGが癌組織の内部に滞留する.一方,低分化の肝細胞癌ではこれらのトランスポーターの発現に乏しく,ICGは癌組織に取り込まれないが,周囲の非癌部肝実質に胆汁排泄の遷延があるために,腫瘍を取り囲むようにICGが滞留する9).後者のメカニズムに関して,オランダの研究グループは,同部位に胆汁排泄能の低い未成熟な肝細胞が存在するためであると報告している10).
手術中に肝表面から近赤外光を照射する場合には,上記のICG分布パターンに関わらず,腫瘍内部あるいは周囲から発せられる蛍光シグナルをガイドとして腫瘍の位置を検出することができる(図1B)8)11).これがICG蛍光イメージングによる肝癌診断法の原理であり,簡便(手術から約2週間以内にICG15分停滞率を測定しておけばよい)かつ高感度であるという特徴がある.本法には疑陽性率が比較的高く(~40%),蛍光の組織透過性に限界がある(約8mmまで)などの課題もあるが,特に腹腔鏡下手術において触診の代用として肝被膜下の腫瘍を確認するために有用であり12),低侵襲手術の普及とともに今後応用が進むと予想される.同時に,蛍光イメージングによる肝癌診断能を向上させるため,5-aminolevulinic acid13)や新規プローブ14)を用いる試みも報告されている.

IV.肝区域の描出
解剖学的な境界に沿って正確に肝区域切除を行うことは,肝細胞癌切除後の再発率を低減させるために重要であり,胆汁漏や残肝の虚血などの合併症を低減させるうえでも有効であると考えられている.従来,手術中に肝区域の境界を同定するためには,グリソン一括処理や,超音波ガイド下にインジゴカルミン溶液を門脈枝に注入する染色法が用いられてきた.しかし,再切除症例や肝硬変症例では,虚血や染色に伴う肝表面の色調変化が視認しにくい場合があった.
2008年に,Aokiら1)はICG溶液を担癌門脈枝に注入し,蛍光イメージングによって肝区域を描出する方法を報告した.筆者らは2012年に,このICG門脈内注入による区域同定法が腹腔鏡下手術でも再現できること,また担癌肝区域のグリソン鞘を先行処理してICGを静注することにより蛍光シグナル欠損域として肝区域が同定できることを報告し,それぞれpositive staining technique,negative staining techniqueと分類した15).このうちpositive staining techniqueでは,門脈内投与後に肝を通過したICGが体循環から再度門脈に入り,肝全体が蛍光を呈すことを回避することが特に重要である(図1C).近年の報告では,ごく少量のICG(0.25~2.5mg)を門脈内に注入することが多い15)16).一方negative staining techniqueでは,ICG 2.5mgを静注することが一般的である.いずれの方法でも,一度肝細胞に取り込まれたICGの蛍光は6時間以上持続するので,肝離断中にも肝区域境界を確認できる点が虚血や染色法と比べた場合の蛍光イメージングの長所である.
近年,画像診断技術の向上により,門脈系の解剖だけでなく肝静脈の支配領域も術前にシミュレーションできるようになった.術後の肝機能障害を回避するためには,主肝静脈切除に伴う静脈閉塞領域(便宜上,肝うっ血域と呼ばれる)の範囲と機能を推定することが重要になるが,Kawaguchiら17)は手術中にICGを静注し蛍光像を撮影することにより,肝うっ血域の範囲と門脈取り込み能を評価する方法を報告した.肝うっ血域の肝機能はゼロではないので,必ずしも切除を要さないが,腫瘍の位置によっては,肝うっ血域の程度と範囲を蛍光イメージングで描出することが肝切離線の決定に有用な場合がある18).

V.膵手術への応用
肝切除ではICGの胆汁排泄性を利用して肝癌や胆管を蛍光標識できたが,同じように膵切除で膵癌や膵液を描出することは難しい.ICG静注による蛍光イメージングを,腹腔鏡下膵切除中に膵神経内分泌腫瘍を同定するために利用した報告19)はあるが,臨床使用に耐える十分なコントラストが得られるか追加検討が必要である.一方,ICG蛍光イメージングは血管再建の要否判断や再建後の血流評価に有効である可能性がある(図1D).例えば,腹腔動脈幹合併膵体尾部切除において,ICG 2.5mgを静注した後に蛍光イメージングを実施することにより,左胃動脈および胃壁の血流を評価することができる20).ICGを局注することにより膵周囲のリンパ流・リンパ節を描出することも可能である21).膵癌の切除にセンチネルリンパ節生検の概念が適用できるか不明であるが,膵・十二指腸のリンパ流路を解明することは郭清範囲を最適化するために役立つ可能性がある.
前臨床段階では,膵癌を特異的に標識する新規蛍光プローブが活発に開発されており,海外では臨床治験に進展している技術もある22).筆者らは蛋白分解酵素と反応し膵液を蛍光標識する新規プローブを開発しており23),膵液漏出部位の同定や術後膵液漏のリスク評価に応用可能か検討を続けている.

VI.課題と将来展望
術中蛍光イメージングの普及と発展に向けた第1の問題は,蛍光試薬としての特性を持つ既存の薬剤のなかで,術中蛍光イメージングとしての用途が薬事承認されているものが非常に限定されている点である(表2).一定の手術成績が得られるようになった今日の外科臨床で,合併症率や切除率の改善を主要評価項目として蛍光イメージングの有用性を評価する臨床試験をデザインすることは困難だが,そのような状況下でなるべく質の高いエビデンスを構築し,保険適応の取得を目指す取り組みが求められている.例えば静注法による蛍光胆道造影は公知申請の枠組みを利用できる可能性がある.一方,原理的には静注より副作用のリスクが低いはずの胆管内注入法では,新規投与経路となるため承認申請に困難が予想されるという矛盾もある.
技術的な課題としては,癌診断の特異度改善,血流の定量評価法の確立,4K/3D対応を含む画質向上,などが挙げられるが,少なくとも撮像システムに関しては,これらの課題に対応した新規モデルが市場に投入されていくものと予想される.新規蛍光プローブの開発も活発だが,特に癌を蛍光標識する技術は,術中診断に留まらず新規抗癌剤の開発24)や光線力学的療法・光免疫療法などの治療に発展する可能性を内包している25)26).これらの課題に対応するために,2014年に国際研究会であるISFGS(International Society for Fluorescence Guided Surgery, www.isfgs.org)が,2018年には本邦でも日本蛍光ガイド手術研究会(http://plaza.umin.ac.jp/jsfgs/index.html)が発足した.これらの組織を通じて,外科医だけでなく研究者や企業のエンジニアとの情報交換が進み,真に有効な技術が迅速に実臨床に導入されることが期待される.

VII.おわりに
一般的に,肝胆膵外科の対象は難治癌が多く,術後合併症も高率かつ重篤である.本章で述べたように,術中蛍光イメージングが「簡便かつ便利な技術」として多様な用途に利用できることは十分に示されてきたが,今後はこの枠を超えて,「手術成績の向上に直接寄与する技術」に発展するよう開発を継続することが求められている.
利益相反
研究費:公益財団法人中谷医工計測技術振興財団
文献
1) Aoki T, Yasuda D, Shimizu Y, et al.: Image-guided liver mapping using fluorescence navigation system with indocyanine green for anatomical hepatic resection. World J Surg, 32: 1763-1767, 2008.
2) Kubota K, Kita J, Shimoda M, et al.: Intraoperative assessment of reconstructed vessels in living-donor liver transplantation, using a novel fluorescence imaging technique. J Hepatobiliary Pancreat Surg, 13: 100-104, 2006.
3) Mitsuhashi N, Kimura F, Shimizu H, et al.: Usefulness of intraoperative fluorescence imaging to evaluate local anatomy in hepatobiliary surgery. J Hepatobiliary Pancreat Surg, 15: 508-514, 2008.
4) Ishizawa T, Tamura S, Masuda K, et al.: Intraoperative fluorescent cholangiography using indocyanine green:a biliary road map for safe surgery. J Am Coll Surg, 208:e1-4, 2008.
5) Ishizawa T, Bandai Y, Ijichi M, et al.: Fluorescent cholangiography illuminating the biliary tree during laparoscopic cholecystectomy. Br J Surg, 97: 1369-1377, 2010.
6) Ishizawa T, Bandai Y, Kokudo N: Fluorescent cholangiography using indocyanine green for laparoscopic cholecystectomy: an initial experience. Arch Surg, 144: 381-382, 2009.
7) Dip F, LoMenzo E, Sarotto L, et al.: Randomized trial of near-infrared incisionless fluorescent cholangiography. Ann Surg, 270: 992-999, 2019.
8) Ishizawa T, Fukushima N, Shibahara J, et al.: Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer, 115: 2491-2504, 2009.
9) Ishizawa T, Masuda K, Urano Y, et al.: Mechanistic background and clinical applications of indocyanine green fluorescence imaging of hepatocellular carcinoma. Ann Surg Oncol, 21: 440-448, 2014.
10) van der Vorst JR, Schaafsma BE, Hutteman M, et al.: Near-infrared fluorescence-guided resection of colorectal liver metastases. Cancer, 119: 3411-3418, 2013.
11) Gotoh K, Yamada T, Ishikawa O, et al.: A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol, 100: 75-79, 2009.
12) Terasawa M, Ishizawa T, Saiura A, et al.: Applications of fusion fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc, 31: 5111-5118, 2017.
13) Kaibori M, Matsui K, Ishizaki M, et al.: Intraoperative detection of superficial liver tumors by fluorescence imaging using indocyanine green and 5-aminolevulinic acid. Anticancer Res, 36: 1841-1849, 2016.
14) Miyata Y, Ishizawa T, Kamiya M, et al.: Intraoperative imaging of hepatic cancers using γ-glutamyltranspeptidase-specific fluorophore enabling real-time identification and estimation of recurrence. Sci Rep, 7: 3542, 2017.
15) Ishizawa T, Zuker NB, Kokudo N, et al.: Positive and negative staining of hepatic segments by use of fluorescent imaging techniques during laparoscopic hepatectomy. Arch Surg, 147: 393-394, 2012.
16) Inoue Y, Arita J, Sakamoto T, et al.: Anatomical liver resections guided by 3-dimensional parenchymal staining using fusion indocyanine green fluorescence imaging. Ann Surg, 262: 105-111, 2015.
17) Kawaguchi Y, Ishizawa T, Miyata Y, et al.: Portal uptake function in veno-occlusive regions evaluated by real-time fluorescent imaging using indocyanine green. J Hepatol, 58: 247-253, 2013.
18) Inoue Y, Saiura A, Arita J, et al.: Hepatic vein-oriented liver resection using fusion indocyanine green fluorescence imaging. Ann Surg, 262:e98-e99, 2015.
19) Paiella S, De Pastena M, Landoni L, et al.: Is there a role for near-infrared technology in laparoscopic resection of pancreatic neuroendocrine tumors? Results of the COLPAN “colour-and-resect the pancreas” study. Surg Endosc, 31: 4478-4484, 2017.
20) Oba A, Inoue Y, Sato T, et al.: Impact of indocyanine green-fluorescence imaging on distal pancreatectomy with celiac axis resection combined with reconstruction of the left gastric artery. HPB (Oxford), 21: 619-625, 2019.
21) Hirono S, Tani M, Kawai M, et al.: Identification of the lymphatic drainage pathways from the pancreatic head guided by indocyanine green fluorescence imaging during pancreaticoduodenectomy. Dig Surg, 29: 132-139, 2012.
22) Hoogstins CES, Boogerd LSF, Sibinga Mulder BG, et al.: Image-guided surgery in patients with pancreatic cancer:first results of a clinical trial using SGM-101, a novel carcinoembryonic antigen-targeting, near-infrared fluorescent agent. Ann Surg Oncol, 25: 3350-3357, 2018.
23) Yamashita S, Sakabe M, Ishizawa T, et al.: Visualization of the leakage of pancreatic juice using a chymotrypsin-activated fluorescent probe. Br J Surg, 100: 1220-1228, 2013.
24) Inagaki Y, Kokudo T, Kamiya M, et al.: A novel liver-specific fluorescent anti-cancer drug delivery system using indocyanine green. Sci Rep, 28: 3044, 2019.
25) Kaneko J, Inagaki Y, Ishizawa T, et al.: Photodynamic therapy for human hepatoma-cell-line tumors utilizing biliary excretion properties of indocyanine green. J Gastroenterol, 49: 110-116, 2014.
26) Shirata C, Kaneko J, Inagaki Y, et al.: Near-infrared photothermal/photodynamic therapy with indocyanine green induces apoptosis of hepatocellular carcinoma cells through oxidative stress. Sci Rep, 24: 13958, 2017.
PDFを閲覧するためには Adobe Reader が必要です。