日外会誌. 126(3): 267-274, 2025
特集
進行胃癌治療の現状
7.進行胃癌治療におけるバイオマーカーと薬剤選択
|
群馬大学 総合外科講座消化管外科学分野 木村 明春 , 佐野 彰彦 , 酒井 真 , 佐伯 浩司 |
進行再発胃癌に対する医療は大きく変化している.これまで使用されてきた抗HER2抗体薬トラスツズマブ,免疫チェックポイント阻害薬ニボルマブに加え,抗Claudin18.2抗体薬ゾルベツキシマブが承認され,免疫チェックポイント阻害薬であるペンブロリズマブも一次治療に適応拡大となった.化学療法の治療選択肢が拡大している状況において,患者に適切な治療を提供するために,バイオマーカー検査が重要となっている.日本胃癌学会より「切除不能進行・再発胃癌バイオマーカー検査の手引き」が公開され,HER2,PD-L1,MSI/MMR,CLDN18の四つのバイオマーカー検査を一次治療の前に実施することが推奨されている.一方で施設の状況等により四つ全ての検査を実施できない場合もあり,各バイオマーカーの位置づけや治療方針決定への影響度等を考慮して,検査を計画する必要がある.また,複数のバイオマーカーが陽性の場合の治療選択については,今後の臨床試験を重ねてデータを蓄積する必要がある.今後,進行再発胃癌治療におけるバイオマーカーの利用により,個別化医療が促進されていくことが予想されるが,最適な治療選択を確立していくためには臨床・基礎研究のさらなる発展が必須である.
キーワード
進行胃癌, バイオマーカー, 薬剤選択, 治療成績, 個別化治療
I.はじめに
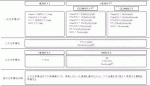
2025年3月に改訂第7版が出版された胃癌治療ガイドライン1)
2)において,切除不能進行・再発胃癌に対して推奨される化学療法レジメンを図1に示す.胃癌の薬物治療においては,長らく5-フルオロウラシル(5-FU)系薬剤と,プラチナ系薬剤が治療の中心であった.ToGA試験3)の結果より,2011年3月にHER2陽性の進行胃癌および胃食道接合部腺癌に対して,HER2を標的とするトラスツズマブの有効性が示され,胃癌の薬物治療においてバイオマーカーによる診断を必要とする治療が開始された.その後,KEYNOTE-158試験4)およびKEYNOTE-061試験5)の結果により,2018年12月に癌化学療法後に増悪したMSI-Highを有する進行・再発胃癌,食道胃接合部癌に対する免疫チェックポイント阻害薬ペムブロリズマブが適応となり,二次治療以降における薬物選択を目的としてMSI検査が行われるようになった.また2020年9月に化学療法後に増悪したHER2陽性胃癌に対するトラスツズマブ デルクステカンが適応となり,2021年11月には免疫チェックポイント阻害薬であるニボルマブがPD-L1発現状況(Combined Positive Score : CPS)を指標とした一次治療への適応となったことで,胃癌薬物療法における治療戦略が大きく変化した.2024年5月にはペムブロリズマブの一次治療への適応拡大,また,同年6月にはCLDN18.2をターゲットとしたゾルベツキシマブが臨床応用開始となり,バイオマーカーに基づいた治療選択を行うことがより重要となった.
現在ではHER2検査(HER2免疫染色[Immunohistochemistry:IHC]検査・HER2 in situ hybridization [ISH]検査)に加えて,PD-L1 IHC検査,Microsatellite Instability (MSI) / Mismatch Repair (MMR)判定検査(MSI PCR検査およびMMR IHC検査),Claudin (CLDN) 18 IHC検査の計四つのバイオマーカー検査が進行胃癌の薬剤選択に必須となっている.こうした状況を踏まえ,日本胃癌学会では胃癌を専門とする病理医,腫瘍内科医,消化管内視鏡医,バイオマーカーの専門家により「切除不能進行・再発胃癌バイオマーカー検査の手引き」6)が作成された.
本稿では胃癌における四つのバイオマーカーの臨床的意義や検査方法について概説する.また,薬剤選択におけるバイオマーカーの影響や検査の実施タイミングについて言及する.なお,各治療法についての詳細,ならびに治療選択については,胃癌治療ガイドラインを参考にされたい.
II.各バイオマーカーの臨床的意義
1)HER2
HER2タンパクとは,Human Epidermal Growth Factor Receptor 2と呼ばれる蛋白質の略称で,細胞の増殖を促進するシグナル伝達に関わるタンパク質の一つである.HER2タンパク過剰発現/遺伝子増幅は,乳癌では予後因子であるとともに,分子標的治療薬の特異的治療ターゲットとして判定方法が国際的にも重要であるとされる.一方,胃癌においては,予後因子としての意義は現段階では明確でないが,HER2陽性(IHC 3+またはFISH+)の切除不能な進行再発の胃癌・食道胃接合部癌の初回治療例を対象に実施された国際共同第Ⅲ相試験であるToGA試験3)により一次化学療法におけるトラスツズマブ上乗せの安全性と有効性が検証された.また,トラスツズマブを含む2レジメン以上の治療に不応となったHER2陽性の進行胃・食道胃接合部癌患者を対象に,日本と韓国で実施された非盲検無作為化第Ⅱ相試験であるDESTINY-Gastric01試験7)により,HER2陽性進行性胃癌の三次治療以降における抗HER2抗体薬物複合体トラスツズマブ デルクステカンの有効性が検討され,奏効割合と全生存期間はトラスツズマブ デルクステカン群の方が化学療法群よりも統計学的に有意に長かった.これらの結果から,胃癌の薬物治療を開始する前にHER2タンパク発現を確認することは必須となった.ToGA試験症例でのHER2陽性胃癌(IHC Score 3+もしくはIHC Score 2+/FISH Positive)頻度は17.8%であった3).本邦胃癌におけるHER2陽性率は,15.6~17%8)
9)と報告されている.
胃癌におけるHER2発現と切除標本の処理時間の関連性は,病理診断において重要な要素である.切除標本の処理時間が長くなると,HER2検査の正確性に影響を与える.「乳癌・胃癌HER2病理診断ガイドライン第2版」10)では,「外科切除検体は,乾燥させないようにして摘出後速やかに冷蔵庫など4℃以下で保管し,1時間以内,遅くとも3時間以内に切開,写真撮影と固定板上での伸展・張り付けを行い,固定液に浸漬することが望ましい.」と記載されている.検体処理に2時間以上かかった場合には,HER2検査の結果に影響し,ホルマリン固定までの時間が2時間を超えるとFISHでのHER2シグナルが低下することが報告されている.
2)PD-L1
PD-L1(Programmed cell Death 1- Ligand 1)は,T細胞の表面にあるPD-1(Programmed cell Death 1)と呼ばれるタンパク質に結合し,T細胞の活動を抑制する働きを持つタンパク質である.胃癌においては,CheckMate-649試験11),ATTRACTION-4試験12)により,HER2陰性の治癒切除不能な進行・再発胃癌/食道胃接合部癌の一次治療として,化学療法とニボルマブ併用療法が化学療法単独と比較して,OSと無増悪生存期間(PFS)が延長することが示された.PD-L1の発現量はCPSによって評価され,ニボルマブ併用化学療法の効果を予測するために重要な役割を果たすため,一次治療の開始前に可能な限りPD-L1検査を実施することが望ましい.三次治療以降におけるニボルマブ単剤療法については,PD-L1の発現は問わない.さらにKEYNOTE-859試験13)によりHER2陰性の治癒切除不能な進行・再発胃癌/食道胃接合部癌の一次治療として,化学療法とペムブロリズマブ併用療法は化学療法単独と比較してOSおよびPFSを延長することが報告された.
胃癌および食道胃接合部癌のPD-L1検査キットとしては,ニボルマブに対するPD-L1 IHC 28-8 pharmDx「ダコ」,ペムブロリズマブに対するPD-L1 IHC 22C3 pharmDx「ダコ」がそれぞれ承認されている.ニボルマブまたはペムブロリズマブの使用を検討する場合には,それぞれに対応するPD-L1検査キットによりPD-L1発現を評価することがエビデンスに基づくが,日常診療において両検査を実施することは難しいと想定される.肺癌領域でも「肺癌患者におけるバイオマーカー検査の手引き」14)において,それぞれ対応する抗体を用いてPD-L1発現を検討することは現実的でないと記載されている.胃癌においても同様で,PD-L1検査と使用する薬剤を必ずしも紐付ける必要はない.ただし,28-8と22C3抗体の染色性には一致が認められたという報告がある一方で,一致しないという報告もあり注意が必要である6).PD-L1検査は,胃癌においては現時点でコンプリメンタリー検査であり,両PD-L1検査キットによる結果は,ニボルマブおよびペムブロリズマブの投与を考慮する上でも参考になり得ると考えられる.CPS高発現の症例では治療効果がより期待できるため免疫チェックポイント阻害薬の使用が考慮される.一方でCPS発現が低い場合には,他のバイオマーカーの結果を考慮し,免疫チェックポイント阻害薬以外の分子標的治療薬の使用や化学療法単剤での治療が検討される.
PD-L1の発現の指標となるCPSは,PD-L1陽性の腫瘍細胞およびリンパ球やマクロファージといった免疫細胞をカウントし,その数を全腫瘍細胞の総数で除し100を乗じることで算出される.それぞれの検査キットによりカットオフが異なる.PD-L1 IHC 28-8 pharmDx「ダコ」はニボルマブ併用化学療法を行う胃癌患者の特定のための補助に用いられ,CPSのカットオフはCPS<1,1≤CPS<5,5≤CPSで記載される.PD-L1 IHC 22C3 pharmDx「ダコ」はペンブロリズマブを用いる胃癌および食道胃接合部癌患者の特定のための補助に用いられ,CPSのカットオフはCPS<1,1≤CPS<10,10≤CPSで記載される.胃癌におけるCPSの発現の割合について,ニボルマブのPD-L1 IHC 28-8 pharmDxではCheckmate-649試験11)において,CPS≥1: 82.0%,CPS≥5: 60.4%,CPS≥10: 48.5%,ペムブロリズマブのPD-L1 IHC 22C3 pharmDxではKEYNOTE-859試験13)において,CPS≥1: 78.2%,CPS≥5: 48.5%,CPS≥10: 34.9%と報告されている.
3)MSI/MMR
MMRは細胞分裂の過程でDNA複製時に生じたエラーを修復する機構である.この機構が損なわれたミスマッチ修復欠損(MMR deficiency, dMMR)では,遺伝子の突然変異が蓄積しやすくなり,特定の癌の発生や進行に関与する.またマイクロサテライトはDNAの反復配列であり,ゲノムの安定性に関与している.MMR機構が正常に働かない場合,マイクロサテライトの長さが異常となるマイクロサテライト不安定性(MSI)が生じる.MMR検査は免疫染色によりMMRタンパク質(MLH1, MSH2, MSH6, PMS2)の発現を調べる検査であり,MSI検査はゲノム上の特定の繰り返し配列をPCRや次世代シーケンシング(Next Generation Sequencing, NGS)によって検出する方法である.胃癌に対する抗PD-1抗体薬の適応判定では,MMR検査とMSI検査は同等と考えてよい17).MSI/MMR検査の判定基準を図2に示す.
胃癌を含む固形癌を対象としたKEYNOTE-158試験4)で良好な奏効率とPFSが報告され,日本人を含む第Ⅲ相試験であるKEYNOTE-061試験5)のMSI-High集団のサブセット解析で,ペンブロリズマム単剤療法がパクリタキセル単剤療法を上回る治療成績が示唆された.これらの結果により2018年12月にMSI-Highの切除不能・再発胃癌に対して,二次治療以降におけるペムブロリズマブ単剤療法が適応となった.また,CheckMate-649試験11)およびKEYNOTE-859試験13)において,MSI-High集団における免疫チェックポイント阻害薬併用化学療法の極めて良好な治療成績が示されている.このためMSI-High/dMMR症例には免疫チェックポイント阻害薬を使用することが推奨されるため,一次治療の開始前にMSI/MMR検査を行う意義が示唆されている.KEYNOTE-061試験におけるMSI-Highの頻度は約5%と報告されている.また,MMR検査とMSI検査の判定結果一致率は96.6~98.7%であることが報告されている.
「切除不能進行・再発胃癌バイオマーカー検査の手引き」において,MSI検査およびMMR検査の算定について言及している.MSI検査について,「診療報酬の算定方法の一部改正に伴う検査上の留意事項について」(令和年3月4日付 保医発0304第1号)が発出され,「マイクロサテライト不安定性検査については,リンチ症候群の診断の補助を目的とする場合又は固形癌の抗悪性腫瘍剤による治療法の選択を目的とする場合に,当該検査を実施した後に,もう一方の目的で当該検査を実施した場合にあっても,別に1回に限り算定できる.」と改正された.MMR検査の算定についても,「検査料の点数の取扱いについて」(令和4年9月30日付け 保医発0930第9号)が発出され,「抗PD-1抗体抗悪性腫瘍剤または抗PD-L1抗体抗悪性腫瘍剤の投与の適応を判断することを目的として,免疫染色(免疫抗体法)病理組織標本作成を行った場合に,当該抗悪性腫瘍剤の投与方針決定までの間に1回を限度として算定する.」と改正された.以上のことから,一次治療前においてMSI/MMR検査は実施可能であるとしている.
4)CLDN 18.2
CLDN18.2はタイトジャンクションの重要な構成要素であるタンパクで,胃粘膜をはじめ,全身の組織や臓器に存在している.CLDN18.2は,正常組織では胃粘膜の分化した上皮細胞に選択的に発現しているが,癌化などにより細胞の極性が崩壊するとCLDN18.2は細胞膜上に露出される19)
20).ゾルベツキシマブはCLDN18.2をターゲットとしたモノクローナル抗体であり,SPOTLIGHT試験21),GLOW試験22)において,化学療法との併用により有意にPFSおよびOSが延長することが確認された.本邦においては,2024年3月にCLDN18.2陽性の治癒切除不能な進行・再発の胃癌に対する治療薬として製造販売承認を取得した.上記二つの臨床試験において,免疫染色法により75%以上の腫瘍細胞の細胞膜で中等度~強いCLDN18の染色を示すものがCLDN18陽性とされ,スクリーニング患者の約38%がCLDN18陽性と判断された.
CLDN18の診断薬であるベンタナOptiView CLDN18 [43-14A]はCLDN18.1と18.2の共通部分である細胞内領域に結合し,両アイソフォームを認識する.正常胃粘膜や胃癌においては18.1の発現は極めて低いため,CLDN18の発現はCLDN18.2とほぼ同一と考えられる.

III.薬剤選択におけるバイオマーカーの影響
胃癌の薬物治療におけるバイオマーカーを利用した治療選択肢が増えたことで,治療の個別化が推進される一方で,バイオマーカー測定の選択や検査実施のタイミングにより,患者への適切な治療が提供できない可能性がある.「切除不能進行・再発胃癌バイオマーカー検査の手引き」においても,HER2,CLDN18,MSI/MMR,PD-L1の四つのバイオマーカーを,一次治療の開始前に同時に測定することが,もっとも推奨される検査のタイミングであるとしている.同時に検査を行うことで,薄切などの工程を省き少量の生検組織検体でも効率的に検査を行うことができ,各検査結果が出るまでの時間(turn-around-time : TAT)を短縮できるとしている.HER2検査ではIHCのスコアが2+となった場合には,追加でFISH検査を行う必要があり,結果の到着までに時間を要するため,治療スケジュールを検討する際に注意が必要となる.自施設内で上記四つの検査が対応可能であれば,スムーズに治療方針を検討し治療を開始することができるが,一部の検査を外注に依頼する場合には検査結果の到着までに時間を要するため,症例によってはバイオマーカーの結果を待たずに化学療法のみで治療を開始することが検討されうる.
実臨床においては,生検組織量がごく少量である場合やバイオマーカー検査にかかる費用負担等のため四つのバイオマーカーの同時検査が実施できない場合も想定される.4検査を同時に行わない場合には,コンパニオン診断薬であるHER2,CLDN18,MSI(二次治療以降でのペンブロリズマブの適用判断に必須),コンプリメンタリー診断薬であるPD-L1など当該バイオマーカーの位置づけや治療方針決定への影響度等を考慮して,測定するバイオマーカーを選択する必要がある.「切除不能進行・再発胃癌バイオマーカー検査の手引き」において,4検査を同時に実施しない場合のスキームについても言及しているため参考にされたい.
IV.今後の展望
バイオマーカー検査の結果,HER2陽性の場合にはトラスツズマブ,MSI-High/dMMR症例には免疫チェックポイント阻害薬,CLDN18陽性の場合にはゾルベツキシマブの使用が検討されるが,複数のバイオマーカーが陽性であった場合に,どのように薬剤選択を行うべきかは,今後の臨床試験を重ねてデータの蓄積が必要である.現時点では,基礎疾患や,懸念される有害事象,期待する治療効果などを個々の患者で考慮して,薬物選択を行うことが重要である.
V.おわりに
進行胃癌に対する治療においてバイオマーカーを利用した薬物選択が可能となり,今後は個別化医療が胃癌治療の中心となり,バイオマーカーが患者の予後に貢献する革新的なツールとなることが期待される.一方で,バイオマーカーに基づいて治療効果を予測し,最適な治療選択を確立していくには,これからの臨床研究および基礎研究のさらなる発展が必須である.
利益相反:なし
文献
1) 日本胃癌学会(編):胃癌治療ガイドライン医師用2025年3月改訂.第7版,金原出版,東京,2025.
2) Japanese Gastric Cancer Association: Japanese Gastric Cancer Treatment Guidelines 2021 (6thedition). Gastric Cancer, 26: 1-25, 2023.
3) Bang YJ , Van Cutsem E , Feyereislova A , et al.: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA):a phase 3,open-label, randomised controlled trial. Lancet, 376: 687-697, 2010.
4) Marabelle A , Le DT , Ascierto PA , et al.: Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer:Results From the Phase II KEYNOTE-158 Study. J Clin Oncol, 38: 1-10, 2020.
5) Shitara K , Özgüroğlu M , Bang YJ ,et al.: Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061):a randomised, open-label, controlled, phase 3 trial. Lancet, 392: 123-133, 2018.
6) 日本胃癌学会(編):切除不能進行・再発胃癌バイオマーカー検査の手引き 第1.1版2024年8月発出.2024年11月3日. https://www.jgca.jp/wp-content/uploads/2023/08/tebiki_01.1_202408.pdf
7) Shitara K , Bang YJ , Iwasa S , et al.: Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med, 382: 2419-2430, 2020.
8) Matsusaka S , Nashimoto A , Nishikawa K , et al.: Clinicopathological factors associated with HER2 status in gastric cancer:results from a prospective multicenter observational cohort study in a Japanese population (JFMC44-1101). Gastric Cancer, 19: 839-851, 2016.
9) Oono Y , Kuwata T , Takashima K , et al.: Clinicopathological features and endoscopic findings of HER2-positive gastric cancer. Surg Endosc, 32: 3964-3971, 2018.
10) 日本病理学会(編):癌・胃癌HER2病理診断ガイドライン 第2版,金原出版,東京,2021.
11) Janjigian YY , Shitara K , Moehler M , et al.: Firstline nivolumab plus chemotherapy versus chemotherapy a lone for advanced gastric, gastrooesophageal junction, and oesophageal adenocarcinoma (CheckMate 649):a randomised, open-label, phase 3 trial. Lancet, 398: 27-40, 2021.
12) Kang YK , Chen LT , Ryu MH , et al.: Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4):a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol, 23: 234–247, 2022.
13) Rha SY , Oh DY , Yañez P , et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859):a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol, 24: 1181-1195, 2023.
14) 日本肺癌学会(編):肺癌患者におけるバイオマーカー検査の手引き 2024年9月改訂版.2024年12月15日. https://www.haigan.gr.jp/wp-content/uploads/2024/10/1-%E7%9B%AE%E6%AC%A1-%E5%BA%8F%E6%96%87_202409.pdf
15) アジレント・テクノロジー株式会社(編):PD-L1 IHC 28-8 pharmDx「ダコ」染色結果判定マニュアル:胃癌 2021年11月発行.2024年12月15日. https://www.chem-agilent.com/pdf/pathology/29441ja-pdl1-ihc28-8-gastric-im-cm649.pdf
16) アジレント・テクノロジー株式会社(編):PD-L1 IHC 22C3 pharmDx「ダコ」の食道扁平上皮癌染色結果判定マニュアル 2020年7月発行.2024年12月15日. https://www.agilent.com/cs/library/usermanuals/public/29361ja_pd_l1_ihc_22c3_escc_interpretation_manual_kn181.pdf
17) Bartley AN , Mills AM , Konnick E , et al.: Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy:Guideline From the College of American Pathologists in Collaboration With the Association for Molecular Pathology and 図ht Colorectal Cancer. Arch Pathol Lab Med, 146: 1194-1210, 2022.
18) MSD社ホームページ:MSI検査/MMR IHC検査:MSI検査/MMR IHC検査とは.2024年12月1日. https://www.msdconnect.jp/products/keytruda-msi-high/msi-laboratorytest/msi-laboratorytest1/
19) Sahin U , Koslowski M , Dhaene K , et al.: Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development. Clin Cancer Res, 12: 7624-7634, 2008.
20) Sawada N : Tight junction-related human diseases. Pathol Int, 63: 1-12, 2013.
21) Shitara K , Lordick F , Bang YJ , et al.: Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT):a multicentre, randomised, double-blind, phase 3 trial. Lancet, 401: 1655-1668, 2023.
22) Shah MA , Shitara K , Ajani JA , et al.: Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma:the randomized, phase 3 GLOW trial. Nat Med, 29: 2133-2141, 2023.
PDFを閲覧するためには Adobe Reader が必要です。