日外会誌. 126(3): 254-260, 2025
特集
進行胃癌治療の現状
5.胃癌に対するconversion surgeryの現状と展望
|
1) 岐阜大学大学院医学系研究科 臨床解剖開発学講座 安福 至1) , 坂本 倫太郎2) , 鷹羽 律紀2) , 藤林 勢世2) , 近石 和花菜2) , 深田 真宏2) , 浅井 竜一2) , 佐藤 悠太2) , 田島 ジェシー雄2) , 木山 茂3) , 田中 善宏2) , 村瀬 勝俊3) , 松橋 延壽2) |
近年cStage ⅣB胃癌患者で化学療法が奏効した場合に,治癒を含めた長期生存を期待し根治手術を適応するconversion surgeryに関する報告が増加している.CONVO-GC-1研究はconversion surgeryに関する最大規模の国際多施設共同観察研究であり,全1,206名のcStage ⅣB胃癌患者に対する化学療法後手術において,R0切除が行われた場合の全生存期間中央値は56.6カ月と良好な治療成績が報告された.
一方conversion surgeryのエビデンスにおける課題として,conversion surgeryと化学療法の継続による治療成績を直接比較したランダム化比較試験がないことが問題とされている.cStage ⅣBであっても化学療法が奏効した場合には良好な長期成績が報告されており,conversion surgeryを行わなくとも長期生存した可能性が否定できないため,conversion surgeryが化学療法の継続より有効な治療であるかどうかはランダム化比較試験で検証すべき課題とされている.
このような背景のもと,JCOG胃がんグループでは現在conversion surgeryの有効性を検証するランダム化比較第Ⅲ相試験(JCOG2301試験)が実施されており,その結果の公表が待たれる.
キーワード
胃癌, 遠隔転移, cStage ⅣB, 化学療法, conversion surgery
I.はじめに
遠隔転移を有する胃癌はcStage ⅣBに分類され1),一部の限局した遠隔転移を除き,その治療の原則は緩和的化学療法であるが,生存期間中央値は約15カ月と報告されている2).Conversion surgeryは診断時には切除不能であった腫瘍が,化学療法により切除可能な状態となり,治療を緩和的化学療法から根治手術へと「convert」する治療戦略においてその中核となる外科手術を指す.
本項では,胃癌におけるconversion surgeryの現状と展望を,現在あるエビデンスをもとに概説する.なお本項では引用文献によっては胃癌取り扱い規約第14版以前の分類で記述されたものと胃癌取り扱い規約第15版で分類されたものが混在しており,混乱を避けるため遠隔転移を有する胃癌のステージを胃癌取り扱い規約第15版に統一し記載する.
II.胃癌におけるconversion surgeryのエビデンス
胃癌におけるconversion surgeryとは,診断時に技術的または腫瘍学的に切除不能な腫瘍に対して,化学療法後にR0切除を目指して適応する手術と定義されており3),2010年代からその報告は増加傾向である.同様の外科治療は過去には「adjuvant surgery」4)
5)や「salvage gastrectomy」6)などと報告されており,呼称が統一されておらず,またその治療成績についても,報告により対象とする遠隔転移が様々であったことなどから複数の報告の治療成績を比較検討することが困難であった.こうした背景からYoshidaらは上記のconversion surgeryの定義と合わせて,cStage ⅣB胃癌の遠隔転移を手術適応の可能性にもとづいて分類したカテゴリー分類を提唱した3).本分類はまず腹膜播種の有無で2群に大別される.腹膜播種のないカテゴリー1・2のうち,単発肝転移や大動脈周囲リンパ節(paraaortic lymph node: PALN)16a2/b1,腹腔洗浄細胞診陽性(CY1)などはpotentially resectable metastasisとしてカテゴリー1に分類され,本邦ではこの対象には術前化学療法(neoadjuvant chemotherapy: NAC)が適応されることも多く,手術を前提とした治療が適応される.カテゴリー2は多発肝転移やPALN16a2/b1以外の遠隔リンパ節転移などで,marginally resectable metastasisとして手術ではなく化学療法が推奨され,奏効した場合に手術を検討する対象とされた.腹膜播種を有する場合はカテゴリー3・4に分類され,腹膜播種以外に遠隔転移がない場合はカテゴリー3,腹膜播種に加えて別の遠隔転移を有する場合はカテゴリー4で,いずれも手術適応の可能性は低い遠隔転移として分類された.このカテゴリー分類の発表以降,conversion surgeryの治療成績に関する報告の多くでこのカテゴリー分類が用いられるようになった7)
~
10).
しかしながらconversion surgeryは遠隔転移を有する胃癌患者に対して化学療法を適応し,奏効した場合に手術を適応する治療戦略であるため,遠隔転移を有するすべての患者に手術が適応されるわけではなく,単施設で経験する症例数が少ないことから,治療成績を検討する際にサンプルサイズが少ないことが課題であった.またconversion surgeryにおける切除範囲や手術のタイミングについても一定の見解がなく,術者や各施設の判断で実施されていた.このような背景のもと,conversion surgeryを含めて,遠隔転移を有するcStage ⅣB胃癌を対象に化学療法後に手術を行った患者の治療成績を国際的な多施設共同の大規模観察研究として検討したCONVO-GC-1研究が実施された10).本研究は日本,中国,韓国から55施設が参加し,1,902例の患者が登録され,先述のカテゴリー分類にもとづいてその治療成績が報告された.本研究では,化学療法後に手術を実施した1,206名の患者のうち,R0切除が達成された839名の患者群では全生存期間中央値(mOS): 56.6カ月(95%CI 46.4-74.5)と,遠隔転移を有するcStage ⅣB胃癌としては非常に良好な長期成績が報告された.またカテゴリー分類別の解析結果として,R0切除であった場合,mOSはカテゴリー1: 47.8カ月(95%CI 40.7-95.2),カテゴリー2: 116.7カ月(95%CI 61.2-NA),カテゴリー3: 44.8カ月(95%CI 37.9-60.4)で,カテゴリー4: not reached(95%CI 37.2-NA)であり,腹膜播種を有するカテゴリー3・4であってもR0切除であれば良好な長期成績が報告され,conversion surgeryにおけるR0切除の重要性が示された.
このようなエビデンスをもとに,胃癌治療ガイドライン2021年7月改訂第6版には重要臨床課題として「conversion surgeryは推奨されるか?」というクリニカルクエスチョンに対して,「Stage Ⅳ胃癌症例に対してconversion surgeryを行うことは,化学療法により一定の抗腫瘍効果が得られ,奏効が維持され,R0切除が可能と判断される条件付きで弱く推奨される」と記載されるに至った.
III.胃癌におけるconversion surgeryの課題
胃癌治療ガイドライン2021年7月改訂第6版では,conversion surgeryに関する問題点も指摘されている.まずconversion surgeryの有効性に関するエビデンスにおいて,化学療法が奏効した患者に対して,化学療法の継続と比較してconversion surgeryが有効かどうかを検証したランダム化比較試験によるエビデンスがなく,全てが観察研究の結果であることから,エビデンスの強さが「とても弱い」とされている.観察研究においてconversion surgeryが適応された患者は,そもそも化学療法が奏効しているため,手術を行わなくとも長期生存した可能性が否定できない.さらにconversion surgeryは胃切除を含む手術が適応されるため,術後合併症による予後の短縮や,胃切除後症候群によるQOLの低下,術後の化学療法に対する忍容性の低下,費用などあきらかな「害」を含む治療であることが指摘されている.遠隔転移を有するcStage ⅣB胃癌に対する胃切除の有効性を検討したJCOG0705試験(REGATTA試験)は,診断時腹膜播種や多発肝転移,PALN16a1/b2におよぶ遠隔リンパ節転移を有する患者を対象に,標準治療である緩和的化学療法に対して,試験治療として胃切除を行ってから化学療法を行う2群間の全生存期間を比較したランダム化比較第Ⅲ相試験であるが,胃切除による生存期間の延長はみられず,とくに胃全摘を適応した患者では化学療法の忍容性の低下が示唆される結果であった.本試験の結果からは,cStage ⅣB胃癌患者で緩和的化学療法を行う場合には不要な胃切除は避けるべきであると考えられる.
またcStage ⅣB胃癌患者に対して緩和的化学療法を行う場合も,化学療法が奏効した患者では長期生存が期待できる可能性がある.切除不能進行HER2陽性胃癌患者に対する一次化学療法において,標的病変の縮小率と全生存期間の関係を検討した観察研究では,標的病変の縮小率が高度であった場合のmOSは24.7~29.7カ月と報告されている11)
12).また対象を腹膜播種,4個以上の多発肝転移,PALN16a2/b1以外の遠隔リンパ節転移の,より進行した遠隔転移に限定した場合でも,化学療法が奏効した場合にはmOS: 27.9カ月(95%CI 24.7-31.3)と良好な治療成績が報告されている13).また近年切除不能進行再発胃癌の一次化学療法において,nivolumabやpembrolizumab,zolbetuximabが使用可能となり,遠隔転移を有するcStage ⅣB胃癌患者に対する化学療法の治療成績もより一層改善している.CheckMate 649試験は切除不能進行再発胃癌に対する一次化学療法におけるnivolumabの有効性を検証したランダム化比較試験であるが14),その追加解析研究により,測定可能病変を有する患者群で治療開始から18カ月時点で病変の縮小率が80%以上の集団に限定した場合mOS: 38.2カ月(95%CI 25.6-NE),さらにnivolumabの治療効果と関連するCPS(combined positive score)5以上の患者に限定した場合,mOS: 44.8カ月(95%CI 26.6-44.8)と非常に良好な治療成績が報告された15).Conversion surgeryが適応される患者は本研究の縮小率80%以上の集団と同程度かそれ以上に化学療法が奏効した患者であるため,conversion surgeryの対象となる患者に手術を行わず化学療法を継続した場合でも長期生存する可能性が示唆されている.
また,conversion surgeryによる治療戦略が適切な対象についても,明確なエビデンスはない.一概に胃癌の遠隔転移といっても,限局した遠隔転移に対しては治療開 始時から手術を前提とした治療戦略が適応される.PALN16a2/b1に限局した遠隔リンパ節転移を含む高度リンパ節転移を有する患者に対してはJCOG0405試験で術前化学療法(S1+シスプラチン療法)+根治手術を適応することで3年生存率59%,5年生存率53%と良好な手術成績が報告されている16).また同対象に対してはJCOG1704で術前化学療法としてDOS療法を適応することで組織学的効果判定Grade 3の割合が24%と非常に良好な治療成績が報告されており1)
17),同試験の長期成績の解析結果も期待されている.また単発肝転移は切除により良好な治療成績が報告されており18)
~
20),胃周囲に限局した腹膜播種やCY1胃癌は手術+術後補助化学療法により良好な治療成績が報告されている21)
22).これらの比較的限局した遠隔転移はoligometastasisとして近年注目を集めており,国内外のガイドラインにおいても外科手術を中心とした治療戦略の対象として他の遠隔転移とは区別されている2)
23).Conversion surgeryは診断時に切除不能な遠隔転移を有するcStage ⅣB胃癌が対象であり,緩和的化学療法が奏効し,切除不能が切除可能となった患者に適応される手術である.診断時に手術が考慮されるような比較的限局している遠隔転移に対する手術は,化学療法後の手術であってもconversion surgeryとは異なる点に注意が必要である.
IV.胃癌におけるconversion surgeryに関するランダム化比較試験によるエビデンスと将来展望
遠隔転移を有するcStage ⅣB胃癌に対するconversion surgeryと化学療法を直接比較したランダム化比較試験ですでに結果が得られている研究はまだないが,類似した対象において手術と化学療法を比較したランダム化比較試験にRENAISSANCE試験がある.本試験は比較的限局した遠隔転移を有するcStage ⅣB胃癌・食道胃接合部癌を対象に,欧米における進行胃癌に対する標準治療であるFLOT療法を用いた周術期化学療法+手術とFLOT療法単独を比較したランダム化比較第Ⅲ相試験であり,ドイツで実施され,2024年のASCO(American Society of Clinical Oncology)annual meetingで結果が報告された24).本試験の対象はPALNを中心とした腹部の遠隔リンパ節(retroperitoneal lymph node:RPLN)転移かつ/または胃周囲に限局する腹膜播種,5個以下の肝転移,片側肺転移,卵巣転移,副腎転移,腹部以外の遠隔リンパ節転移,骨転移などを有する患者で,FLOT療法を4コース実施したのち腫瘍増悪のない患者をランダム化し,手術+FLOT4-8コースの周術期化学療法群とFLOT4-8コースのみ行う化学療法継続群を比較する試験で,主要評価項目はランダム化からの全生存期間であった.176名のランダム化が予定されたが登録不良により141名がランダム化された時点で登録が終了し結果が解析され,残念ながら周術期化学療法群の化学療法継続群に対する優越性は示されなかった.結果のサブグループ解析ではRPLN転移のみを有する患者では周術期化学療法の有効性が示唆されたが,腹膜播種を有する患者や化学療法非奏効患者では周術期化学療法群の生存成績は化学療法継続群を下回った.また手術に関して術後30日以内,90日以内の死亡がそれぞれ3%,8%と高率であったことや,周術期化学療法群において手術後の化学療法の忍容性が低下していたことも報告された.手術の安全性や,周術期化学療法が適応となる遠隔転移が本邦と異なるため,単純にこの結果を本邦に外挿することはできないが,これらの結果からは,遠隔転移を有するcStage ⅣB胃癌に対する手術を前提とした周術期化学療法による治療戦略の有効性は明らかでなく,少なくともより限局した遠隔転移に限定し,化学療法が奏効しており,安全に,R0切除できる患者に限定すべきであろうと考えられる.またこの結果は,本邦でNAC+手術や,手術+術後化学療法など手術を前提とした治療戦略の有効性が報告されている遠隔転移が,PALNa2/b1や単発肝転移,胃周囲に限局した腹膜播種やCY1など比較的限局した遠隔転移に限定されていることと矛盾がなく,本邦においてこれら以外のより進行した遠隔転移に対する標準治療はいまだ緩和的化学療法である.
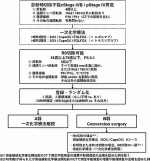
このような現状を踏まえ,JCOG(Japan Clinical Oncology Group)胃がんグループでは現在conversion surgeryの有効性をランダム化比較第Ⅲ相試験で検証すべくJCOG2301試験を実施している25).本試験は診断時に腹膜播種,PALN16a2/b1以外の遠隔リンパ節転移,4個以上の多発肝転移といったより広範囲な遠隔転移を有するcStage ⅣB胃癌患者のうち,一次化学療法が奏効し遠隔転移が消失または切除可能な範囲に限局しR0切除が可能となった患者を対象とし,標準治療である一次化学療法の継続に対して,試験治療であるconversion surgery+術後補助化学療法の優越性を検証するランダム化比較第Ⅲ相試験(図1)26)である.主要評価項目はランダム化からの全生存期間であり,登録患者数は126名を予定している.また本試験におけるconversion surgeryは原発巣切除と残存している場合の遠隔転移巣切除で構成されており,conversion surgery後の化学療法は,手術でR0切除が達成できれば術後半年間のSOX療法またはCapeOX療法を実施するプロトコール治療であり,これまで明確な定義のなかったconversion surgeryの対象や術式・切除範囲,術後の化学療法について定義した点も意義が大きい.特に術後の化学療法に関して,本試験で試験治療の有効性が示された場合には,術後半年間で化学療法が終了となることから,緩和的化学療法を受けてきた患者にとって化学療法を終了することで身体的,経済的な負担が軽減されることはconversion surgeryの大きなメリットとなりうる.一方本試験で試験治療の有効性が示されなかった場合,これまでconversion surgeryとして適応されてきた胃切除が避けられることとなる.本試験は,長らく議論されてきた,「conversion surgeryは有効か?」というクリニカルクエスチョンに一つの答えをもたらすものとして期待されている.
V.おわりに
Conversion surgeryは診断時に手術の適応とならない遠隔転移を有するcStage ⅣB胃癌患者にとって有望な治療であるが,化学療法継続に対する優越性を示すエビデンスはまだなく,現在進行中のJCOG2301試験の結果が待たれる.
※本稿は一部胃癌治療ガイドライン第6版の情報を含んでいます.2025年3月に胃癌治療ガイドライン第7版が発刊されていますので,最新の情報については胃癌治療ガイドライン第7版も参照ください.
利益相反:なし
文献
1) 日本胃癌学会:胃癌取り扱い規約第15版. 金原出版,東京,2017.
2) 日本胃癌学会:胃癌治療ガイドライン医師用 2021年7月改訂 第6版. 金原出版,東京,2021.
3) Yoshida K , Yamaguchi K , Okumura N , et al.: Is conversion therapy possible in stage Ⅳ gastric cancer: the proposal of new biological categories of classification. Gastric Cancer, 19(2): 329-338, 2016.
4) Suzuki T , Tanabe K , Taomoto J , et al.: Preliminary trial of adjuvant surgery for advanced gastric cancer. Oncol Lett, 1(4): 743-747, 2010.
5) Yoshida K , Yamaguchi K , Okumura N , et al.: The roles of surgical oncologists in the new era: minimally invasive surgery for early gastric cancer and adjuvant surgery for metastatic gastric cancer. Pathobiology, 78(6): 343-352, 2011.
6) Ishigami S , Natsugoe S , Nakajo A , et al.: Salvage gastrectomy following a combination of biweekly paclitaxel and S-1 for stage Ⅳ gastric cancer. J Gastrointest Surg, 12(8): 1370-1375, 2008.
7) Morgagni P , Solaini L , Framarini M , et al.: Conversion surgery for gastric cancer: A cohort study from a western center. Int J Surg, 53: 360-365, 2018.
8) Yamaguchi K , Yoshida K , Tanahashi T , et al.: The long-term survival of stage Ⅳ gastric cancer patients with conversion therapy. Gastric Cancer, 21(2): 315-323, 2018.
9) Solaini L , Ministrini S , Bencivenga M , et al.: Conversion gastrectomy for stage Ⅳ unresectable gastric cancer: a GIRCG retrospective cohort study. Gastric Cancer, 22(6): 1285-1293, 2019.
10) Yoshida K , Yasufuku I , Terashima M , et al.: International Retrospective Cohort Study of Conversion Therapy for Stage Ⅳ Gastric Cancer 1 (CONVO-GC-1). Ann Gastroenterol Surg, 20: 227-240, 2021.
11) Kadowaki S , Masuishi T , Eto T , et al.: Depth of response predicts the clinical outcome of advanced HER2-positive gastric cancer to trastuzumab-based first-line chemotherapy. Cancer Chemother Pharmacol, 80(4): 807-813, 2017.
12) Osumi H , Takahari D , Shinozaki E , et al.: Associations between early tumor shrinkage and depth of response and clinical outcomes in patients treated with 1st-line chemotherapy for advanced gastric cancer. Gastric Cancer, 21(2): 267-275, 2018.
13) 中山 厳 :【胃癌に対するconversion surgery-Stage Ⅳでも治したい!】総論 腫瘍内科医からみたconversion surgery. 臨外, 78(12): 1333-1338, 2023.
14) Janjigian YY , Shitara K , Moehler M , et al.: First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet, 398(10294): 27-40, 2021.
15) Yamaguchi K : SSY3-4-2. JSCO2022. 2022.
16) Tsuburaya A , Mizusawa J , Tanaka Y , et al.: Neoadjuvant chemotherapy with S-1 and cisplatin followed by D2 gastrectomy with para-aortic lymph node dissection for gastric cancer with extensive lymph node metastasis. Br J Surg, 101(6): 653-660, 2014.
17) Kurokawa Y , Doki Y , Kitabayashi R , et al.: Short-term outcomes of preoperative chemotherapy with docetaxel, oxaliplatin, and S-1 for gastric cancer with extensive lymph node metastasis (JCOG1704). Gastric Cancer, 27(2): 366-374, 2024.
18) Kodera Y , Fujitani K , Fukushima N , et al.: Surgical resection of hepatic metastasis from gastric cancer: a review and new recommendation in the Japanese gastric cancer treatment guidelines. Gastric Cancer, 17(2): 206-212, 2014.
19) Kinoshita T , Kinoshita T , Saiura A , et al.: Multicentre analysis of long-term outcome after surgical resection for gastric cancer liver metastases. Br J Surg, 102(1): 102-107, 2015.
20) Oki E , Tokunaga S , Emi Y , et al.: Surgical treatment of liver metastasis of gastric cancer: a retrospective multicenter cohort study (KSCC1302). Gastric Cancer, 19(3): 968-976, 2016.
21) Kodera Y , Ito S , Mochizuki Y , et al.: A phase Ⅱ study of radical surgery followed by postoperative chemotherapy with S-1 for gastric carcinoma with free cancer cells in the peritoneal cavity (CCOG0301 study). Eur J Surg Oncol, 35(11): 1158-1163, 2009.
22) Yamaguchi T , Takashima A , Nagashima K , et al.: Efficacy of Postoperative Chemotherapy After Resection that Leaves No Macroscopically Visible Disease of Gastric Cancer with Positive Peritoneal Lavage Cytology (CY1) or Localized Peritoneum Metastasis (P1a): A Multicenter Retrospective Study. Ann Surg Oncol, 27(1): 284-292, 2020.
23) Lordick F , Carneiro F , Cascinu S , et al.: Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol, 33(10): 1005-1020, 2022.
24) Al-Batran S-E : ASCO annual meeting 2024. 2024.
25) Kita R , Yasufuku I , Takahashi N , et al.: Randomized controlled phase Ⅲ study comparing chemotherapy alone versus conversion surgery after a remarkable response to chemotherapy in patients with initially unresectable cStage ⅣB or pStage Ⅳ gastric cancer (JCOG2301, Conversion study). Jpn J Clin Oncol, 2024. Dec 18:hyae 174. doi:10.1093/jjco/hyae174.Online ahead of print.
26) JCOG2301試験概要.2025年1月16日. https://jcog.jp/document/2301.pdf
PDFを閲覧するためには Adobe Reader が必要です。