日外会誌. 126(3): 247-253, 2025
特集
進行胃癌治療の現状
4.胃癌化学療法における外科医の役割とタスクシフト
|
兵庫医科大学 上部消化管外科 篠原 尚 |
近年,分子標的薬や免疫チェックポイント阻害剤の開発により,進行胃癌の治療選択肢は大きく広がった.バイオマーカーの解析も進み,個別化治療が現実のものとなりつつある.これまで胃癌に対する化学療法は外科医が中心となって行ってきたが,新規薬剤の副作用管理や薬物相互作用の把握には専門的な知識が求められることから,タスクシフトの重要性が高まっている.内科医による化学療法管理は,より適切で効果的な治療を可能にし,外科医は手術や周術期管理に集中できるようになる.働き方改革を見据えた業務量の削減や超過勤務の削減,医療の質の向上も期待できる.ただしタスクシフト後も外科医の役割は重要であり,手術適応の判断や手術タイミングの決定には外科医の専門性が不可欠である.外科医は内視鏡やロボットを使った低侵襲手術の精度を上げることに力を注ぎつつも,進歩する化学療法の動向を絶えず注視し続ける必要がある.
キーワード
進行胃癌, 化学療法, バイオマーカー, タスクシフト
I.はじめに
現在,多くの消化器外科医が手術治療に加えて化学療法も担当している.これは,癌の集学的治療に対するアプローチとして長年行われてきた方法である.外科医が手術前後の化学療法を管理することで,患者の全体的な治療経過を把握し,適切なタイミングで手術介入を行うことができるという利点があった.進行胃癌の治療においても例外ではない.しかし,化学療法の複雑化に伴い,外科医が単独で管理することの限界も指摘されるようになってきた.もし実施される化学療法が時代遅れの治療であったり,エビデンスに基づかないやり方であったりすれば,患者は進歩の恩恵を受けることができない.
昨今の働き方改革を受け,手術以外での外科医の役割も変化しつつある.本稿では,最近の胃癌化学療法について概説したのち,治療に対する外科医の関わりについて,タスクシフトと内科との連携,チーム医療という観点から解説する.
II.進行胃癌に対する化学療法の進歩
進行胃癌の薬物治療は,近年急速に進歩している.従来の殺細胞性抗がん剤に加え,分子標的治療薬や免疫チェックポイント阻害剤の開発により,治療の選択肢が大幅に拡大した(図1).
2021年7月に改訂された胃癌治療ガイドライン第6版1)には,一次治療から三次治療までの推奨レジメンが記載されている.一次治療においては,S-1,カペシタビン,オキサリプラチンなどを中心とした併用療法が主流となり,HER2(Human Epidermal Growth Factor Receptor 2)陽性胃癌に対してはトラスツズマブの併用が推奨されている.胃癌におけるHER2の陽性率は一般に15%程度とされ,多くを占めるHER2陰性胃癌に対しては,その後2021年11月の速報でニボルマブの併用が推奨された.さらに2024年5月にはペムブロリズマブやゾルベツキシマブの併用も追加された.
二次治療では,パクリタキセルとラムシルマブの併用やぺムブロリズマブが, さらに三次治療ではニボルマブやトリフルリジン・チピラシルが推奨されている.HER2陽性胃癌に対するトラスツズマブ デルクステカンは既存治療に抵抗性を示した患者において高い有効性が報告されており,三次治療として2020年9月に承認された.

III.バイオマーカー検査と個別化治療
近年,遺伝子変異やタンパク質発現などのバイオマーカーの解析が進み,胃癌の個別化治療が現実のものとなりつつある.バイオマーカーに基づいた治療選択は,患者個々の腫瘍特性に応じた最適な治療を提供し,治療効果の向上と副作用の軽減を可能にする.HER2は胃癌における最も確立されたバイオマーカーの一つである.MMR欠損(mismatch repair deficiency:dMMR)またはMSI-High(microsatellite instability-high)は,免疫チェックポイント阻害剤の効果予測因子として重要である.胃癌におけるMMR欠損/MSI-Highの頻度は約5%であり,使用可能な薬物として抗PD-1モノクローナル抗体であるニボルマブやペムブロリズマブがある.これら免疫チェックポイント阻害剤の効果予測因子としてはPD-L1発現 (CPS:Combined Positive Score)も有用である.Claudin(クローディン)は細胞間結合様式の一つであるタイトジャンクションを形成する主要な膜蛋白質である.CLDN18.2は正常組織では胃に極めて特異的に発現し,胃癌においても多くの症例でその発現が保たれる.これまでの大規模臨床試験の結果からCLDN18.2高発現(免疫組織化学法で2+以上,かつ腫瘍細胞の75%以上に発現)はスクリーニング検査において全体の38%(HER2陰性に限ると43.5%)と報告されている2).使用可能な薬物として抗CLDN18.2モノクローナル抗体であるゾルベツキシマブがある.
これらバイオマーカーに基づいた個別化治療を実践するためには,適切なタイミングでの検査実施が重要である.日本胃癌学会の「切除不能進行・再発胃癌バイオマーカー検査の手引き」では,一次治療開始前に検査を実施することが推奨されている3).
IV.化学療法における外科医のこれまでの関わり方
このような進歩を受け,進行胃癌に対する化学療法の管理はより専門的かつ時間を要するものとなっている.推奨されている標準治療の多くは治療効果において最も強力なレジメンであり,当然のことながら重篤な有害事象や,時には治療関連死さえ覚悟せねばならない.
従来,進行胃癌の化学療法は外科医が中心となって行ってきた.外科医は以下の観点から化学療法の実施に強みがある.
1.手術適応の判断:薬物療法の効果を適切に評価し,conversion surgery(CS)の可能性を判断できる.
2.合併症管理:手術関連の知識を活かし,薬物療法中の合併症に迅速に対応できる.
3.総合的な治療戦略の立案:手術,内視鏡治療,薬物療法を組み合わせた最適な治療計画を立案できる.
しかし一方で,外科医が化学療法を行うことの問題点は,以前から指摘されてきた3).
1.患者の全身状態の評価が不十分で,PS不良例に少量の抗癌剤を投与する.
2.抗癌剤による有害事象への対応が不十分である.
3.有害事象が発現すると,すぐに減量,あるいは中止する.
4.経口抗癌剤が簡便で,有害事象が少ない優れた治療法と考えている.
5.抗癌剤の治療効果をエビデンスに基づいて十分に説明できない.
きわめて多忙な臨床現場で,手術を主業とする外科医が多くの情報の中から必要な情報を取捨選択して,適切な医療を実施することは大変なことである.特に,新規薬剤の副作用管理や薬物相互作用の把握,臨床試験への参加判断など,薬物治療に特化した専門的な知識が求められる場面が増えており,その方策の一つとしてタスクシフトは有効である.
V.タスクシフトによる外科医の利点
癌の化学療法は一般的に,薬剤師,看護師が薬剤管理や患者の状態観察を行うチーム医療として行われてきた.近年では腫瘍内科医の専門性が高まり,治療チームの中心的役割を担う体制も整いつつある4).外科医の長時間労働の是正と医療の質の向上を両立させるためには,医師の業務を適切に分担し,効率化を図ることが理想であろう.化学療法の主導を腫瘍内科医にシフトすることは,働き方改革の実践においても重要な意味を持つ.
外科医が化学療法をタスクシフトすることで得られる具体的な利点を表1に示す.化学療法の詳細な管理を腫瘍内科医や薬剤師に委ねることで,外科医は本来の専門領域である手術および周術期管理に集中することが可能となる.その結果,手術の質の向上や新しい手術技術の習得に時間を割くことができる.外科医が過度な労働から解放されることで,自身の専門性をさらに深化させる時間的余裕が生まれるからである.超過勤務の短縮は,外科医の身体的・精神的負担を軽減し,結果的に医療の質の向上につながる.

VI.タスクシフトによる内科医の利点
化学療法の専門家である腫瘍内科医が管理することで,より適切で効果的な治療が可能になると期待される.腫瘍内科医は,化学療法に特化した専門的トレーニングを受けており,最新の治療法および臨床試験に関する最先端の知見を有している.特に,複数の臓器にまたがる進行癌や希少癌の治療において,その専門性は顕著である.個々の患者の状態に応じた治療レジメンの選択と適切な管理が可能となり,治療の質的向上が期待できる.また,新規分子標的薬や免疫チェックポイント阻害薬など,従来の抗がん剤とは異なる作用機序を持つ薬剤は特有の有害事象をもたらすことから,その管理には高度な専門知識を要する.これを早期に発見し,適切に対応することで,治療の継続性を担保しつつ患者のQuality of Lifeを最大限に維持することができる.さらに腫瘍内科医は,臨床試験に関する深い知識を基に,適切な患者選択と試験への組み入れを行うことができる.新規治療法の開発と最先端の治療を患者に提供する上で,この役割は極めて重要である.特にがんゲノム医療の推進においては,遺伝子パネル検査結果の的確な解釈と,それに基づく分子標的薬の選択が求められる.
2024年12月現在,日本臨床腫瘍学会の薬物療法専門医は全国で1,677名が登録されている5).日本胃癌学会では2023年度より施設認定制度を設け,認定施設Aの申請条件の一つとして,同専門医が1名以上常勤していることを挙げている.進行胃癌に対する化学療法のタスクシフトを見据えたものであろう.
VII.タスクシフト後の外科医のかかわり方
化学療法のタスクを腫瘍内科医にシフトした場合でも,外科医の役割は依然として重要である.まず,手術適応の判断や手術のタイミングの決定において,外科医の専門性は不可欠である.特に,術前化学療法後の手術適応の判断や,化学療法の効果判定に基づく手術時期の決定には,外科医の経験と知識が重要な役割を果たす.また,定期的なカンファレンス(キャンサーボード)を通じて,内科医と密接に連携することが求められる.そこでは化学療法の進捗状況や効果を把握し,適切なタイミングでの手術介入を提案する.さらに,周術期の管理においても外科医の役割は重要である.化学療法による副作用や全身状態の変化が手術に与える影響を評価し,安全な手術の実施を確保する必要がある.加えて,術後の補助化学療法の必要性や方針について内科医と協議し,決定することも外科医の重要な役割となる.そして最も重要なことは,外科医が化学療法の基本的な知識を維持・更新し続けることである.これにより内科医と同じ言葉で会話ができ,患者にとって最適な治療方針を決定することができる.
このように,化学療法のタスクシフトは,外科医の役割を否定するものではなく,むしろチーム医療の中で外科医の専門性をより効果的に活用するための方策であると言える.外科医と内科医が密接に連携し,それぞれの専門性を最大限に発揮することで,進行胃癌患者により質の高い医療を提供することができる.
VIII.当院における胃癌診療の連携
図2に示すように,当院では外科医と消化器内科医が密に連携して胃癌の診療にあたっている.まず,当科に紹介された初診患者は基本的に全例,1週間以内に消化器内科医による内視鏡検査を受ける.早期癌であれば腫瘍の局在と超音波内視鏡による深達度の評価,副病変の有無の確認がなされ,生検によって組織型を確認する.ESD適応病変であれば次回外来で患者に説明し,直ちに内科医に引き継ぐ.進行癌であればHER2,CLDN18,MSI/dMMR,PD-L1といったバイオマーカー検索のための生検検体が提出される.造影CT検査で遠隔転移がなく手術適応と判断されたものは手術の準備にかかるが,一方で大型3型や4型で画像上,遠隔転移が明らかでない場合は可及的速やかに審査腹腔鏡を行い,CY,Pを評価する.この間,内科医とは都度,電話で患者情報を共有しあう.キャンサーボードは2週間ごとに,病理医も参加して開催される.外科チームからはcStage ⅣBと診断された症例が提示され,バイオマーカー等を参考に化学療法のレジメンが協議される.内科チームからは,ESDが実施されたものの非治癒切除と判定された症例や,内科初診で進行癌の症例が提示される.これには手術適応のない高度進行症例も含まれ,外科との間で治療情報が共有される.結果として,兵庫医科大学病院に紹介されたすべてのcStage ⅣB胃癌症例は,このキャンサーボードにかかる.
化学療法は内科チームによって実施される.治療経過は,定期的に実施される効果判定の結果とともにキャンサーボードで報告され,化学療法が著効しM0に持ち込めたと判断された症例についてはCSが検討される.P1がStage ⅣB因子であった場合は,再度の審査腹腔鏡が予定される.また,CY1のみで化学療法が先行された場合はコース数を決めての手術を計画するなどのタイミング調整も行われる.キャンサーボードには外科外来での経過観察中に再発が判明した症例も提示され,その後の化学療法が内科医に引き継がれる.ただし,そうした患者さんには外来化学療法実施日に合わせて外科外来にも立ち寄っていただき,適切なスピリチュアルケアを欠かさない.
このような診療体制の下,われわれは2017年から2022年に兵庫医大病院を受診したすべてのcStage ⅣB胃癌125症例の18.4%にCSを実施することができた6).91.3%にR0手術が行われ,Clavien-Dindo grade ≥ Ⅲの術後合併症は1例のみであった.治療コース数中央値は8,手術までの化学療法期間中央値は8.5カ月で,一次治療後に実施された症例が78.3%と多かったが,二次治療後に実施された症例が8.2%,三次治療後に実施された症例も1例あった.手術に至らなかった群の生存期間中央値(16カ月)に比べ,CS群のそれは56.7カ月に延長した.この解析には,すでに大量の腹水貯留を認めるような厳しい症例も含まれており,内科と外科の緊密な連携によって得られた結果である.こうした数字を示すことは,「今は手術ができない」と告げられ絶望的な状況に追い込まれた患者に,一筋の希望の光を与える.そして明らかに前向きな表情になり,内科の診察室に向かう.2021年11月以降,ニボルマブが一次治療として使用できるようになり,当院でのCS実施率はさらに向上した(データ未発表).
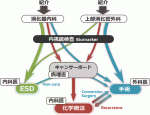
IX.これからの胃癌治療における外科医の立ち位置
かつてはどんな早期癌であっても手術が選択され,拡大郭清が行われていた.現在は,粘膜にとどまる状態で発見される早期癌の多くは内科医によってESDで治療される.外科手術のリスクをとれない高齢患者に対しては,その適応が今後さらに拡大する.一方,化学療法の進歩に伴い,高度進行胃癌に対して外科医が拡大手術で立ち向かう時代も終わった.あくまでも局所療法を担う外科医は“身の程をわきまえた治療”を提供することが求められている7).できるだけ手術を回避してESDに委ねる選択,あるいは化学療法によって手術にもちこむ戦略を常に考えておく必要がある(図3).
ただし当面,手術による局所コントロールが胃癌治療の中心にあることに変わりはない.局所コントロールには原発巣のみならず,領域リンパ節のコントロールが含まれる.その技術を持ち合わすことは外科医であることの基本的条件である.その上で外科医は,患者の病状や治療経過を総合的に判断し,最適な治療計画を立案する上で重要な役割を担っている.専門性を活かしつつ,内科医との連携を強化することで,トータルでより質の高い治療を提供することができる.

X.おわりに
今後,胃癌が希少癌となり,その治療機会も急激に減っていくことが予想される.すでに消化器外科専門医の申請に必要な胃癌の術者経験数は2020年に5例に緩和され,現在は3例にまで下がったが,それでも申請に向けた大きなハードルであると聞く.胃外科を志す若手医師は確実に減り,いずれ貴重な存在となるだろう.外科医の専門性を考えれば,化学療法のタスクシフトは避けて通れない課題である.ただし,彼らには,内視鏡やロボットを使った低侵襲手術の精度を上げることに力を注ぎつつも化学療法の動向を絶えず注視し,胃癌に対する集学的治療の中心的役割を担い続けてほしいと願う.
利益相反:なし
文献
1) 日本胃癌学会編:胃癌治療ガイドライン.第6版,金原出版,東京,2021.
2) 「切除不能進行・再発胃癌バイオマーカー検査の手引き」第1.1版.2024年12月31日. https://www.jgca.jp/wp-content/uploads/2023/08/tebiki_01.1_202408.pdf
3) 島田 安博 :がん治療における「腫瘍内科医」の役割.外科治療,98:9-13,2008.
4) Shitara K , Lordick F , Bang YJ , et al.: Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet, 401: 1655-1668, 2023.
5) 日本臨床腫瘍学会ホームページ.2024年12月31日. https://www.jsmo.or.jp/system/pdf/senmon.pdf
6) Hojo Y , Ishida Y , Tomita T , et al.: Treatment strategy for successful conversion surgery in clinical stage IVB gastric cancer. Eur J Surg Oncol, 50: 107314, 2024.
7) 佐野 武 :胃癌手術の変遷とそのエビデンス.日臨外会誌,80:1771-1778,2019.
PDFを閲覧するためには Adobe Reader が必要です。