日外会誌. 126(1): 46-50, 2025
特集
少子化時代のこどもの外科医療のあり方
8.小腸移植領域からみたこどもの外科医療のあり方
|
東北大学大学院医学系研究科外科病態学講座小児外科学分野,東北大学病院総合外科(小児外科) 和田 基 , 工藤 博典 , 櫻井 毅 , 中村 恵美 , 安藤 亮 |
日本では過去10年間で出生数が約30%減少し,それに伴い小腸移植を必要とする小児腸管不全症例の減少が推測される.
腸管不全は主に新生児期に発症し,その中で合併する腸管不全関連肝障害(IFALD)が小腸移植の主要な適応となる.近年,本邦では未承認であるものの,魚油由来脂肪乳剤の使用や短腸症候群に対するGLP-2アナログ製剤による新規治療,IR技術の進展による中心静脈カテーテル挿入技術の向上などにより,包括的な腸管リハビリテーションが導入され,小児腸管不全治療の質は向上している.これにより小腸移植の必要性が一部減少する傾向にあるが,特に進行したIFALDにより肝臓-小腸移植を必要とする患者は依然として存在する.国内における小腸移植の実施数は年間3~5例にとどまっており,少子化の進行に伴い移植適応症例数の減少が予測されるものの,小児脳死ドナーからの臓器提供が増加すれば,肝臓-小腸移植の実施数が今後増加することが期待される.
魚油由来脂肪乳剤の国内承認により,IFALDの進行を抑え,これまで救命が困難であった症例にも適切な移植が可能となり,小児腸管不全の治療成績のさらなる向上が期待される.
本稿では,少子化に伴う小児外科医療の現状と,小腸移植を中心とした治療戦略の展望について論じる.
キーワード
小腸移植, 腸管不全関連肝障害(IFALD), 小児脳死ドナー, 腸管リハビリテーション, 魚油由来脂肪乳剤
I.はじめに
日本における出生数は過去10年間で約30%減少しており,2015年には1,005,677人だったが,2023年には727,288人に減少した1).この少子化の進行は,小児医療全般に患者数の減少をもたらしており,特に小児外科領域では,治療対象,手術数が減少し,医療リソース配分や次世代の外科医の育成に影響を与えている.また,小腸移植が必要な腸管不全症例も少子化の影響を受けると考えられている.
一方,新生児期に発症する壊死性腸炎や消化管穿孔の主なリスク要因である低出生体重児や早期産児の割合はむしろ増加している.2018年の日本小児外科学会・先進医療検討委員会の報告によれば,消化管穿孔の症例数は増加しているが,6週間以上の長期静脈栄養(PN)を必要とする症例は減少傾向にある2).このため,少子化による小児腸管不全症例数の減少は予測されるものの,その実態の一部は不明確であり,少子化の進行ほど減少していない可能性も示唆される.今後,小児腸管不全症例数の動向を明確に把握するためには,腸管不全症例登録などのさらなる研究が必要である.
II.小腸移植の現状
小腸移植は,重症の不可逆的腸管不全症例に対する最終的な治療法として位置づけられており,特に進行した腸管不全関連肝障害(IFALD)においては肝臓-小腸移植が必要となる.小児腸管不全の多くは新生児期に発症し,中心静脈アクセスの喪失や繰り返すカテーテル関連血流感染症(CRBSI)も移植適応の要因となるが,特に小児の中でも乳幼児の症例においては,IFALDの進行が主たる小腸移植適応の要因である3)
4).
日本腸管リハビリテーション・小腸移植研究会の本邦小腸移植症例登録による報告によれば,2022年までに国内で38名の患者に対して42件の小腸移植が実施されており,そのうち6歳以下の症例が約4分の1を占めている5)
6).2018年に健康保険が適用されたにもかかわらず,年間の実施件数は3~5例にとどまり,小児IFALDに対しては,2022年にようやく脳死ドナーからの肝臓-小腸同時移植が実施された.この背景には,小児脳死ドナーからの臓器提供数の少なさが主な要因として挙げられるが,適切な臓器提供があれば,移植成功率や成績の改善が期待される.
特に,小児IFALDに対する肝臓-小腸移植に関しては,小児脳死ドナーからの臓器提供が少ないため,これまでは生体ドナーからの肝移植と脳死ドナーからの小腸移植を組み合わせた異時性の移植や,肝臓と小腸を別々に移植するノンコンポジット移植が行われてきた6).しかし,体格が適合する小児脳死ドナーからの臓器提供が増加すれば,こうした複雑な移植手術を回避できる可能性が高くなる.さらに,制度的にも膵臓を含む胆道系・門脈が連続する形のコンポジット移植が可能になれば,術式の簡略化や合併症リスクの低減が期待され,治療成績も向上すると考えられる.これにより,今後はこのような移植が増加すると見込まれる.
III.小児腸管不全とIFALDの管理
腸管リハビリテーションと呼ばれる腸管不全に対する包括的な治療の進展は顕著であり,魚油由来脂肪乳剤によるIFALDにおける栄養補給7)や,GLP-2アナログ製剤による短腸症候群に対する新規治療が注目されている8).特に,魚油由来脂肪乳剤はIFALDの進行を抑制する効果が報告されており,国際的にはすでに広く小児IFALD症例に使用され,2007年以降,小腸移植の件数が減少している9)
10).日本ではこの脂肪乳剤は未承認であり,現在,医師主導の治験が進行中であるが,今後の承認と普及が期待されている.
グルカゴン様ペプチド-2(Glucagon-like peptide-2, GLP-2)は,小腸粘膜の増殖,消化吸収の促進,粘膜バリアの維持など多彩な作用を有する消化管ホルモンである.このGLP-2のアナログ製剤は天然型GLP-2と同じ受容体に結合し,同様の効果を発揮することで,短腸症候群における静脈栄養・補液量を軽減する効果が期待されている.
また,放射線科手技(IR)の進歩により,中心静脈カテーテル挿入技術も向上しており,長期のPN管理が必要な腸管不全患者に対しても,安全に管理が提供できるようになっている.これらの包括的な腸管リハビリテーションにより,腸管不全患者の治療成績は向上し,移植を回避できる症例も増加している.
しかし,進行する重症IFALD症例においては,依然として肝臓-小腸移植が不可欠であり,特に年少児におけるIFALDの進行は急速であるため,早期の移植が必要となるケースが多い3)
4).
IV.小児ドナーからの臓器提供
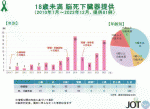
小腸移植の実施において最大の課題は,適切な臓器の確保である.2010年に臓器移植法が改正され,小児脳死ドナーからの臓器提供が可能となったが,小児脳死ドナーからの臓器提供数は依然として少なく11),小腸移植の普及における大きな障害となっている.しかし,2019年以降,少しずつ小児ドナーからの提供が増加しており,COVID-19の影響で一時的に減少したものの,再び増加傾向にある(図1).小児ドナーの臓器提供数が増加すれば,これまで移植に至らなかった潜在的な適応症例や,移植待機中の死亡率を減少させることで,移植数や治療成績が向上することが期待される.特に,肝臓-小腸移植の適応患者に対しては,小児脳死ドナーからの臓器提供が増えることで,救命率やQOLが大きく向上することが見込まれる.
さらに,これまでの異時性移植やノンコンポジットの肝臓-小腸移植に代わり,制度的にも小児脳死ドナーからの胆道系や門脈を含むコンポジット移植が実現すれば,術式が簡略化され,手術の安全性や成績が飛躍的に向上する可能性がある.
V.課題と今後の展望
今後の課題として,包括的腸管リハビリテーションのさらなる普及と,小児ドナーからの臓器提供の増加が挙げられる.魚油由来脂肪乳剤は現在,医師主導治験が進行中であり,承認されれば,IFALDの発症と進行をさらに制御することが可能となる.これにより,肝臓-小腸移植が必要な症例は減少する可能性がある.
しかし,上述のごとく新生児期におけるIFALD発症リスクの高い重症腸管不全症例の増加の可能性を考慮すると,重症IFALD患者に対しては,引き続き肝臓-小腸移植が重要な治療手段となると考えられる.
VI.おわりに
少子化が進行する中,小腸移植を必要とする腸管不全症例数も減少することが推測され,包括的腸管リハビリテーションの進展により,その治療成績は向上している.一方,小児脳死ドナーからの臓器提供の増加により,これまで十分に対応できなかった重症IFALD患者への移植が可能となり,救命率が大幅に向上することが期待される.
今後,医療従事者のみならず研究者や社会全体が協力し,小腸移植を必要とする重症小児腸管不全症例に対しても適切な医療が提供される体制を整備していく必要がある.包括的腸管リハビリテーションと移植医療のさらなる発展が,少子化が進む社会において小児腸管不全患者に対する質の高い治療提供に貢献することを期待したい.
利益相反:なし
文献
1) 令和5年(2023)人口動態統計(確定数)の概況.2024年9月28日. https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/kakutei23/index.html
2) 日本小児外科学会学術・先進医療検討委員会: わが国の新生児外科の現状─2018年新生児外科全国集計─.日小外会誌,56:1167-1182, 2020.
3) Duggan CP , Jaksic T : Pediatric Intestinal Failure. N Engl J Med, 377: 666-675, 2017.
4) Kaufman SS , Avitzur Y , Beath SV , et al.: New Insights Into the Indications for Intestinal Transplantation: Consensus in the Year 2019. Transplantation, 104: 937-946, 2019.
5) Ueno T , Wada M , Ogawa E , et al.: Present state of intestinal transplantation in Japan. Pediatr Surg Int, 39: 276, 2023.
6) 日本腸管リハビリテーション・小腸移植研究会:本邦小腸移植症例登録報告.移植,58:239-245, 2023.
7) Puder M , Valim C , Meisel JA , et al.: Parenteral fish oil improves outcomes in patients with parenteral nutrition-associated liver injury. Ann Surg, 250: 395-402, 2009.
8) 和田 基 :グルカゴン様ペプチド-2(Glucagon-like peptide-, GLP-2)アナログ製剤の治験. 小児外科, 56: 335-341, 2024.
9) Grant D , Abu-Elmagd K , Mazariegos G , et al.: Intestinal Transplant Registry Report: Global Activity and Trends. Am J Transplant, 15: 210-219, 2015.
10) Raghu VK , Beaumont JL , Everly MJ , et al.: Pediatric Intestinal Transplantation: Analysis of the Intestinal Transplant Registry. Pediatr Transplant, 23: e13580, 2019.
11) 日本臓器移植ネットワーク:脳死臓器移植の分析データ,18歳未満脳死下臓器提供による提供件数.2024年9月30日. https://www.jotnw.or.jp/data/brain-death-data.php
PDFを閲覧するためには Adobe Reader が必要です。