日外会誌. 125(5): 435-442, 2024
特集
乳癌治療における手術の省略について考える
8.腋窩リンパ節郭清省略におけるTargeted Axillary Dissectionの現状
|
がん研究会有明病院乳腺センター 乳腺外科 坂井 威彦 |
リンパ節転移陽性患者に対して,術前化学療法後の腋窩の低侵襲手術として,Targeted axillary dissection(TAD)が近年注目されている.術前化学療法前に,転移が証明されたリンパ節に印(マーカー)を留置して,治療効果が良好な患者に対して,センチネルリンパ節生検に加えてマーカーを留置したリンパ節を摘出することで,腋窩リンパ節郭清を省略できる群を選択する検査としての手技である.初期治療開始前のステージング,標的リンパ節へのマーキング,追跡,画像評価,そして標的リンパ節を確実に取るための位置決めといった,五つの工程を行うことで,より精度の高い患者選択が可能となる.このマーカーには放射性同位元素や磁気を用いたマーカーや,乳房に用いるクリップ,墨汁など,世界で様々な方法が用いられている.TADは各種ガイドラインでも推奨治療とされ,広く世界中で行われてきているが,上記マーカーが保険収載されていない点など日本ではまだ十分に普及しているとは言えない.画像診断機器が広く普及している日本の実臨床に適した,腋窩の低侵襲手術が提唱されるには,社会基盤の整備を含めてもう少しデータの蓄積が必要である.
キーワード
腋窩の低侵襲手術, Targeted axillary dissection, TAD, マーカー, センチネルリンパ節生検
I.はじめに
乳癌治療の中で,最も侵襲が大きい治療の一つに腋窩リンパ節郭清があげられ,その予後を改善するというMeta-analysis1)の結果をもとに,長く腋窩の標準治療として行われてきた.近年の乳癌治療成績の改善は,乳癌治療を終えたサバイバーの生活の質に医療者の注目を集めさせ,2割程度に不可逆的な上肢のリンパ浮腫が生じてしまう腋窩リンパ節郭清は,その医学的な価値が得られる患者だけに行うことが求められている.腋窩リンパ節郭清を回避できる患者を選択する手段として,センチネルリンパ節生検(SLNB)が開発された.初診時に臨床的リンパ節転移陰性(cN-)の乳癌患者においては,SLNBがその患者選択に果たす役割はほぼ確立し,センチネルリンパ節に転移が少数個であれば,腋窩リンパ節郭清を行わないことがほぼ標準治療となっている.
一方,初診時に臨床的リンパ節転移陽性(cN+)乳癌患者の腋窩手術は,腋窩リンパ節郭清が標準治療であったが,術前化学療法(NAC)によって病理学的にリンパ節転移陰性(ypN0)が得られる機会が増加したことで転換期を迎えている.NAC後の最適な腋窩マネージメントに,腋窩リンパ節郭清が必要な群と,より低侵襲な手技で安全に腋窩リンパ節郭清を省略できる群を選ぶことが加わった.その低侵襲手術の一つがTADであり,2016年にMDアンダーソンのCaudleらによってNAC後の腋窩の低侵襲手術として報告された2).転移が証明されたリンパ節にクリップ(印)を付けた後にNACを開始することで,NAC後の腋窩の病期評価精度を改善するもので,センチネルリンパ節+クリップをつけたリンパ節を摘出することをTADと定義している.その腫瘍学的安全性に関する長期のデータはないが,TADを行うことでSLNBしか行わなかった場合にセンチネルリンパ節以外に転移が診断される偽陰性率(false negative rate: FNR)を12.6%から2~4%に低減できることが優位点として示され,現在世界中の多くの施設で導入されている.現在TADは,“センチネルリンパ節+転移があったリンパ節に各種マーカーをつけて摘出する手技”として広義に用いられている.本稿ではこの広義のTADについて,その方法や患者選択の方法,当院で行っているTADの方法について解説し,現状とその課題について述べる.
II.腋窩リンパ節転移診断とNACの効果判定
NAC後に腋窩リンパ節郭清を省略するには,治療開始時点のリンパ節転移の進行度と,転移があったリンパ節への治療効果判定を正確に行うことが求められる.American Joint Committee on Cancer (AJCC)の TNM病期分類では,腋窩リンパ節転移は腋窩,内胸,鎖骨上リンパ節への転移状況によってcN1-3に分類される(図1).そして,これらのcN+乳癌患者にNACが施行された後の腋窩リンパ節の状態は,最終的な病理結果として三つのパターンが考えられる(図2).cN+乳癌患者の中で腋窩リンパ節郭清を省略できるのは,病理学的にリンパ節転移が完全に消失(ypN0)した患者群,もしくは腋窩への低侵襲手術のみで腋窩リンパ節転移をすべて切除できる患者群である.これらの患者群が選択できれば,理論的には安全に腋窩リンパ節郭清が省略できるが,実際にはNAC後のリンパ節の病期,転移リンパ節の効果判定は難しいケースが多い.当院のリンパ節超音波検査(LNUS)におけるNAC後のリンパ節転移消失の陰性的中率は5割程度であり,画像診断のみで判断をすることは難しいと考えられる3).
それゆえに画像診断に加えて,腋窩の低侵襲手術で腋窩リンパ節郭清省略を目指す試験が考案された.センチネルリンパ節生検でypN0を確認することの妥当性を検証した四つの前向き試験では4)
~
7),偽陰性率が当初閾値と決められていた10%を超えてしまった.NACによってリンパの流出パターンが変化することで真のセンチネルリンパ節が描出されない可能性がある事,転移リンパ節がNACの効果で縮小してセンチネルリンパ節として確実に同定することが難しくなることなどが,その原因として考えられている.しかし,そのサブグループ解析から,RIと色素のDual tracer mappingを用いて3個以上のセンチネルリンパ節を摘出するか,転移が証明されたリンパ節にクリップを付けておいて摘出するTADなどの方法を加えることで,FNRが10%以下になるとの報告が示された8).長期予後についてのデータは不十分ではあるが,これらの結果から,FNRを十分に下げる手技を加えた低侵襲手術が施行される機会が増加した.RI+色素法併用のセンチネルリンパ節生検(SLNB),Targeted axillary dissection(TAD),Targeted lymph node biopsy(TLNB),Tailored axillary surgery(TAS)などの手技がいくつかの国内外のガイドラインで推奨されてきている9)
~
11).
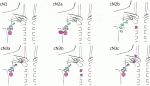
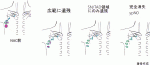
III.腋窩の低侵襲手術としてのTAD, TAS(表1)
TADとTASは,いずれもcN+乳癌患者の腋窩リンパ節を管理するための異なる腋窩の低侵襲手術手技である.
TADはセンチネルリンパ節生検に加えてNAC前に転移があったリンパ節を摘出して評価を行う,NAC後の腋窩の再ステージング(Re-staging)検査としての手技である2).一方TASはTAXIS試験の中で定義されている新しいコンセプトで,TADで摘出されるリンパ節に加えて,触診で転移が疑われる周囲のリンパ節を合わせて摘出することで,後の放射線治療等で制御可能なレベルまで腋窩の腫瘍負担(Tumor burden)を減らすことを目的とした,腋窩リンパ節郭清に替わる治療としての手技である12).TAXIS試験は,ヨーロッパの4か国で行われている無作為化対照Phase-Ⅲ試験で,TAS(+腋窩の放射線治療)の腋窩リンパ節郭清に対する非劣性を示すことを目的とした試験である.約300例(最終目標は1,500例)時点における,予定された報告では13),TAS後に腋窩リンパ節郭清を行った症例の70%にリンパ節転移が認められていた(すなわちFNR 70%という意味).TAXIS試験におけるTAS群では,NAC症例は半数以下しか含まれていない.半数以上を占める手術先行例には,術後の薬物療法+放射線療法が加わることでTAS群が非劣性となる可能性が考えられるが,NAC症例においてはTAS(+腋窩の放射線療法)の長期予後がどの程度になるのかは最終結果が待たれる.TAXIS試験の結果すなわち,TAS+腋窩への放射線療法が腋窩リンパ節郭清に非劣性であることが証明されていない現状では,NAC後の腋窩低侵襲手術は検査として行われるべきである.つまり低侵襲手術が安全に達成できる患者と,腋窩リンパ節郭清が必要な患者を適切に分けることであると考えている.

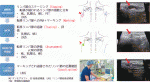
IV.TADの実際(図3)
NACが著効した患者に対してTADを行うためには,化学療法が始まる前からTADを行うことを見越していくつかの準備が必要となる.特に診断時のステージング(Staging),転移が疑われるリンパ節への印(Marking),NAC中のリンパ節の追跡(Tracing),NAC終了後のリンパ節の評価(Assessment),執刀前の転移があったリンパ節の位置確認(Localization)の五つの行程を行うことで,より精度の高い腋窩の再ステージングが可能となる.
1)診断時
NACが始まると転移リンパ節の状況は変化してしまうため,治療開始前にcN+の適切な診断が求められる.腋窩リンパ節郭清省略可能なcNステージについては,ESMOのガイドラインにおいてはcN1までと規定している9).当院ではLNUS,PET,CT,MRI等を用いて総合的にcNステージを判定し,特にLNUSを用いて転移個数,転移リンパ節の分布をシェーマで記載している(図3).転移が最も疑われるリンパ節からは,細胞診/針生検での確定診断が必須と考えている.急速増大したTNBCなどでは,しばしばリンパ節が反応性に腫大することがあるため,確実に転移があったことを細胞・病理診断で確定すべきである.また,穿刺がなされたリンパ節は,後で追跡ができるように印(Marking: クリップ,マーカー,点墨等)をつけておくことが望ましい.
2)NAC中間評価
主腫瘤の評価と共に,腋窩リンパ節の評価を併せて行う.当院では1レジメン終了後にMRI,乳房US,LNUSで主病変とリンパ節の評価を行っている.
周囲の解剖学的メルクマール(大胸筋,特徴的な脂肪とクーパー靱帯,正常リンパ節,血管等)を参考に,マークした転移リンパ節の追跡(Tracing)を行う.クリップ留置時はクリップを参考にすることが可能である.
3)NAC終了後(手術前)
転移リンパ節の評価を原発巣の化学療法効果判定と併せて行う.当院ではマンモグラフィ,乳房US,MRI,LNUSをもちいて,多職種チーム(乳腺外科医,放射線診断医,超音波検査技師)で臨床的(画像での)転移リンパ節消失(ycN0)の妥当性を評価(Assessment)する.ycN0の妥当性,Markingされたリンパ節が同定できて摘出可能と評価した時にTADが可能と判定している.
4)手術時
TADはセンチネルリンパ節生検(RI+色素法)に併せて,転移があったリンパ節を摘出する手技である.転移があったリンパ節がセンチネルリンパ節と一致しないことが20%程度あるため8),確実にマークをしたリンパ節が摘出できるように位置確認(Localization)を行う.術野での視認性改善を目的に,点墨を併用することが多い.
V.世界で行われているTADの現状について(適応と使用するマーカーについて)
NAC後の腋窩リンパ節郭清省略を目的として行うTADであるが,その適応,方法はさまざまで,まだ世界で統一されていないのが現状である.2022年に行われたヨーロッパを中心とした36か国,137施設へのアンケートによると14),TADの適応について,初診時の腫瘤径に制限をしている施設が73%で,T1~T3までとしている施設が45%であった.リンパ節転移については,42%が画像上リンパ節転移が3個までの患者をTADを行う対象としていた一方,12%はもともとの転移の個数によらずに行うと回答していた.HER2陽性およびトリプルネガティブのサブタイプはTADを実施する可能性が高く(それぞれ86%および79.1%),化学療法感受性の低いLuminal AおよびB乳癌はその可能性が低いとされていた(Luminal Aでは39.5%,Luminal Bでは62.8%).また,転移が証明されたリンパ節の位置を特定するために,6種類のマーカー(ワイヤー,125I-labelled seed,99mTc,Magnetic/radiofrequency markers,墨汁,クリップ)が使用されていた.Markingと同時にLocalizationが可能となるのは,術野でのトレーサーでMarkingされたリンパ節が同定できる放射性同位元素を用いたもの,Magnetic/radiofrequency markersを用いたものであり,この場合術前日のLocalizationがなくとも術野で摘出が可能となる(One-step procedure).また,墨汁を用いた場合は術野にて黒く染まったリンパ節を見つけることができれば,術野での視認性は可能であるため,One-stepで行うことも可能である.一方通常のクリップは,体表から指摘することが難しいため,術前日もしくは当日に位置を確認して視認できるようにする位置決め(Localization)が必要となる(Two-step procedure).日本で薬事審査が通っているものは数種類のClipのみであり(保険未収載),今後TADが広く行われるための課題である.
NCCNガイドラインでは11),NACが予定されているcN+患者に対しては細胞診,針生検施行時に最も転移が疑われるリンパ節にmarkerを留置すること,NAC後にcN0となった際にTADを行うことが推奨されている.
VI.TADのデメリットについて
腋窩の低侵襲手術には,腋窩リンパ節郭清に関連する合併症を回避できる可能性はあるが,その長期のQOL改善のデータ,再発リスクについてのデータはない.腋窩の低侵襲手術には低くなってきているとはいえ数%のFNRがあり,低侵襲手術では検出できない遺残癌が腋窩に残る可能性がある.アメリカの癌登録を用いた報告では15),2006~2014年にcT1-3,N1でNAC後に癌遺残が病理学的に認められた1,617例を対象として,SLNB(摘出リンパ節個数≦4個)+リンパ領域照射群(n=304例)と腋窩リンパ節郭清+リンパ領域照射群(n=1,313)とを比較している.5年のOSは患者背景を補正してもSLNB群が腋窩リンパ節郭清群に劣っていた(HR 1.563 95% CI 1.21-2.01, P=0.001).化学療法に抵抗性を示した癌を遺残させるリスクについては十分に情報提供をしたうえで,腋窩の術式を決めるべきである.
VII.おわりに
2022年版乳癌診療ガイドラインでは,cN+乳癌患者に対してNAC後ycN0が得られた際に,センチネルリンパ節生検のFNRを十分に下げる手技を加えた手技を用いての,腋窩の低侵襲治療が弱く推奨とされるようになった10).2024年のNCCNガイドラインでは11),腋窩リンパ節郭清省略が考慮される症例に対して最も疑わしいリンパ節にマーカーを留置すべきと変更されており,腫瘍学的安全性について長期の前向きデータが十分とは言えないが,cN+患者に対するNAC後の腋窩の低侵襲手術が世界中で広まってきている.
術前化学療法の副作用に耐えた患者の多くは,可能であれば腋窩リンパ節郭清を避けたいと願っている.TADが可能となりそうな症例への初期治療開始時のマーキング,マーカー留置が保険収載され,多くの患者が治療の効果によってはTADの候補となるのが理想的である.
腋窩のステージング,化学療法の効果判定(ycN0の診断)には,超音波,CT,PET,MRI等世界でも多くのモダリティが試されているが確立されたものはなく,そして多様な実臨床の現場の手術方法はさらに不確定要素を多く含んでおり,これらの手技が世界で完全に統一されることは難しいのかもしれない.化学療法に抵抗性を示した遺残癌が残る場合の,腋窩低侵襲手術が予後を悪化させる可能性については,米国のリアルワールドデータで示した通りであり15),腋窩に多くのTumor burdenを残さないように,外科医はより慎重にTADの適応,手術方法を考慮すべきである.
画像診断を多く用いる日本の実臨床に適した,安全に腋窩の低侵襲手術が可能な患者群を選別できる方法が提唱されるには,統一された診断,治療プロトコールで行われた腋窩の低侵襲手術の治療データ集積が必要である.今後それらの結果や社会的な基盤の整備が進み,腋窩の低侵襲手術が広く日本国内でも行われることを切望する.
利益相反:なし
文献
1) Orr RK : The impact of prophylactic axillary node dissection on breast cancer survival--a Bayesian meta-analysis. Ann Surg Oncol, 6(1): 109-116, 1999.
2) Caudle AS , Yang WT , Krishnamurthy S , et al.: Improved Axillary Evaluation Following Neoadjuvant Therapy for Patients With Node-Positive Breast Cancer Using Selective Evaluation of Clipped Nodes:Implementation of Targeted Axillary Dissection. J Clin Oncol, 34(10): 1072-1078, 2016.
3) Maeshima Y , Sakai T , Ogiya A , et al.: Assessment of axillary node status by ultrasound after neoadjuvant chemotherapy in patients with clinically node-positive breast cancer according to breast cancer subtype. Sci Rep, 11(1): 10858, 2021.
4) Classe JM , Loaec C , Gimbergues P , et al.:Sentinel lymph node biopsy without axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients:the GANEA 2 study. Breast Cancer Res Treat, 173(2): 343-352, 2019.
5) Boileau JF , Poirier B , Basik M , et al.: Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer:the SN FNAC study. J Clin Oncol, 33(3): 258-264, 2015.
6) Kuehn T , Bauerfeind I , Fehm T , et al.: Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA):a prospective, multicentre cohort study. Lancet Oncol, 14(7): 609-618, 2013.
7) Boughey JC , Suman VJ , Mittendorf EA , et al.: Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer:the ACOSOG Z1071 (Alliance) clinical trial. JAMA, 310(14): 1455-1461, 2013.
8) Boughey JC , Ballman KV , Le-Petross HT , et al.: Identification and Resection of Clipped Node Decreases the False-negative Rate of Sentinel Lymph Node Surgery in Patients Presenting With Node-positive Breast Cancer (T0-T4, N1-N2) Who Receive Neoadjuvant Chemotherapy:Results From ACOSOG Z1071 (Alliance). Ann Surg, 263(4): 802-807, 2016.
9) Loibl S , André F , Bachelot T , et al.: Early breast cancer:ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol, 35(2): 159-182, 2024.
10) Sakai T , Kutomi G , Shien T , et al.: The Japanese Breast Cancer Society Clinical Practice Guidelines for surgical treatment of breast cancer, 2022 edition. Breast Cancer, 31: 1-7, 2024.
11) NCCN clinical practice Guidelines in Oncology:Breast Cancer. Version 2. 2024-March 11, 2024. [cited June 18, 2024]. Available from: https://www.nccn.org/professionals/physician_ gls/pdf/breast.pdf
12) Henke G , Knauer M , Ribi K , et al.: Tailored axillary surgery with or without axillary lymph node dissection followed by radiotherapy in patients with clinically node-positive breast cancer (TAXIS):study protocol for a multicenter, randomized phase-Ⅲ trial. Trials, 19(1): 667, 2018.
13) Weber WP , Matrai Z , Hayoz S , et al.: Tailored axillary surgery in patients with clinically node-positive breast cancer:Pre-planned feasibility substudy of TAXIS (OPBC-03, SAKK 23/16, IBCSG 57-18, ABCSG-53, GBG 101). Breast, 60: 98-110, 2021.
14) Kontos M , Kanavidis P , Kühn T , et al.: Targeted axillary dissection:worldwide variations in clinical practice. Breast Cancer Res Treat, 204(2): 389-396, 2024.
15) Almahariq MF , Levitin R , Quinn TJ , et al.: Omission of Axillary Lymph Node Dissection is Associated with Inferior Survival in Breast Cancer Patients with Residual N1 Nodal Disease Following Neoadjuvant Chemotherapy. Ann Surg Oncol, 28(2): 930-940, 2021.
PDFを閲覧するためには Adobe Reader が必要です。