日外会誌. 125(4): 340-347, 2024
特集
肺癌外科診療up to date
7.周術期治療の今とこれから
|
藤田医科大学 呼吸器内科学 大矢 由子 |
切除可能非小細胞肺癌(NSCLC)は今なお予後の悪い疾患で,ステージ 1でも遠隔転移再発をきたす症例が存在する.このことから,一部は切除時点ですでに微小転移が存在すると想定され,長年にわたり周術期薬物治療が検討されてきた.近年,術後補助治療では免疫チェックポイント阻害薬(ICI) アテゾリズマブとEGFR阻害薬オシメルチニブが,術前治療では化学療法+ICI ニボルマブが承認され,肺癌周術期薬物療法は大きな変化の時を迎えた.従来の細胞障害性抗癌剤では5年生存率で5%の上乗せ効果が示されていたが,抗癌剤後にアテゾリズマブを上乗せすることで,抗癌剤投与後に支持療法のみを行った群に比して有意に無再発生存期間(DFS)を改善した(未到達 vs. 35カ月,ハザード比0.66).また,術前のニボルマブ+化学療法も化学療法単独に比し有意にDFSを改善した(21カ月 vs. 32カ月,ハザード比0.63).EGFR陽性症例では術後のオシメルチニブ投与により,DFSのみならず5年生存率の有意な改善が示された(88% vs. 78%,ハザード比0.49).しかし,これらは新規の治療法であり,日常臨床に導入するにあたり様々な課題に直面している.さらに,現在ほかにも様々な術前,術後治療の臨床試験が行われており,さらに術前後いずれにも治療が加わるレジメンも開発されており,今後周術期治療の選択肢は増えるだろう.術前と術後いずれの治療が良いのか,という議論がしきりになされているが,決着はついておらず,また,明確な患者選択の基準もない.周術期には,これから手術を行う上で,あるいは手術侵襲が加わった後の治療という意味で,高い安全性が求められる一方,十分な治療効果を求めたいジレンマがある.このことからも患者選択が現在の喫緊の課題であると言える.本稿では現在承認されている肺癌周術期の治療法の解説と課題の提示に加え,現在報告されつつある新規の治療法や患者選択への検討,免疫療法の強化について解説する.
キーワード
非小細胞肺癌, 術前治療, 術後治療, 分子標的治療薬, 免疫チェックポイント阻害薬
I.はじめに
周術期治療の対象となるようなステージⅡ以上の非小細胞肺癌(NSCLC)症例は,切除後の5年無再発生存(DFS)率が50%以下と予後不良な集団である1).肺癌切除例では病期が進むにつれて遠隔再発が増えるが,Ⅰ期切除例でも一部は遠隔再発をきたす.すなわち,切除時に非進行肺癌と診断された症例の一部は,すでに微小遠隔転移を有している可能性がある.そのため,治療成績の向上を目指して種々の周術期薬物治療が検討されてきた.しかし,旧来のプラチナ併用治療における5年DFS率の改善は5%にとどまり,必ずしも満足のいくものではなかった2).2022年,肺癌術後補助治療として免疫チェックポイント阻害薬(ICI)であるアテゾリズマブ(PD-L1阻害薬)3)とepidermal growth factor receptor(EGFR)阻害薬であるオシメルチニブ4)が承認された.加えて,術前治療としてPD-1抗体であるニボルマブ+化学療法5)が承認され,周術期治療が大きく変わろうとしている.本稿では新たに承認されたこれらの治療法に加え,現在検討されている新規の治療法,患者選択,免疫療法の強化など新規の取り組みについて概説する.
II.術後アテゾリズマブ3)
Impower010試験は,完全切除を受けたⅠB~ⅢA期(第7版)のNSCLCを対象に,術後補助療法としてプラチナ併用化学療法を受けた後のアテゾリズマブ(Atezo)と支持療法(BSC)を比較するランダム化第Ⅲ相試験である.主要評価項目はPD-L1陽性(SP263,TC≧1%),Ⅱ/ⅢA期におけるDFSであった.国内症例149例を含む1,280例が登録され,ランダム化されたのは1,005例(78.5%)であった.登録症例の背景は,扁平上皮癌がAtezo群で35.3%,BSC群で33.5%,全体の約70%が男性であった.腫瘍のPD-L1発現は両群半数程度が陽性(Atezo群57.4%,BSC群51.9%)で,stage ⅢAは,Atezo群 40.4%,BSC群 41.8%であった.また,Atezo群 13.5%,BSC群 16.6%がEGFR遺伝子変異あるいはALK融合遺伝子を有していた.腫瘍細胞中,PD-L1発現陽性細胞が占める割合(TC)≧1%(stage Ⅱ/ⅢA)のDFSは,Atezo群 未到達,BSC群は35.3カ月,ハザード比(HR)0.66(95%CI,0.50-0.88)であった.同集団における全生存期間(OS)の中間解析ではOS両群未到達,5年生存率はAtezo群76.8%,BSC群67.5%であった.この時点でのOSイベント発生率は25%であった.Atezo群でGrade3以上の毒性を21.8%に認め,うち1.6%が死亡した.また,immune related advarsed event (irAE)はAtezo群で52%(Grade3以上は8.0%)に出現し,2例が死亡した(心筋炎,肺炎が1例ずつ).
PD-L1発現別のサブグループ解析では,BSC群と比較したAtezo群におけるDFSのHRは,TC 1~49%で0.868(95%CI,0.600-1.256),TC ≧50%で0.432(95%CI,0.272-0.684)であり,Atezo使用とTC ≧50%に有意な交互作用を認めた(p= 0.0192).加えて,OSもTC 1~49%では1.218 (95%CI,0.705-2.104),TC ≧50%では0.366 (95%CI,0.181-0.742)で,Atezo使用とTC ≧50%に有意な交互作用を認めた(P=0.0091).これらは事前に規定されていないサブグループであるが,欧州ではこの結果も鑑みて本レジメンの適応はPD-L1 50%以上に制限されており6),また,最適使用推進ガイドラインにおいても「PD-L1の発現状況別(1≦TC<50%およびTC≧50%)の本剤の有効性について十分に理解した上で,適応患者の選択を行うことが適切である.」と記載された7).現時点で本邦では,PD-L1発現が1%以上であれば,Atezo使用は可能だが,肺癌診療ガイドライン上の位置付けは,PD-L1発現50%以上で推奨の強さ2(合意率53%)であるのに対し,1~49%は推奨度決定不能とされる.しかし,そもそもPD-L1発現50%以上群と1~49%群との比較は事前規定されていないサブグループ解析であり,加えてOSに関するデータは未成熟であるため,PD-L1発現による患者選択について現時点で決定的な結論を下すことはできないと考える.
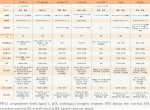
術後ICIの補助治療に関する臨床試験は,Impower010試験以外にも複数実施されており,一部はまだ結果が公表されていない.表1にまとめる.

III.術後オシメルチニブ4)
肺癌のドライバー遺伝子変異に基づく周術期治療として,EGFRに対するオシメルチニブ,ALK融合遺伝子陽性肺癌(以下,ALK陽性肺癌)に対するアレクチニブ,Rearranged during transfection(RET)融合遺伝子陽性肺癌(以下,RET陽性肺癌)に対するセルペルカチニブが検討されている.その中で,現時点では唯一術後病理病期Ⅱ~ⅢA期(第8版)*完全切除例に対してオシメルチニブによる術後補助治療が本邦で承認されている承認根拠となったADAURA試験は,完全切除された病理病期ⅠB~ⅢA期NSCLCでEGFR変異陽性(19delとL858Rのみ)を対象にプラセボ(PBO)とオシメルチニブ(Osi)を比較したランダム化第三相試験である.治療期間は3年間で,主要評価項目はⅡ/ⅢA期のDFSであった.患者背景は,女性が7割程度であり,ⅢA期はOsi群で34%,PBO群で35%であった.術後補助プラチナ併用化学療法は,プロトコール上必須とされていないが,両群ともに6割の患者で行われていた.Ⅱ~ⅢA期のDFSは,3回目の解析時点(データカットオフは2022年4月11日)でOsi群 65.8カ月,PBO群 21.9カ月,HR 0.23(95%CI,0.18-0.30)であった.サブグループ解析でも病理病期やEGFRのサブタイプ,人種を含む全ての項目でPBO群に比しOsi群で良い傾向であった.
EGFR阻害薬による術後補助治療は,複数の先行試験において,DFSの延長のみでOSの延長は得られないという結果であったことから,ADAURA試験のOSの結果が明らかになるまではこの治療の有用性は評価不能という懐疑的な意見も多かった.そのような状況の中,2023年の米国臨床腫瘍学会(ASCO)Annual Meetingで,ADAURA試験のOSの最終解析結果が発表された.Osi群では,PBO群に比し,HR 0.49という顕著な死亡リスクの低減が示され,加えて,内服終了後に生存曲線の傾きがやや強くなるものの,それでもなお両群の生存曲線が収束しないことが示され,Osiによる術後補助治療の有用性が明らかになった.ⅠB期でのDFSは両群で未到達であるがHR 0.41(95%CI,0.23-0.69)でありOsi群が良好であった.安全性は,Osi群でグレード3の毒性が22.6%であったが,死亡に至る有害事象はなかった.Osi群における間質性肺炎(ILD)は3%,グレード3以上のQT延長は1%であった.日本人の進行期肺癌におけるオシメルチニブによる治療に際してはILD発症率が高いことが報告されており8),ADAURA試験でも懸念事項であった.日本人サブグループデータでは,ILD発症率は13%と全体集団よりもその頻度は高かったが,ILD発症例全例でグレード1~2であった.
IV.術前化学療法+ニボルマブ5)
Checkmate816試験は,EGFR/ALK陰性臨床病期ⅠB~ⅢA期(第7版)肺癌を対象として,PD-1抗体であるニボルマブ+化学療法(Nivo+CT)と化学療法(CT)を比較するランダム化第三相試験である.Nivo+CT群ではニボルマブ360mgと併用してpaclitaxel + carboplatin,pemetrexed + cisplatin(腺癌のみ),gemcitabine + cisplatin(扁平上皮癌のみ)が規定されていた.CT群の化学療法はvinorelbine + cisplatin,docetaxel + cisplatin,or paclitaxel + carboplatin,gemcitabine + cisplatin(扁平上皮癌のみ),pemetrexed + cisplatin(非扁平上皮癌のみ)が許容されていた.両群ともに化学療法は3サイクル行い,その後画像での再ステージングを行った上で手術を行う.主要評価項目はevent-free survival (EFS)(eventの定義は,手術の妨げになる疾患進行,手術後の疾患進行または再発,手術に至らなかった症例の疾患進行,全死亡)と病理学的完全奏効(pCR)率であった.全体の70%程度が男性であり,扁平上皮癌がNivo+CT群で48.6%,CT群で53.1%だった.また,両群ともに60%以上がステージⅢAであった.Nivo+CT群では,CT群に比しEFSがHR 0.63と良好であり,3年フォローアップでも曲線が収束しないことが欧州肺癌学会(ELCC2023)で示された.pCR率はNivo+CT群 24%,CT群 2%と,Nivo+CT群で有意に高率であった.さらに,どちらの群においてもpCRが得られた症例では予後良好であるが,pCRが得られなかった症例ではNivo+CT群とCT群は生存曲線における上乗せ効果は乏しかった.pCRに有意に関わる臨床因子はなく,PD-L1発現ですらpCR率との相関が乏しいことより(PD-L1発現,0%/1~49%/50%以上; pCR率,10.6%/8.5%/12.8%),治療前のpCR予測は難しいと言える.EFSのサブグループ解析では,CT群と比較した際のNivo+CT群のEFS上乗せ効果は,扁平上皮癌と比較して腺癌,ⅠB~Ⅱ期と比較してⅢA期の方が良好な傾向がみられたことから,現状では組織型と病期がEFSの予測因子の一つと考えられている.
Checkmate816レジメンの懸念点は,疾患進行や有害事象により,症例の一部が手術不能になることである.手術不能になる率は,Ⅱ期ではNivo+CT群12%,CT群13%と同等であるのに対し,Ⅲ期ではNivo+CT群17%,CT群25%と,CT群でより高率であった.手術不能となった理由の多くは疾患進行であった.一方,少数ではあるが有害事象で手術ができなくなる症例もあったが,現時点ではその危険性は治療前に予測できない.
化学療法にICIを加える術前治療に関しては,十分な説明と理解に基づいて患者の同意がなされることが,これまで以上に求められる.
ICIを含む術前あるいは術前+術後治療の臨床試験を表2にまとめる.
V.術前と術後どちらが良いのか
ICI出現前の化学療法の時代においては完全切除例(病期は問わない)を対象とした臨床試験のメタ解析で術前,術後どちらでも5年生存率で約5%の向上であり,大きな差はなかった2)
9).しかし,ICIを含むレジメンの治療は,術前に行うか術後に行うかによって,その成績が大きく異なる可能性がある.表3に術前術後治療それぞれのメリットとデメリットをまとめたが,術前治療では,特に抗原量が多く,局所リンパ節が存在するので抗腫瘍T細胞反応のプライミングが促進されることが最も大きなメリットであろう10).
免疫治療を術前に行うメリットに関しては,動物実験による複数の研究報告があるが11),⽶国の Southwest Oncology Group(SWOG)で行われたS1801試験で臨床上明らかな知見が示された.切除可能臨床病期Ⅲ~Ⅳ期のメラノーマを対象に,術後ペムブロリズマブを18サイクル投与する群(対象群)と,術前に3サイクル,術後15サイクルのペムブロリズマブを投与する群(試験群)を比較しているが,主要評価項目であるEFSにおいて,試験群が対象群に比し有意に良好であった(ハザード比 0.58,95%信頼区間 0.37~0.87)12).また,先日アップデートが報告されたが,生存曲線が収束しないことも示された13).ペムブロリズマブの総治療回数は同じでも,術前治療を行うことでEFSを延長できたことから,免疫チェックポイント阻害薬による術前治療への期待は高まった.一方で,メラノーマと肺癌では様々な性質が異なる.解剖学的な観点では,肺癌では主病巣や転移リンパ節と肺門部主要血管の位置関係によっては片肺全摘のような比較的大きな機能喪失を伴う術式を選択せざるを得ない.また,肺癌では心肺機能低下例も一定数存在し術前治療が困難であることも多い.加えて,本邦では肺癌患者の平均年齢は75歳以上であり,術前治療を行うことができる患者はメラノーマよりだいぶ少ない可能性がある.
肺癌でも切除可能Ⅱ~Ⅲ期を対象として術前補助療法後手術と手術先行療法を比較することが現在JCOGで検討されている.

VI.患者選択
周術期治療を受ける患者には,①手術だけで治る患者,②微小残存病変があり潜在的な進行癌だが薬物療法で制御できる患者,③微小残存病変があり潜在的な進行癌であり薬物療法で制御できない患者の3群が含まれる.これらのうち,②のみが真に周術期治療でメリットを受ける患者であるが,この患者を選別するにはどのような手法が適切だろうか.
DYNAMIC試験は,完全切除されたⅡ期大腸癌に対するCirculating tumor DNA(ctDNA)に基づいた患者選択(術後補助治療の要否選択)の可能性を検討した試験である14).完全切除されたⅡ期大腸癌は,T4,転移リンパ節個数,組織学的分化度,腸閉塞,腸穿孔などの予後不良因子がある場合に術後補助治療の対象となる.本試験では通常の予後不良因子に基づいた患者選択を行う群(標準群)と,ctDNAが陽性の場合にのみ術後補助治療を行うctDNAガイド群にランダム化された.その結果,術後補助治療を受けた患者の割合は標準群28%に対してctDNAガイド群では15%と低値であったが,主要評価項目である2年無増悪生存率は両群で同等であった(標準群92.4%,ctDNAガイド群91.7%).ctDNAガイドにより,無再発生存率を損なうことなく補助化学療法の施行患者数を減らすことができた.しかし,ctDNA陰性でも一部は再発をきたす.そこで,ctDNA群を従来の予後不良因子の有無で分けると,ctDNA陰性でも予後不良因子を有する場合にはctDNA陽性群と生存曲線が重なることが示された.つまり,ctDNAだけではなく従来の予後不良因子との組み合わせにより,化学療法が必要ない患者(上記①の患者)の効率的な選別ができることが示された.このctDNAを用いたMinimal Residual Disease(MRD)解析は,既に血液癌で臨床使用されている.肺癌では検出感度の問題があるが,いくつかの報告がなされており15)
16)患者選択において現時点で最も期待されるものの一つであろう.
VII.新規の試み
現在最も期待される新規の試みの一つは免疫治療の強化であろう.ICIの効果を強化するためにPD-1/L1治療に加え他のチェックポイント阻害薬を併用する(複合免疫療法の)試験が進行期では複数報告されている17)
18).進行期肺癌ですでに承認されているものとしてはCTLA-4阻害薬がある.CTLA-4阻害薬併用の利点は,長期奏効に至る割合が高いことである.進行NSCLC初回治療例のNivo+イピリムマブ(Ipi)併用療法による5年OS率は24%,Nivo単剤では17%と報告されている19).NivoとIpiの併用療法によるNivo単独療法への上乗せ効果はPD-L1発現に影響されないため,進行期におけるCTLA-4阻害薬併用療法は,PD-L1陰性例で選択されることが多い.一方,NivoとIpiの併用療法では,免疫関連有害事象(irAE)の発現率が増える19).そのほかの免疫チェックポイント阻害薬との併用においても,周術期への適用は慎重になるだろう.そのような中,プラチナ製剤ベースの補助化学療法を受けた完全切除非小細胞肺癌患者を対象としたT-cell immunoreceptor with Ig and ITIM domains(TIGIT)抗体であるチラゴルマブ+アテゾリズマブとプラセボ+アテゾリズマブを比較する第Ⅲ相試験(SKYSCRAPER-15)が現在行われており結果がまたれる.
もう一つの試みは,患者教育と考える.周術期治療は未だどの治療が最善かというエビデンスは確立していない.加えて,治療費や休職に伴う経済的な不利益(経済毒性),治療自体やその後の療養に要する時間の問題(時間的な毒性),有害事象などの懸念が大きいが,それらのコストは患者に大きくのしかかる.どんな治療を受けるか,そもそも侵襲的な治療を受けるかどうかについても,患者個人とご家族の価値観が大きく影響するだろう.そのため,患者と医療者が相談・協力して一緒に意思決定してゆくプロセス「シェアード・デジションメイキング(Shared Decision Making, SDM)」が大切と考えられるようになった20).一方で,肺癌と診断されてまもない患者は選んだり考えたりする土台となる知識もなく,精神的に動揺している場合もある.そのため,前もって「予習」しておくことができるような教材の開発や,説明方法のブラッシュアップへの取り組みも各施設や学会で真剣に行われている.
VIII.おわりに
肺癌の周術期治療はここ数年で大きな変遷を遂げた.そして,前述の通り,従来の化学療法のみの周術期治療と比較し,完全切除されたⅡ期〜ⅢA期症例に新規の薬剤を用いた場合には,より良好なDFSが得られることが示された.その中で,術前治療と術後治療のどちらが良いのか,という議論が多くなされるが,結論は得られておらず,また,現時点では明確な患者選択基準も示されていない.
対象患者のうち,真に周術期治療の恩恵を受けるのは確かに一部であるが,治癒しうる集団であり,貪欲に効果を求めたい.そのため,患者選択が喫緊の課題であり,その手法として注目されるのがct DNAに基づいたMRDであろう.感度の問題等がまだあるものの,他の癌種での成功を鑑みると期待は大きいだろう.
利益相反
講演料など:日本イーライリリー株式会社,アストラゼネカ株式会社,中外製薬株式会社,MSD株式会社,ヤンセンファーマ株式会社,大鵬薬品工業株式会社,第一三共株式会社,武田薬品工業株式会社,アムジェン株式会社,ブリストル・マイヤーズ スクイブ株式会社,ノバルティス ファーマ株式会社,小野薬品工業株式会社
文献
1) Okami J , Shintani Y , Okumura M , et al.: Demographics, safety and quality, and prognostic information in both the seventh and eighth editions of the TNM classification in 18,973 surgical cases of the Japanese Joint Committee of Lung Cancer Registry Database in 2010. J Thorac Oncol, 14: 212-222, 2019.
2) Pignon JP , Tribodet H , Scagliotti GV , et al.: Lung adjuvant cisplatin evaluation:a pooled analysis by the LACE Collaborative Group. J Clin Oncol, 26: 3552-3559, 2008.
3) Felip E , Altorki N , Zhou C , et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010):a randomised, multicentre, open-label, phase 3 trial. Lancet, 398: 1344-1357, 2021.
4) Wu YL , Tsuboi M , He J , et al.: Osimertinib in resected EGFR-mutated non–small-cell lung cancer. N Engl J Med, 383: 1711-1723, 2020.
5) Forde PM , Spicer J , Lu S , et al.: Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med, 386: 1973-1985, 2022.
6) European Commission approves Roche’s Tecentriq as adjuvant treatment for a subset of people with early-stage non-small cell lung cancer. News release. Roche. June 9, 2022. Accessed June 13, 2022. https://bit.ly/3xOWv6S
7) 厚生労働省.最適使用推進ガイドライン アテゾリズマブ(遺伝子組換え)(販売名:テセントリク点滴静注 1200 mg)~非小細胞肺癌~.平成30年4月(令和4年5月改訂). https://www.mhlw.go.jp/content/12404000/000945177.pdf
8) Sakata Y , Sakata S , Oya Y , et al.: Osimertinib as first-line treatment for advanced epidermal growth factor receptor mutation-positive non-small-cell lung cancer in a real-world setting (OSI-FACT). Eur J Cancer, 159: 144-153, 2021.
9) Group NM-aC . Preoperative chemotherapy for non-small-cell lung cancer:a systematic review and meta-analysis of individual participant data. Lancet, 383: 1561-1571, 2014.
10) Chamoto K , Chowdhury PS , Kumar A , et al.: Mitochondrial activation chemicals synergize with surface receptor PD-1 blockade for T cell-dependent antitumor activity. Proc Natl Acad Sci U S A, 114:E761-E770, 2017.
11) Liu J , Blake SJ , Yong MC , et al.: Improved Efficacy of Neoadjuvant Compared to Adjuvant Immunotherapy to Eradicate Metastatic Disease. Cancer Discov, 6: 1382-1399, 2016.
12) Patel SP , Othus M , Chen Y , et al.: Neoadjuvant–adjuvant or adjuvant-only pembrolizumab in advanced melanoma. N Engl J Med, 388: 813-823, 2023.
13) Sharon CE , Tortorello GN , Ma KL , et al.: Long-term outcomes to neoadjuvant pembrolizumab based on pathological response for patients with resectable stage Ⅲ/Ⅳ cutaneous melanoma. Ann Oncol, 34: 806-812, 2023.
14) Tie J , Cohen JD , Lahouel K , et al.: Circulating tumor DNA analysis guiding adjuvant therapy in stageⅡ colon cancer. N Engl J Med, 386: 2261-2272, 2022.
15) Chaudhuri AA , Chabon JJ , Lovejoy AF , et al.: Early Detection of Molecular Residual Disease in Localized Lung Cancer by Circulating Tumor DNA Profiling. Cancer Discov, 7: 1394-1403, 2017.
16) Sugimoto A , Matsumoto S , Udagawa H , et al.: A Large-Scale Prospective Concordance Study of Plasma- and Tissue-Based Next-Generation Targeted Sequencing for Advanced Non-Small Cell Lung Cancer (LC-SCRUM-Liquid). Clin Cancer Res, 29: 1506-1514, 2023.
17) Hellmann MD , Paz-Ares L , Bernabe Caro R , et al.: Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer. N Engl J Med, 381: 2020-2031, 2019.
18) Cho BC , Abreu DR , Hussein M , et al.: Tiragolumab plus atezolizumab versus placebo plus atezolizumab as a first-line treatment for PD-L1-selected non-small-cell lung cancer (CITYSCAPE):primary and follow-up analyses of a randomised, double-blind, phase 2 study. Lancet Oncol, 23: 781-792, 2022.
19) Brahmer JR , Lee JS , Ciuleanu TE , et al.: Five-year survival outcomes with nivolumab plus ipilimumab versus chemotherapy as first-line treatment for metastatic non–small-cell lung cancer in CheckMate 227. J Clin Oncol, 41: 1200-1212, 2023.
20) Shiraishi Y , Hakozaki T , Nomura S , et al.: A Multicenter, Randomized Phase Ⅲ Study Comparing Platinum Combination Chemotherapy Plus Pembrolizumab With Platinum Combination Chemotherapy Plus Nivolumab and Ipilimumab for Treatment-Naive Advanced Non–Small Cell Lung Cancer Without Driver Gene Alterations:JCOG2007 (NIPPON Study). Clin Lung Cancer, 23:e285-e288, 2022.
PDFを閲覧するためには Adobe Reader が必要です。