日外会誌. 124(5): 416-421, 2023
特集
外科医によるこれからの癌薬物療法―最新知識と安全で効果的な遂行のコツ―
6.大腸癌における薬物療法
|
九州大学大学院 消化器・総合外科 沖 英次 , 中西 良太 , 安藤 幸滋 , 南原 翔 , 吉住 朋晴 |
大腸癌に対する薬物療法の進歩はめざましい.現在ではさまざまな分子標的薬や支持療法によって,切除不能大腸癌であってもQOL(quality of life)を保ちながら約30カ月以上の生存期間中央値を得るまでになっている.薬剤の適切な治療法の選択のためには,RAS/BRAF, MSI, HER2などの遺伝子ステータスの他,原発巣の部位など多くのバイオマーカーが重要となっている.一方で,根治切除後の術後補助化学療法は,病理学的分類のみでその適応が決定されている.術後補助療法の効果を層別化する遺伝子学的バイオマーカーとして,今後Circulating DNA(ctDNA:血中微量遊離がん由来DNA)をはじめとした新しい手法が注目される.
キーワード
分子標的薬, 抗VEGF抗体, 抗EGFR抗体, CGP検査, ctDNA
I.はじめに
切除不能大腸癌はさまざまな分子標的薬や支持療法によって,約30カ月以上の生存期間中央値を得るまでになった.しかし適切な治療法の選択のため,RAS/BRAFやHER2などの遺伝子ステータスの他,遺伝子パネル検査などのさまざまなバイオマーカーの検査が必要である.一方で,根治切除後の補助療法の選択には,病理学的分類以外で患者を層別化するバイオマーカーがない.将来はCirculating DNA(ctDNA:血中微量遊離がん由来DNA)やオミックス解析をはじめとした新しい手法をバイオマーカーとした治療選択が行えるようになる可能性が高い.治療を行う医師には,将来がん薬物療法の知識だけでなく,ゲノム解析,オミックス解析などに対する深い知識が要求されるようになるだろう.
II.バイオマーカーと大腸癌治療
大腸癌の薬物治療を選択するためには,コンパニオン検査もしくは遺伝子パネル検査が必要である.コンパニオン検査は,特定の薬剤の効果を予測するバイオマーカー検査であり,抗EGFR抗体薬のためのRAS検査,BRAF阻害剤のためのBRAF遺伝子検査,免疫チェックポイント阻害剤のためのMSI(マイクロサテライト不安定性)検査およびMMR検査,さらには抗HER2療法のためのHER2検査などがある.これに対し遺伝子パネル検査では,がんゲノムプロファイリング(Comprehensive genome profiling:CGP)検査により一度に大量の遺伝子の異常を検討し,最適な医療を選択するいわゆるPrecision medicineである.本邦では,2017年10月に「がんゲノム医療中核拠点病院」と「がんゲノム医療連携病院」が整備され,2019年6月にがん組織検体を用いたがんCGP検査が保険収載となり,2021年8月には,血中循環腫瘍由来DNA(Circulating tumor DNA:ctDNA)からCGP検査を行うリキッドバイオプシーも使えるようになった.このCGP検査は,当初は標準治療が終了した症例を対象としていたため,本来の検査意義が発揮できていなかった.「大腸癌治療ガイドライン2022年度版」では,治療ラインのみでがんゲノムプロファイリング検査を行う時期を限定しないことが記載され1),治療開始後から後方ライン治療移行までの間に検査を行うことが推奨されている.たとえば融合遺伝子の変化がCGP検査で見つかった場合,保険診療でNTRK阻害剤が使用可能である.さらには特定の遺伝子異常を標的とした新しい治療の治験に参加できることもある.一次治療の効果が悪い症例や,若年発症者などを中心に積極的にCGP検査の必要性を考慮することが重要である.
III.切除不能大腸癌の一次治療の選択
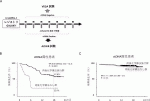
大腸癌の一次治療の選択には,大腸癌治療ガイドラインに記載がある「一次治療の方針を決定するためのプロセス」のとおり,パフォーマンスステータス,遺伝子変異ステータス,原発部位などに応じて治療方針を決定する.治療選択では殺細胞性薬物療法によるベースレジメンとしてのmFOLFOX6(fluorouracil, leucovorin, and oxaliplatin)療法,CAPOX(capecitabin and oxaliplatin),SOX(S-1 and oxaliplatin),CAPXIRI(capecitabin and irinotecan), FOLFIRI(fluorouracil, leucovorin, and irinotecan)療法,FOLFOXIRI(fluorouracil, leucovorin, oxaliplatin and irinotecan)療法があり,これに分子標的薬を組み合わせる.大腸癌の一次治療で用いることができる分子標的治療薬は抗血管内皮細胞増殖因子(vascular endothelial growth factor:VEGF)ヒト化モノクローナル抗体であるbevacizumabと,抗上皮細胞増殖因子(Epidermal growth factor receptor:EGFR)ヒト/マウスキメラ型IgG1モノクローナル抗体のcetuximabと,完全ヒト型IgG2モノクローナル抗体のpanitumumabである.抗EGFR抗体薬はRAS野生型の症例のみに使用可能である.一次治療における抗VEGF抗体と抗EGFR抗体の選択は長い間議論されてきた.これは,RAS野生型左側原発大腸癌での抗EGFR抗体の有用性を示す検討がすべて付随研究などの観察研究であったからである.ごく最近,RAS遺伝子野生型の左側大腸癌においてmFOLFOX6+ panitumumab療法とmFOLFOX6+bevacizumab療法を比較したランダム化比較試験であるPARADIGMの結果が本邦から発表された2).823例が試験群とコントロール群に1:1で無作為に割り付けられ,層別化因子として,施設年齢(20~64歳vs 65~79歳),肝転移の有無が用いられた(図1A).主要評価項目の左側原発の症例における全生存期間(OS)は左側症例においてmFOLFOX6+panitumumab療法群で有意に良好であった[OS中央値:37.9カ月vs 34.3カ月,HR:0.82(0.68~0.99)p=0.031](図1B).左側,右側をあわせた全症例でも有意に全生存を延長している(図1).この結果により,RAS野生型の左側大腸癌で強力な治療が適応となる患者には,抗EGFR抗体を用いた一次治療が標準的な治療と言えるようになった.生存曲線を見ると,抗EGFR抗体使用群の生存は,特に2年目以降で抗VEGF抗体使用群より上回っており,薬物療法で腫瘍が縮小したのちにR0切除された症例が全生存を延長していることが指摘されている.切除不能大腸癌であっても外科治療が生存期間の延長に大きな役割を果たしていることが再認識された.
PARADIGM試験の結果から,右側大腸癌では,RASステータスにかかわらず,抗VEGF抗体であるbevacizumabを分子標的薬として選択することが現時点では勧められる.特に薬物療法後の切除を念頭にしている場合には,FOLFOXIRI療法との組み合わせで高い奏効率が期待できる.
このほかMicrosatellite Instability high frequency(MSI-H)症例には一次治療としてpembrolizumabやnivolumabなどの免疫チェックポイント阻害剤が使用される.nivolumabとIpilimimabの併用療法も2次治療以降では使用可能である.MSI-Hは,DNAミスマッチ修復遺伝子の異常により,ゲノム上に存在する繰り返し配列の長さが不安定になった腫瘍である.最近ではDNAミスマッチ修復タンパクの欠損(deficient Mismatch repair:dMMR)を免疫染色で評価する方法も薬事承認された.リンチ症候群の症例の多くはMSI-H, dMMRであるが,リンチ症候群でなくても高齢者の右結腸癌にMSI-Hの頻度は高い.このような症例はBRAF変異も同時にみられることもあり注意が必要である.

IV.2次治療以降の治療選択
2次治療では,ベースレジメとして一次治療で使用しなかった殺細胞性薬物療法が選択する.一次治療がmFOLFOX6やCAPOXなどであればFOLFIRI,一次治療がFOLFIRIであればmFOLFOX6, CAPOXなどとなる.一次治療でFOLFOXIRIを選択した場合は2次治療としてFOLFIRIが選択されることが多い.2次治療では,複数の血管新生を抑制する分子標的薬が選択できる,bevacizumabのほか抗VEGFR2抗体であるramucirumab, VEGFトラップと呼ばれる特定のリガンドを阻害するafliberceptである.2次治療におけるこれらの選択には多くの議論がなされてきた.いずれの薬剤も2次治療での有効性が第3相試験で証明されており,それらから一つを積極的に選択する強いエビデンスはない.
HER2陽性症例には,2次治療としてpertuzumabとtrastuzumabの抗HER2抗体併用療法も使用できるようになった.国内で行われたPhaseⅡ試験では1次治療,2次治療に不応となったRAS遺伝子野生型かつHER2陽性の患者で,30%のレスポンスが観察された3).RAS変異の症例には効果があまり期待できないので注意が必要である.
3次治療にはマルチキナーゼ阻害薬regorafenibもしくはFTD/TPIが選択される.ごく最近,FTD/TPIとbevacizumab併用の有用性を検証した第3相試験であるSUNLIGHT試験の結果が報告された4).この試験ではFTD/TPI単独療法をコントロールとして2レジメン以上の前治療が行われた症例を対象としている.結果はFTD/TPI+bevacizumab群が有意に全生存期間を延長した(HR 0.61 [95%C.I. 0.49~0.77], p<0.001).おそらく今後日本のガイドラインにも掲載されることになるだろう.さらに,新しい薬剤としてVEGFR-1, -2および-3に対するキナーゼインヒビターであるfruquintinibの単剤治療を,4次治療以降の患者を対象にプラセボコントロールと比較したFRESCO-2試験の結果も発表されている5).RegorafenibもしくはFTD/TPIが9割以上の症例で使用されている対象でfruquintinibの有用性が証明されている.今後late line治療の選択は,多くの議論が必要になってくるだろう.
V.術後補助化学療法
術後補助化学療法は根治切除が行われた症例のうち病理診断でStageⅢ(あるいは一部のhigh risk StageⅡ)と診断された症例に対して再発を抑制するために行われる.1990年代後半にStageⅢ結腸癌で手術単独群と比較し,術後補助療法が有意にOSを延長することが明らかにされ,その後StageⅡ・Ⅲ結腸癌を対象にした数多くの試験が行われてきた.最終的にmFOLFOX6やCAPOX治療などのオキサリプラチンを含む治療がFU/LV併用療法に比べ無再発生存を有意に改善することが証明され,現在ではオキサリプラチンを含む治療が術後補助療法の標準治療となっている.日本を含めた多くの国が参加したIDEA groupでは,オキサリプラチンの投与量を減らすために,術後補助療法の投与期間を6カ月から3カ月に減らすための試験が行われた.長期フォローにおいて,3カ月と6カ月の全生存に大きな差はなく,現在では3カ月の治療が標準的な扱いになっている.日本人のみの部分解析でもStageⅢ低リスク群(T1-3およびN1)における3カ月のCAPOXは,6カ月のCAPOXと比較してむしろ良好な転帰であった(HR=0.70,95% CI:0.45~1.09,p=0.11)6).
現在のところ,術後補助化学療法は病理所見によりその適応が決定される.しかし病理学的因子のみの層別化では本当に薬物療法が必要な集団を選別しているとは言えず,治療強度を高めても,今以上に大腸癌の生存率を改善させることは難しい.また,大腸癌の薬物療法に使用されるオキサリプラチンは末梢神経障害を起こしやすく,癌が根治されても末梢のしびれが生涯残存することがある.再発リスクの少ない一部の症例には,不必要な治療のため有害事象を起こさせている可能性もある.
最近,遺伝子検査を利用したさまざまな方法で,術後補助療法の層別化を行う試みが行われている.なかでも有力な方法がctDNAを用いたリキッドバイオプシーである.ctDNAとは,末梢循環血液中に存在する癌由来のDNAである.次世代シーケンサー技術(NGS:Next Generation Sequencing)を応用して,ctDNAをがんゲノムプロファイリング(Comprehensive genome profiling:CGP)検査や微量残存がん細胞(minimal residual disease:MRD)の検出に応用できるようになった.既にctDNAが術後の再発モニタリングと術後補助療法適応決定に有用であることは多くの観察研究で報告されている.CIRCULATE-JAPANは,結腸・直腸癌の周術期治療におけるctDNAによるMRD(minimal residual disease)検査の重要性を示すための一連の大規模研究である.この研究には,レジストリとして使用されるGALAXY試験と,それと平行して行われる二つの介入研究VEGA,ALTAIR試験が含まれている(図2A).GALAXY試験では,十分な臨床情報と血中循環腫瘍DNAの結果が揃っている1,039例(ランダム化試験に登録された症例は除く)の結果が中間解析として発表されている7).術後4週時点で血中循環腫瘍DNA陽性は,陰性と比較して,再発リスクが著しく高く,18カ月時点での無病生存割合は血中循環腫瘍DNA陽性では38.4%,陰性では90.5%であった(HR 10.0,P<0.0001).さらに,StageⅡ/Ⅲの症例において,術後4週時点でctDNA陽性の場合,術後補助化学療法を受けなかった症例では18カ月時点での無病生存割合が22.0%であったのに対し,術後補助化学療法を受けると61.6%まで再発リスクが低下することが明らかとなった(HR 6.59,P<0.0001)(図2B).一方,術後4週時点でctDNA陰性例では,術後補助化学療法を受けなかった症例は18カ月時点での無病生存割合が91.5%,術後補助化学療法を受けた症例は94.9%と統計学的な有意差は認められなかった(HR 1.71,P=0.16)(図2C).この結果から,術後にctDNAを測定することで,大腸がん患者の再発リスクに応じた術後補助化学療法の選択ができることが期待される.
VI.直腸癌の術前治療
直腸癌は結腸癌と異なり,患者の肛門温存の希望に加え,放射線治療の選択肢もあるため結腸癌とは治療ストラテジーが異なる.以前から欧米では遠隔転移のない局所進行直腸癌には術前放射線化学療法(Chemoradiotherapy:CRT)を行ったのちに手術が行われることが一般的であった.最近では,さらにCRTに薬物療法を組み合わせるTotal neadjuvant therapy (TNT)が広く行われるようになっている.TNTには化学療法を先行する(induction chemotherapy)と化学療法を放射線治療後に行う(consolidation chemotherapy)の両方がある.最近欧米で行われた臨床試験ではconsolidation chemotherapyにより,手術を回避する率(no operative management:NOM)が上昇し,RFSも改善することが報告された8).現在日本でも,TNTの第3相試験としてEMSEMBLE studyが行われている.この臨床試験では,short courseの放射線治療(5Gy×5回)の治療後,consolidation therapyとしてCAPOXもしくはCAPAXIRIを行う.付随研究としてctDNAや全ゲノム解析も行うことになっており,順調に登録が進んでいる.
VII.おわりに
大腸癌は,正しい薬物療法の治療選択を行うため遺伝子検査が切り離せなくなっている.遺伝子検査は,適切な対象に,正しいタイミングで,必要なアッセイを行うことが大切である.そうすることで薬物療法の効果を最大に発揮できる.ただ,どんなに薬物療法が発展しても,大腸癌の根治には手術が重要な役割を果たしている.いままでは根治が不可能と思われていた症例でも薬物療法と手術の組み合わせで根治できる患者がますます増え,外科医には高度な技術が今以上に必要になってくるかもしれない.
利益相反
講演料など:中外製薬株式会社,武田薬品工業株式会社,日本イーライリリー株式会社,バイエル薬品株式会社 ,小野薬品工業株式会社,ブリストル・マイヤーズ スクイブ株式会社
研究費:ガーダントヘルスジャパン株式会社
文献
1) 大腸癌研究会:大腸癌治療ガイドライン 医師用 2022年度版.金原出版,東京,2022.
2) Yoshino T, Watanabe J, Shitara K, et al.: Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC):Results from the phase 3 PARADIGM trial. J Clin Oncol, 40(17 suppl): 2022.
3) Nakamura Y, Okamoto W, Kato T, et al.: Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer:a phase 2 trial. Nat Med, 27(11): 1899-1903, 2021.
4) Tabernero J, Prager G, Fakih M, et al.: Trifluridine/tipiracil plus bevacizumab for third-line treatment of refractory metastatic colorectal cancer:The phase 3 randomized SUNLIGHT study. J Clin Oncol, 41(Suppl 4): 2023.
5) Dasari NA, Lonardi S, Garcia-Carbonero R, et al.: FRESCO-2:A global phase Ⅲ multiregional clinical trial (MRCT) evaluating the efficacy and safety of fruquintinib in patients with refractory metastatic colorectal cancer. Ann Oncol, 33 (suppl 7):S808-S869, 2022.
6) Yoshino T, Oki E, Misumi T, et al.: Final Analysis of 3 Versus 6 Months of Adjuvant Oxaliplatin and Fluoropyrimidine-Based Therapy in Patients With Stage Ⅲ Colon Cancer:The Randomized Phase Ⅲ ACHIEVE Trial. J Clin Oncol, 40(29): 3419-3429, 2022.
7) Kotani D, Oki E, Nakamura Y, et al.: Molecular residual disease and efficacy of adjuvant chemotherapy in patients with colorectal cancer. Nat Med, 29(1): 127-134, 2023.
8) Garcia-Aguilar J, Patil S, Gollub MJ, et al.: Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy. J Clin Oncol, 40(23): 2546-2556, 2022.
PDFを閲覧するためには Adobe Reader が必要です。