日外会誌. 124(3): 253-260, 2023
特集
がん診療における層別化医療の現状と今後の展望
5. 胃がんにおける層別化医療の現状と今後の展望
|
神戸大学大学院医学研究科 外科学講座食道胃腸外科学分野 掛地 吉弘 |
胃癌治療ガイドラインでは,HER2陽性胃癌に対する一次療法でトラスツズマブ,三次療法でトラスツズマブ デルクステカンが推奨されている.MSI-High胃癌に対しては,二次療法でペンブロリズマブが推奨される.一次療法でオキサリプラチンを含む化学療法との併用でニボルマブが推奨され,PD-L1発現をみるcombined positive score (CPS)測定が治療効果と関連することから,一次治療前に可能な限り PD-L1 検査を実施することが望ましいとされている.大規模ながんゲノム解析の結果から胃がんは四つの生物学的なサブタイプに分類されることが示され,新たな分子標的(FGFR2,MET,Claudin 18.2など)も同定され,それらに対する分子標的薬を用いた新規治療法の開発が盛んに行われている.腫瘍組織や血液から複数の遺伝子を効率的にスクリーニングし,分子標的に応じた層別化治療が構築されようとしている.層別化治療の対象は,切除不能胃癌にとどまらず,切除可能な胃癌に対してもバイオマーカーによる術前補助化学療法の検証が進んでいる.今後は,胃癌組織の中でのクローンの空間的heterogeneityとともに治療経過とともに変化する時間的heterogeneityについても考慮した治療戦略が望まれる.
キーワード
HER2, 免疫チェックポイント阻害, FGFR2, MET, Claudin 18.2
I.はじめに
近年の大規模ながんゲノム解析の結果から胃がんゲノムの全体像が明らかとなり,新たな治療標的も同定され,各分子標的に対する新規治療法の開発も盛んに行われている.本章では,胃癌治療ガイドライン最新版,TCGA分類に触れ,開発中の新たな分子標的治療の現状と今後の展望について概説する.
II.胃癌治療ガイドライン
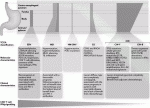
2021年7月に改訂第6版が出版され,その後一次治療における免疫チェックポイント阻害剤の併用が承認されたので,切除不能進行・再発胃癌に対する推奨される化学療法レジメンは図1のように示される1)2).
1.一次化学療法
HER2陽性胃癌におけるトラスツズマブを含む化学療法が標準療法として位置づけられていることから,一時治療前にHER2検査を行うことが強く推奨される.HER2検査の方法は免疫組織学的検査(IHC),in situ hybridization(ISH)検査である.
1-1) HER2陰性胃癌
胃癌の一次治療における免疫チェックポイント阻害剤の有用性について検討したATTRACTION-4 試験3)およびCheckMate649 試験4)で抗PD-1抗体ニボルマブ+化学療法による PFS の延長および腫瘍縮小効果の向上が一貫して認められたことから,SOX,CapeOX,FOLFOXとニボルマブの併用が推奨される.また,国内のSPIRITS試験5)からS-1+CDDP,海外の試験6)7)からCape+CDDPも推奨されている.
1-2) HER2陽性胃癌
HER2陽性の定義はIHC3+,またはIHC2+かつFISH陽性である.ToGA試験6)からCape+CDDP +トラスツズマブ,またS-1+CDDP,CapeOX,SOXとトラスツズマブの併用も推奨されている.
2.二次化学療法
RAINBOW試験8)より,パクリタキセル+ラムシルマブ療法が推奨される.高頻度マイクロサテライト不安定性(MSI-High)を有する胃癌に対しては,免疫チェックポイント阻害剤の一つである抗PD-1抗体ペンブロリズマブの有効性が高く,MSI検査は二次治療前に実施することを強く推奨する.
3.三次化学療法
全身状態の良好な症例に対する三次治療以降の化学療法としてニボルマブ,イリノテカン,FTD/TPIによる化学療法が推奨される.HER2陽性胃癌の三次治療としてトラスツズマブ デルクステカン9)が推奨される.

III.TCGA分類
The Cancer Genome Atlas(TCGA)プロジェクトの一環として,胃癌のゲノム,プロテオーム解析が行われ,胃癌が四つの分子サブタイプに分類できることが明らかになり,治療ターゲットになりうる分子が同定された10).その分子サブタイプとは,①Epstein-Barr virus(EBV),②microsatellite instability(MSI),③genomically stable(GS),④chromosomal instability(CIN)である.Nakamuraら11)は胃癌の分子標的治療についてこれまでのエビデンスを集め,TCGA分類のサブタイプの解剖学的局在と分子学的・臨床的特徴をまとめている(図2).
IV.分子標的治療
1.HER2(human epidermal growth factor receptor 2)
HER2陽性の割合は胃癌全体で約15~25%,食道胃接合部癌では30%,また高度リンパ節転移(Bulky N2 もしくはparaaortic)を伴う進行胃癌を対象とした JCOG 試験の統合解析では27%と比較的高い陽性率を示している.
トラスツズマブ デルクステカン(T-DXd)は,ヒト化モノクローナル抗体であるトラスツズマブとトポイソメラーゼⅠ阻害剤であるデルクステカンを共有結合させた抗体薬物複合体(antibody-drug conjugate:ADC)である.T-DXdはbystander effectによりHER2発現が弱い(IHC2+かつISH-,IHC1+)症例においても抗腫瘍効果が期待されている12).
抗HER2抗体治療がPD-1/PD-L1の発現を高めることから,トラスツズマブ+ペンブロリズマブ+化学療法の第Ⅲ相試験(Keynote-81113))が行われ,74.4%という高い奏効率が報告されている.また,既存の抗HER2抗体薬とはFc領域の構造が異なるマルゲツキシマブは活性型FcγRⅢ(CD16A)への結合能が高く,抗体依存性細胞障害活性(ADCC)がより強力に働く.マルゲツキシマブ+抗PD-1抗体レチファンリマブ併用療法(MAHOGANY試験 Cohort A)では奏効率53%と報告されている14).化学療法無しでは効果に限界があり,マルゲツキシマブ+レチファンリマブ+化学療法,あるいはマルゲツキシマブ+抗PD-1/抗LAG3抗体テボテリマブ+化学療法を含むMAHOGANY試験 Cohort Bの結果が待たれる.HER2受容体型チロシンキナーゼ阻害薬ツカチニブはトラスツズマブ+ラムシルマブ+パクリタキセルとの併用が検証されている(NCT0449924).ザニダタマブ(ZW25)は,HER2上の異なるエピトープであるECD2(トラスツズマブ結合ドメイン)とECD4(ペルツズマブ結合ドメイン)に結合する二重特異性抗体である.抗PD-1抗体チスレリズマブ+化学療法との併用が検証されている(NCT04276493).
2.FGFR2(fibroblast growth factor receptor 2)
細胞膜蛋白FGFR2の遺伝子増幅は胃癌の5%ほどにみられ,CINやGSサブタイプに多いとされている.FGFR2b過剰発現が認められたもしくは FGFR2遺伝子増幅が認められた胃癌患者を対象として,FGFR2のスプライスバリアントFGFR2bに対するベマリツズマブとmFOLFOX6併用療法がプラセボ+mFOLFOX6療法を比較したランダム化第Ⅱ相FIGHT試験15)で,ベマリツズマブ群の無増悪生存期間中央値は9.5カ月,プラセボ群は7.4カ月であった(hazard ratio [HR] 0.68 [95% CI 0.44–1.04; p=0.073).統計学的な有意差は証明できなかったが,第Ⅲ相試験(NCT05052801,NCT05111626)で検証されている.
3.MET(mesenchymal-epithelial transition factor)
胃癌のMET遺伝子増幅は1.5%ほどで頻度は少ないが,METチロシンキナーゼ阻害剤サボリチニブがVIKTORYアンブレラ試験16)で奏効率50%(20例中10例)を示した.
4.抗血管新生
抗VEGFR2抗体のラムシルマブがパクリタキセルとの併用で二次化学療法として推奨されている.VEGFRを標的としたチロシンキナーゼ阻害剤レゴラフェニブやフルキンチニブの検証も進んでいる(NCT02773524,NCT03223376).
5.Claudin 18.2
Claudinは細胞間結合タイトジャンクションの形成に関わる膜貫通型蛋白質で,消化器癌はCLDN18.2の発現がみられる.腫瘍細胞の40%以上でCLDN18.2の中等度から強度の発現を示す胃癌症例に対して,一次治療としての抗Claudin18.2抗体ゾルベツキシマブ+EOX療法がEOX群に対して無増悪生存期間(PFS)および全生存期間(OS)の有意なリスクの低下を示した(第Ⅱ相FAST試験17)).更に,ゾルベツキシマブ+mFOLFOX6併用療法が,プラセボ+mFOLFOX6群よりも有意に全生存期間(OS)と無増悪生存期間(PFS)を延長できたと発表された(第Ⅲ相SPOTLIGHT試験18): NCT03504397).またゾルベツキシマブ+CAPOX併用療法も検証されている(NCT03653507).
6.免疫チェックポイント阻害
一次化学療法におけるニボルマブ+オキサリプラチン併用化学療法,二次化学療法におけるMSI-High胃癌に対してペンブロリズマブが推奨されている.抗PD-1抗体+チロシンキナーゼ阻害剤(TKI)併用療法の奏効率もニボルマブ+レゴラフェニブ併用療法(EPOC160319))で44%,ペンブロリズマブ+レンバチニブ併用療法(EPOC170620))で69%と報告されている.ペンブロリズマブ+レンバチニブ+化学療法(CAPOX or mFOLFOX6)も検証されている(NCT04662710).
V.バイオマーカーによる選択的治療
次世代シーケンサーの登場により複数のがん種,複数の遺伝子を効率的にスクリーニングできるようになった.従来の分子標的と薬剤の1対1対応ではなく,1種のがんでがんの生存や増殖などに関わるドライバー遺伝子を複数特定し,その遺伝子を標的とする薬剤を投与するアンブレラ試験が可能になった.韓国のVIKTORY試験16)は二次治療として,八つのバイオマーカー(RAS異常,TP53変異,PIK3CA変異/増幅,MET増幅,MET過剰発現,全陰性,TSC2欠失,RICTOR増幅)により10の第Ⅱ相試験の一つに登録するデザインになっている.従来の薬剤レジメンに比べてPFSやOSの生存を延ばす効果が認められている.シカゴ大学によるPANGEA試験21)ではERBB2,MET,FGFR2,EGFRの増幅およびICIバイオマーカー(MSI-H,EBV-positive,CPS ≥10 and TMB ≥15 mut/Mb)により,HER2,MET,FGFR2,EGFR,PD-1,VEGFR2に対する抗体と化学療法の併用を一次から三次治療として行い,1年全生存率が66%と良好な成績を示している.
わが国では国立がん研究センターによる産学連携全国がんゲノムスクリーニング事業「SCRUM-Japan GI-SCREEN」が2015年に開始された.進行消化器癌を対象として腫瘍組織を用いてBRAFV600E変異やNTRK,ALK,ROS1融合遺伝子など,有病率1%未満の稀少な遺伝子異常も含めた解析が成された.さらに2018年からはリキッドバイオプシーを用いたスクリーニングプロジェクト「GOZILA Study」が行われ,腫瘍組織検査とリキッドバイオプシー検査の大規模な比較検討も成された22).リキッドバイオプシーが腫瘍組織検査と比べ,約22日早く解析結果が判明し,さらにゲノム解析結果に基づき,対応する治療薬の治験に登録した患者の割合が高まることが明らかになった.GOZILA Studyの結果から,血中循環腫瘍DNAでHER2遺伝子増幅が検出された切除不能固形がん患者を対象とするDS-8201a療法の多施設共同臨床第Ⅱ相試験(HERALD試験:JapicCTI-194707)やTMB-Hの治癒切除不能な進行・再発の消化器悪性腫瘍患者に対するニボルマブ単独療法の有効性および安全性を評価する多施設共同第Ⅱ相臨床試験(UMIN000033182)などが進んでいる.
VI.バイオマーカーによる術前補助化学療法
治癒切除可能な進行胃癌に対する術前補助化学療法は,欧米では標準治療とされているが,本邦では確立していない.バイオマーカーによる幾つかの臨床試験が行われている.
1.HER2
高度リンパ節転移を有するHER2陽性胃癌に対する術前トラスツズマブ併用化学療法の意義に関するランダム化第Ⅱ相試験(JCOG1301C)では,測定可能病変のある患者についてSP群の奏効率(ORR)は50%,SP+トラスツズマブ群は84%,Grade 1b以上の組織学的効果は24%と50%で,トラスツズマブを加えたレジメンのほうが良好だった23).中国のRESOLVE-2試験(NCT03691454)はSOXに対するDOSの優越性を検証する第Ⅱ/Ⅲ相試験で,HER2陽性症例にはトラスツズマブを上乗せするデザインになっている.EPOC2003試験(NCT05034887)は,HER2強陽性cohort(IHC3+ or IHC2+/ISH+)とHER2弱陽性cohort(IHC1+ or IHC2+/ISH- かつ HER2-ECD >11.6ng/mL)に対するトラスツズマブ デルクステカンの組織学的効果をみる.
2.免疫チェックポイント阻害
DANTE/FLOT8試験24)はFLOTとFLOT+抗PD-L1抗体アテゾリズマブを比較する第Ⅲ相試験で,FLOT+アテゾリズマブ群の全患者(n=146)での組織学的完全奏効率(TRG1a)は25%,PD-L1 CPS≥1(n=82)では26%,PD-L1 CPS≥5(n=40)では33%,PD-L1 CPS≥10(n=27)では41%,MSI-High(n=8)では63%と高い奏効率が報告されている.MATTERHORN試験(NCT 04592913)はPD-L1の発現状況を調べ,FLOTとFLOT+抗PD-L1抗体デュルバルマブを比較する.NEONIPIGA試験25)はミスマッチ修復機構欠損(dMMR)症例に対してニボルマブ+イピリムマブ併用療法を行い,病理学的完全奏効率(pCR)が58.6%であった.
VII.今後の展開
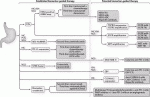
VIKTORY,PANGEA,GI-SCREEN/GOZILAなどの試験が展開されているように,分子学的に層別化した治療が構築されようとしている.Nakamuraら11)は,バイオマーカーに基づいた胃癌の層別化治療を提唱している(図3).HER2やPD-L1検索のための免疫組織化学染色やPCRによるMSI検査などは,一次治療の前にHER2標的治療や免疫チェックポイント阻害剤が有効な症例を判別するために行うべきである.ctDNAシークエンシングは標的分子を同定するだけでなく,腫瘍のクローン進化や薬物耐性機序を知る上でも有用である.
VIII.おわりに
治療ガイドラインにも記載されて日常診療で使われているバイオマーカーはHER2,MSI,PD-L1発現である.分子標的治療は高い奏効を示すので,融合遺伝子など希少な例も含めて層別化治療が今後進んでいくと考えられる.胃癌組織の中でのクローンの空間的heterogeneityとともに治療経過とともに変化する時間的heterogeneityについても考慮した治療戦略が望まれる.
利益相反
講演料など:大鵬薬品工業株式会社,小野薬品工業株式会社
奨学(奨励)寄附金:大鵬薬品工業株式会社
文献
1) 日本胃癌学会(編):胃癌治療ガイドライン医師用2021年7月改訂.第6版,金原出版,東京,2021.
2) Japanese Gastric Cancer Association:Japanese Gastric Cancer Treatment Guidelines 2021 (6th edition). Gastric Cancer, 26:1-25, 2023.
3) Kang YK, Chen LT, Ryu MH, et al.:Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol, 23: 234–247, 2022.
4) Janjigian YY, Shitara K, Moehler M, et al.:First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastrooesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet, 398:27-40, 2021.
5) Koizumi W, Narahara H, Hara T, et al.:S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase III trial. Lancet Oncol, 9:215-221, 2008.
6) Bang YJ, Van Cutsem E, Feyereislova A, et al.:Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet, 376:687-697, 2010.
7) Ohtsu A, Shah MA, Van Cutsem E, et al.:Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J Clin Oncol, 29:3968–3976, 2011.
8) Wilke H, Muro K, Van Cutsem E, et al.:Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol, 15:1224–1235, 2014.
9) Shitara K, Bang YJ, Iwasa S, et al.:Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer. N Engl J Med, 382, 2419-2430, 2020.
10) Cancer Genome Atlas Research Network:Comprehensive molecular characterization of gastric adenocarcinoma. Nature, 513:202-209, 2014.
11) Nakamura Y, Kawazoe A, Lordick F, et al.:Biomarker-targeted therapies for advanced-stage gastric and gastro-oesophageal junction cancers: an emerging paradigm. Nat Rev Clin Oncol, 18:473-487, 2021.
12) Yamaguchi K, Bang YJ, Iwasa S, et al.:Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-low, advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Results of the exploratory cohorts in the phase II, multicenter, open-label DESTINY-Gastric01 study. Ann Oncol, 31, S899-S900, 2020.
13) Janjigian YY, Kawazoe A, Yañez P, et al.:The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer. Nature, 600(7890):727-730, 2021.
14) Catenacci DVT, Kang YK, Yoon HH, et al.:Margetuximab with retifanlimab as first-line therapy in HER2+/PD-L1+ unresectable or metastatic gastroesophageal adenocarcinoma: MAHOGANY cohort A. ESMO Open, 7(5):100563, 2022.
15) Wainberg ZA, Enzinger PC, Kang YK, et al.:Bemarituzumab in patients with FGFR2b-selected gastric or gastro-oesophageal junction adenocarcinoma (FIGHT): a randomised, double-blind, placebo-controlled, phase 2 study. Lancet Oncol, 23: 1430-1440, 2022.
16) Lee J, Kim ST, Kim K, et al. :Tumor Genomic Profiling Guides Patients with Metastatic Gastric Cancer to Targeted Treatment: The VIKTORY Umbrella Trial. Cancer Discov, 9:1388-1405, 2019.
17) Sahin U, Türeci Ö, Manikhas G, et al.:FAST: a randomised phase II study of zolbetuximab (IMAB362) plus EOX vs EOX alone for first-line treatment of advanced CLDN182 positive gastric and gastro-oesophageal adenocarcinoma. Ann Oncol, 32: 609-619, 2021.
18) Shitara K, Lordick F, Bang YJ, et al.:Zolbetuximab + mFOLFOX6 as first-line treatment for patients with claudin-18.2+ / HER2− locally advanced unresectable or metastatic gastric or gastroesophageal junction adenocarcinoma: Primary results from phase 3 SPOTLIGHT study. J Clin Oncol, 41(4 suppl):LBA292, 2023.
19) Fukuoka S, Hara H, Takahashi N, et al.:Regorafenib plus nivolumab in patients with advanced gastric or colorectal cancer: an open-label, dose-escalation, and dose-expansion phase Ib trial (REGONIVO, EPOC1603). J Clin Oncol, 38: 2053–2061, 2020.
20) Kawazoe A, Fukuoka S, Nakamura Y, et al.:Lenvatinib plus pembrolizumab in patients with advanced gastric cancer in the first-line or second-line setting (EPOC1706): an open-label, single-arm, phase 2 trial. Lancet Oncol, 21: 1057–1065, 2020.
21) Catenacci DVT, Moya S, Lomnicki S, et al.:Personalized antibodies for gastroesophageal adenocarcinoma (PANGEA): a phase II study evaluating an individualized treatment strategy for metastatic disease. Cancer Discov, 11:308, 2021.
22) Nakamura Y, Taniguchi H, Ikeda M, et al.:Clinical utility of circulating tumor DNA sequencing in advanced gastrointestinal cancer; SCRUM-Japan GI-SCREEN and GOZILA studies. Natute Med, 26:1859-1864, 2020.
23) Tokunaga M, Machida N, Mizusawa J, et al.:A randomized phase II trial of preoperative chemotherapy of S-1/CDDP with or without trastuzumab followed by surgery in HER2 positive advanced gastric or esophagogastric junction adenocarcinoma with extensive lymph node metastasis: Japan Clinical Oncology Group study JCOG1301C (Trigger Study). J Clin Oncol, 40 (4 suppl):285, 2022.
24) Al-Batran SE, Lorenzen S, Thuss-Patience PC, et al.:Surgical and pathological outcome, and pathological regression, in patients receiving perioperative atezolizumab in combination with FLOT chemotherapy versus FLOT alone for resectable esophagogastric adenocarcinoma: Interim results from DANTE, a randomized, multicenter, phase IIb trial of the FLOT-AIO German Gastric Cancer Group and Swiss SAKK. J Clin Oncol, 40 (suppl 16):4003, 2022.
25) Andre T, Tougeron D, Piessen G, et al.:Neoadjuvant nivolumab plus ipilimumab and adjuvant nivolumab in patients (pts) with localized microsatellite instability-high (MSI)/mismatch repair deficient (dMMR) oeso-gastric adenocarcinoma (OGA): The GERCOR NEONIPIGA phase II study. J Clin Oncol, 40 (suppl 16):244, 2022.
PDFを閲覧するためには Adobe Reader が必要です。