日外会誌. 124(3): 239-245, 2023
特集
がん診療における層別化医療の現状と今後の展望
3.乳がんにおける層別化医療の現状と今後の展望
|
がん研有明病院 乳腺センター 大野 真司 |
乳がんは女性の悪性疾患の中で最多であるが,手術および放射線治療の局所治療に加え,バイオロジーに応じた薬物療法の進歩によって,その治療成績は著しく向上してきた.
1960年代から1970年代には化学療法やホルモン療法による再発抑制や生存期間延長の効果が認められ,治療効果予測因子を決定し,それに従って治療法を選択することの重要性が認識されるようになった.2000年からはcDNAマイクロアレイを用いた遺伝子発現プロファイリングによって,乳がんには多様なサブタイプが存在することがわかり,この概念は乳がん医療に大きな変化をもたらした.臨床現場においては,治療効果予測因子であるホルモン受容体の有無とHER2蛋白の過剰発現の有無,悪性度や増殖活性,さらには多遺伝子アッセイなどによって,内分泌療法,抗HER2療法,PARP阻害薬,免疫チェックポイント阻害薬,その他の分子標的療法薬などの適応が決定されるようになっている.
今後は層別化とともに個別化によってより適切な治療の選択が行われることとなる.増殖・転移機序の解明や新薬の開発,臨床試験などによって,耐性の克服,response-guide therapy,ゲノム医療,escalationとde-escalation治療,などが進歩し,さらなる治療成績の向上が期待されている.
キーワード
乳がん, サブタイプ, 層別化, 個別化, 多遺伝子アッセイ
I.はじめに
乳がんの治療は,2000年代前半からホルモン受容体(HR)やHER2受容体発現の有無によるサブタイプという概念が広く普及し,層別化という言葉は臨床試験組み入れにおける層別化因子として認識されてきたところがある.
遺伝子学的に浸潤性乳がんはHR陽性,HR陰性群に大別され,HR陽性乳がんは主にluminal A/Bに,HR陰性乳がんは主にHER2過剰発現群とbasal-like群に分けることができる.乳がん治療はこのサブタイプ分類を基盤として,疾患に対する理解が進み薬物療法の適応に関して検討されるようになった.薬物療法においてはLuminalタイプは内分泌治療,HER2陽性タイプは抗HER2療法,HR陰性かつHER2陰性のトリプルネガティブタイプは化学療法が主な治療法となる.このように乳がんは層別化治療によって治療成績の向上が図られてきた癌腫であり,固形腫瘍における層別化治療・個別化治療の先駆けを実践してきたといっても過言ではない.
本稿では,層別化の歴史,サブタイプに基づく治療の現状,および今後の展開について述べる.
II.乳がん治療層別化の歴史
乳がんは女性ホルモン依存性疾患であることが古くから知られていた.内分泌療法の基本概念は,卵巣や末梢組織でのエストロゲン産生を抑制すること,およびホルモン受容体の機能を修飾することであり,その治療は1896年のBeatsonによる卵巣摘出術以来の歴史を持つ.卵巣摘出の無作為化比較試験は1948年が最初であったが,1980年代に閉経前乳がん患者においてLH-RH agonistの効果が確認されると,外科的卵摘や卵巣照射は行われなくなった.1970年代前半にタモキシフェンによる術後補助療法としての試験が開始され,その後多くの試験においてホルモン受容体と閉経状況が層別化因子に組み込まれるようになった.
化学療法による術後治療の無作為化比較試験は1970年前後に開始され,1990年代からは多剤併用化学療法やタキサン系薬剤の追加が行われるようになってきた.また,1985年,ヒトEGFRに類似した受容体型チロシンキナーゼがクローニングされ,HER2と名付けられた.Her2/neuタンパク質と結合するモノクローナル抗体トラスツズマブは,米国で1992年より臨床試験が開始され,化学療法と併用することでHER-2陽性進行・再発乳癌患者の全生存が向上することが明らかになった1).
周術期全身薬物療法が再発,死亡までの期間を延長することが判明すると,化学療法,ホルモン療法,あるいは化学・ホルモン療法が有効である患者群,サブグループを選択することが重要な問題となってきた.すなわちER(エストロゲン受容体)/PgR(プロゲステロン受容体),HER2などの治療効果予測因子を決定し,それに従って治療法を選択することの重要性が認識されるようになった.
新しい治療法の安全性と有効性を確認するには大規模な無作為化比較試験が必要であるが,治療群と対照群の有意差が得られた試験は必ずしも多くはなく,種々の後層別解析にあるサブグループで無病生存期間(DFS),全生存期間(OS)が延長されるという成績が得られる程度が多かった.このような状況を鑑み,Early Breast Cancer Trialists’ Collaborative Group (EBCTCG)が結成され,術後治療の無作為化比較試験を集計,overview解析が行われた.これによりそれぞれに治療の効果がサブグループ別に明確となってきた2).
St. Gallen国際乳がんコンセンサス会議では1978年以来手術可能乳がんの治療指針が討議されてきた.2011年には,乳がんの多様性を考慮したサブタイプごとの治療が推奨され,論文タイトルも「Strategies for subtypes--dealing with the diversity of breast cancer」と明示された3).このようにこれまでのタイトルからも層別化・個別化治療の変遷を知ることができる(表1).
進行・再発乳がんの治療指針は,1998年のHortobagyiのアルゴリズム4)が現在においても基本になっている.ホルモン受容体の有無に病勢すなわち生命を脅かす転移を加えることで,薬物療法の適応が検討される.

III.遺伝子発現と内因性サブタイプ
cDNAマイクロアレイを用いた遺伝子発現の網羅的解析技術,遺伝子発現プロファイリングによって,乳がんが遺伝子レベルでは多様性に富んだ疾患であることがわかってきた.2000年にPerouらによって,内因性サブタイプ分類(intrinsic subtype)の概念が提唱され,少なくともLuminal like subtype,normal,HER2-enriched,basal-likeの四つのサブタイプに分類された5).その後研究が進み,luminal A type,luminal B type,ERBB2+type(HER2-enriched type),basal-like type,normal breast-likeの5型に分類されたが,当初は新しい予後因子としての分類であった.その後,化学療法のみならず内分泌療法に関しても,治療効果についてサブタイプ分類との相関がみられ,サブタイプ分類は薬剤感受性を示す効果予測因子としての側面が重要視されるようになった.
現在,内因性サブタイプ分類には通常,サブタイプを推定する方法として開発された多遺伝子アッセイPAM50(Prediction analysis of microarray 50)が用いられている6).再発リスクを予測するモデルROR (risk of recurrence)スコアは,各サブタイプとの相関の強さに基づいて再発リスクを0~100に数値化し,低・中間・高リスクの3群に分類する.ER陽性乳がんのほとんどはluminal Aあるいはluminal Bサブタイプに分類される.luminal Aサブタイプは増殖が遅く予後良好である.luminal Bサブタイプはluminal Aサブタイプに比べて増殖が速く予後不良である.
IV.免疫組織化学法とサブタイプ
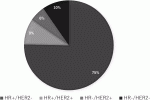
日常的にすべての乳がんの全遺伝子を網羅的に解析することは困難であるため,簡便な分類方法として免疫組織化学染色(IHC)によるER,PgR,HER2,増殖細胞マーカー(Ki67)などの発現を基にサブタイプを決定し臨床に応用されるようになった.そのサブタイプに応じて,早期および進行・再発乳がんの治療薬が適応となる(表2).また図1は日本乳癌学会の全国乳がん患者登録調査報告7)におけるサブタイプ別症例数を示す.
・Luminal乳がん
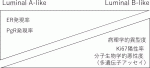
乳がん全体の70~75%を占めるホルモン受容体陽性かつHER2陰性乳がんすなわちLuminal乳がんは,内分泌治療が主体であるが化学療法を上乗せするかどうかが課題となる.生物学的悪性度の低いものに対しLuminal A-like,高いものに対しLuminal B-likeとされ,その判別に用いられる病理学的項目には,病理学的異型度,ER発現率,PgR発現率,Ki67発現率等がある(図2).近年は,多遺伝子アッセイによるリスク分類が重視され,治療薬選択に広く用いられている.また,再発高リスク乳がんや,進行再発乳がんでは内分泌療法薬にCDK4/6阻害薬が併用され,高い治療成績をあげている.
・多遺伝子アッセイ
Oncotype DXⓇはER陽性/HER2陰性乳がんを対象とし,RT-PCR法で21遺伝子の発現を測定して,治療効果予測・予後予測を行う.特にホルモン療法への化学療法の上乗せ効果からその適応決定に有用な検査である8).
MammaPrintⓇは,予後と関連の強い70遺伝子を用いた予後予測をする手法である.clinical riskが低いと評価される場合はMammaPrintⓇおよび抗がん剤がいずれも不要である,clinical riskが高いと評価される場合であっても,MammaPrintⓇによるリスクが低ければ抗がん剤による上乗せ効果は認められない9).
Curebest 95GC BreastⓇは,再発に関係する95遺伝子群を抽出し,高リスク/低リスク2群に分ける予後予測法である.Oncotype DXⓇにおけるintermediate risk群を高リスク群と低リスク群に分類することが示されている10).
・HER2乳がん
HER2陽性乳がんは増殖能が高く予後不良であったが,抗HER2薬であるトラスツズマブが臨床導入され,治療成績は著しく向上した1).再発高リスクには抗HER2薬を2剤併用するdual-HER2 blockade,再発低・中等度リスクにはアンスラサイクリン系抗がん薬の省略,術前化学療法において浸潤がんが遺残したnon pCR例には抗体薬物複合体であるT-DM1への変更などが行われている11).また進行・再発乳がんには抗体複合体T-DXdの高い有効性も示されている12).
・トリプルネガティブ乳がん
ER,PgR,HER2の発現がすべて陰性であると判定された乳がんはトリプルネガティブ乳がんと呼ばれている.トリプルネガティブ乳がんはホルモン療法,抗HER2療法の効果がなく,化学療法が必要な予後不良のタイプである.トリプルネガティブ乳がんは生物学的にも臨床的にも多様な腫瘍を含んでいるため,生物学的特性に応じた治療の層別化を目指す研究が続けられており,有効な治療法や治療効果予測因子の発見が待たれている.
・新たな層別化因子
PD-L1 (Programmed cell Death ligand 1)とは細胞の表面に発現しているタンパク質で,免疫細胞であるT細胞の表面にあるPD-1(Programmed cell Death 1)と呼ばれるタンパク質に結合し,免疫細胞の働きを抑制する.
BRCA1およびBRCA2は損傷したDNAの修復に関わるタンパク質を生成する遺伝子であり,細胞内遺伝子の安定性維持に重要な役割を果たす.BRCA1/2遺伝子変異などが起きているがん細胞では,DNA損傷時にPARP (poly [ADP]-ribose polymerase)阻害剤でPARPを阻害すると,DNA複製に伴って2本鎖が切断されても相同組換え修復欠損(homologous recombination deficiency;HRD)となり,細胞が合成致死へ誘導される.

V.今後
・サブタイプの変化
再発および転移巣においてサブタイプの不一致がみられることが報告されている13).サブタイプ分類は乳がんの治療薬の選択において重要な指標となるため,治療過程あるいは再発時にサブタイプの変化が生じた場合は適切な治療薬を選択できていない可能性がある.サブタイプ変化の機序解明が,薬剤抵抗性の克服や適切な治療法開発に役立つことが期待される.
・De-escalationとEscalation
進歩する治療の中で,De-escalationとEscalationという概念の重要性が注目されるようになった.De-escalationという言葉は乳がん診療においては,予後改善を求めて増強されてきた治療強度を,適切な患者選択や新規薬剤・戦略を駆使することで良好な予後を維持しつつ治療強度を下げる戦略,という意味で使用されている.薬物療法では多遺伝子アッセイを用いた術後化学療法の省略,早期HER2陽性乳がんに対するパクリタキセル+トラスツズマブ療法(APT trial)などが挙げられる.今後,サブタイプ別により治療成績を向上させるための薬物療法の追加や,術前薬物療法奏効例での薬物や局所療法省略などの臨床試験の結果が待たれる.
・ゲノム医療
層別化の進歩とともにより個別化治療も進んでいく.本邦でも2019年6月より遺伝子パネル検査として,FoundationOne CDx がんゲノムプロファイルとOncoGuide NCC オンコパネルシステムの2種類が保険収載されることになった.しかし,高額な検査であることから全症例に行うことは難しく,その適切な適応や治療薬の開発が望まれるところである.
・低HER2
HER2低発現乳がんとはHER2陰性乳がんの新たな下位分類で,細胞膜上にHER2タンパクがある程度発現しているものの,HER2陽性に分類するほどの量ではない乳がんのことを指す.新規乳がん患者の80~85%はHER2陰性乳がんで,このうちの60%はHER2低発現乳がんと判定される見込みである14).米食品医薬品局は,切除不能または転移性のHER2低発現乳がん患者を対象に,抗体複合体T-DXdを承認し,今後低HER2という新たな分類が用いられる可能性がある.
VI.おわりに
乳がん治療は早くからサブタイプの概念が浸透し,治療成績向上に貢献してきた.今後は層別化治療に加えて,escalationとde-escalation,response-guide therapy,ctDNA利用,ゲノム医療などの発展によってさらなる治療効果が期待される.一方で治療戦略の複雑化は避けることができず,そのために患者・家族とのshared decision makingが今後ますます重要となってくるであろう.
利益相反
講演料など:中外製薬株式会社,日本イーライリリー株式会社,MSD株式会社,日本化薬株式会社
研究費:エーザイ株式会社,大鵬薬品工業株式会社
文献
1) Slamon DJ, Leyland-Jones B, Shak S, et al.:Use of Chemotherapy Plus a Monoclonal Antibody Against HER2 for Metastatic Breast Cancer That Overexpresses HER2. New Engl J Med, 344: 783–792, 2001.
2) Gelber RD, Cole BF, Goldhirsch A, et al.:Adjuvant chemotherapy plus tamoxifen compared with tamoxifen alone for postmenopausal breast cancer:meta-analysis of quality-adjusted survival. Lancet, 347: 1066-1071, 1996.
3) Goldhirsch A, Wood WC, Coates AS, et al.:Strategies for subtypes--dealing with the diversity of breast cancer:highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol, 22: 1736-1747, 2011.
4) Hortobagyi GN:Treatment of breast cancer. N Engl J Med, 339: 974-984, 1998.
5) Perou CM, Sørlie T, Eisen MB, et al.:Molecular portraits of human breast tumours. Nature, 406: 747-752, 2000.
6) Parker JS, Mullins M, Cheang MCU, et al.:Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol, 27: 1160-1167, 2009.
7) 日本乳癌学会ホームページ. 2023年1月1日. https://www.jbcs.gr.jp/
8) Sparano JA, Gray RJ, Makower DF, et al.:Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. N Engl J Med, 379: 111-121, 2018.
9) Cardoso F, van’t Veer LJ, Bogaerts J, et al.:70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med, 375: 717-729, 2016.
10) Naoi Y, Kishi K, Tanei T, et al.:Development of 95-gene classifier as a powerful predictor of recurrences in node-negative and ER-positive breast cancer patients. Breast Cancer Res Treat, 128: 633-641, 2011.
11) von Minckwitz G, Huang CS, Mano MS, et al.:Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med, 380: 617-628, 2019.
12) Modi S, Saura C, Yamashita T, et al.:Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med, 382: 610-621, 2020.
13) Niikura N, Liu J, Hayashi N, et al.:Loss of human epidermal growth factor receptor 2 (HER2) expression in metastatic sites of HER2-overexpressing primary breast tumors. J Clin Oncol, 30: 593-599, 2012.
14) Modi S, Jacot W, Yamashita T, et al.:Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med, 387: 9-20, 2022.
PDFを閲覧するためには Adobe Reader が必要です。