日外会誌. 124(2): 190-197, 2023
特集
糖代謝異常と外科医療
8.糖代謝異常に対する移植医療の現状と展望
|
京都大学 肝胆膵・移植外科 穴澤 貴行 , 山根 佳 , 伊藤 孝司 , 長井 和之 , 内田 洋一朗 , 福光 剣 , 石井 隆道 , 秦 浩一郎 , 波多野 悦朗 |
インスリン依存糖尿病において,糖尿病専門医による厳格なインスリン治療によっても血糖コントロールが困難で,高血糖の持続に伴う腎不全をはじめとする糖尿病合併症の発症や,重症低血糖発作の回避が困難な症例が存在する.このような病態に対し,血糖応答性のインスリン分泌を回復し糖尿病の根治をも可能とする治療として,膵臓移植と膵島移植という移植医療が実施されている.膵臓移植は,腎移植と同時に実施されることが多く,移植手術手技の進歩や免疫抑制療法の改良により成績が安定し,インスリン依存糖尿病患者の生命予後を改善しうる治療として確立している.低侵襲な細胞移植の手法で移植される膵島移植は,膵臓移植の欠点となりうる手術の侵襲性や周術期合併症の懸念がなく,より理想的な移植医療である.当初は一般的な医療として展開するには不十分な移植成績であったが,近年の良好な臨床試験成績により治療効果の改善が確認され,多くの国々で重症インスリン依存糖尿病患者の治療オプションとして確立されつつある.本邦でも2020年から膵島移植術が保険収載され,膵臓移植と膵島移植の二つの移植医療が選択できる状況となった.今後,膵・膵島移植の選択基準の確立や,再生医療的アプローチの開発により,糖尿病移植医療の新たな展開が期待される.
キーワード
糖尿病, 膵臓移植, 膵島移植, 再生医療
I.はじめに
1型糖尿病や膵全摘後などにより内因性インスリン分泌が枯渇したインスリン依存糖尿病に対する治療は,インスリン製剤の改良や先進的医療機器の開発により大きな進歩が得られている.しかし,これらの治療によっても血糖コントロールが困難な症例が存在する.理想的な治療は,血糖応答性のインスリン分泌を再び可能にすることであり,その手段として膵臓移植と膵島移植という移植医療が実施されている.膵臓移植は,手術手技の進歩や免疫抑制療法の改良により成績が安定し,確立された医療として実施され,生命予後も改善しうる1).低侵襲な細胞移植の手法で移植される膵島移植は,“実験的”な医療とされてきたが,成績改善や臨床試験結果の蓄積により各国で一般的な医療として位置づけられるようになり,本邦でも2020年から膵島移植術が保険収載された.本稿では,膵臓移植・膵島移植の現状と今後の展望を紹介する.
II.膵臓移植の現状
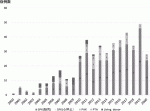
1966年に米国・ミネソタ大学で世界最初の膵臓移植が行われて以来,全世界で60,000例程の膵臓移植が行われてきた.本邦では,2000年から2020年までに脳死・心停止ドナーからの膵臓移植が438例(脳死下 435 例,心停止下3例),生体膵臓移植27例の計465症例が実施されている(図1).膵臓移植の主な対象は内因性インスリン分泌が枯渇し腎不全に陥った患者(主に1型糖尿病),あるいは,あらゆる治療手段によっても血糖コントロールが困難で無自覚性低血糖発作を合併する1型糖尿病である.腎移植との関係から,膵腎同時移植(Simultaneous pancreas and kidney transplant:SPK),腎移植後膵臓移植(Pancreas after kidney transplant:PAK),そして膵単独移植(Pancreas transplant alone:PTA)に分けられ,膵腎同時移植が最も実施数が多い.膵臓移植により,インスリンからの離脱が達成されるだけでなく,糖尿病性合併症を防ぎ,生命予後をも改善することが示されている2).
膵臓グラフトは右腸骨窩の腹腔内あるいは右腸骨窩の腹腔外(後腹膜腔)に移植される.移植膵周囲の液体貯留等を考慮して腹腔内に移植する場合が多い.腎臓は左腸骨窩の腹腔外(後腹膜)に移植される.グラフトを吻合する血管は,右外腸骨動静脈が第一選択となるが,血管の硬化の程度により,総腸骨動静脈や大動脈,下大静脈を選択する場合もある.膵液のドレナージ法には,腸管ドレナージと膀胱ドレナージがあり,グラフトの十二指腸を小腸,あるいは膀胱に吻合する.腸管ドレナージは生理的であること,膀胱ドレナージは尿中アミラーゼ値を拒絶反応診断の指標に用いることができる,という利点がある.膀胱ドレナージには,膵液の重炭酸が尿中へ喪失することによるアシドーシスや尿路の刺激症状,逆流性膵炎等の合併症があり,腸管ドレナージが選択されることが多い.
膵臓移植では腎移植に準じた免疫抑制療法が施行される.図2に,膵腎同時移植における当院の免疫抑制プロトコールを示す.導入時に抗IL-2受容体抗体(バシリキシマブ)を投与し,副腎皮質ステロイド,カルシニューリン阻害剤(CNI),代謝拮抗薬を維持免疫抑制療法に使用する4剤併用療法が基本である.耐糖能への悪影響や腎機能障害を有するステロイド,CNIの使用量を減ずるため,欧米ではポリクローナル抗体である抗ヒト胸腺細胞ウサギ免疫グロブリン(ATG)が導入時に用いられており,本邦でも使用が検討されている.腎移植後であればmTOR阻害薬が保険収載されており,CNIを低用量に抑え腎機能への悪影響を回避することも可能である.
膵臓移植後1年,3年,5年,10年におけるレシピエント生存率はそれぞれ95.8%,95.8%,94.2%,88.7%と報告されている.グラフト生着率でみると,膵グラフト生着率は85.9%,80.6%,76.2%,67.4%,同時に移植された場合の腎グラフト生着率は93.2%,92.9%,90.8%,78.2%であった3).本邦では,①45歳以上,②不安定な血行動態(高用量のカテコラミンの使用),③心停止下での提供,等で規定される,「マージナルドナー」からの膵臓移植が実施例の70%程度を占めるが,欧米に遜色ない移植成績を達成している.移植成績の課題として,腎移植を同時に併施しない膵臓移植の生着率の課題が挙げられる.膵臓移植後1年,3年,5年における膵グラフト生着率は,SPKでは87.3%,85.4%,83.2%であったのに対し,PAKでは85.4%,67.6%,52.3%,そしてPTAでは66.7%,41.6%,31.2%であった.機能廃絶の要因としては,慢性拒絶反応が主要因として挙げられている3).海外では,免疫抑制療法等の進歩により,SPKとPAK/PTAの間の生着率の差が縮まってきていることが報告されており4),今後本邦でも解決に向かうことが期待される.
膵臓移植は周術期合併症が多いとされ,Technical failureが問題となってきた.最も多い要因にはグラフト血栓症が挙げられ,その他,感染症,移植膵膵炎,十二指腸吻合部縫合不全等がある.近年は,手術手技の改善や合併症対処法の改善等により,Technical failure率は5~6%まで低下してきている4).
改善しつつある移植成績から,欧米では血糖コントロールが困難な2型糖尿病にも膵臓移植の適応が拡大されつつある5).United Network for Organ Sharing の報告によると,1996年から2000年ではレシピエント全体の4.6%が2型糖尿病であったが,2016年から2020年の間には18.4%に増加している.今後,移植治療が望まれる2型糖尿病の病態について十分な検討が必要であると思われる.

III.膵島移植の現状
膵臓移植は,インスリン離脱と生命予後の改善をもたらす治療であるが,血管の脆弱性を有する糖尿病患者に対し侵襲の大きい手術を必要とし,手術に伴う合併症の発症も少なくない点が弱点とも言える.インスリン分泌を担う膵島のみを移植で,インスリン依存状態糖尿病を根治しうるとのコンセプトは,1970年代から動物実験レベルで徐々に実証され,臨床試験が実施されてきたが,当初はその成績は不良であった.膵島移植の臨床展開において重要なマイルストーンとなった「エドモントン・プロトコール」は,2000年にカナダ・エドモントンにあるアルバータ大学から報告された.腎機能が維持された1型糖尿病患者を対象とし,ステロイドを免疫抑制療法から排除したプロトコールにて,新鮮膵島を複数回移植することを特徴とする方法で,膵島移植でもインスリン離脱が可能であることが報告された6).その後実施された多施設共同臨床試験でも治療成績の再現性が確認された7).インスリン離脱率やその期間については膵臓移植に劣るものの,重症低血糖発作の抑制効果は長期間維持されるとされ8),徐々に各国で1型糖尿病に対する治療オプションとして組み込まれる様になり,世界中で4,000回以上の膵島移植が実施されている9).
膵島移植成功には,脳死または心停止ドナーから提供された膵臓から「膵島分離」を行い,Viabilityの高い膵島を多く分離することが前提である.膵島分離は,膵摘出→保存・運搬→膵臓膨化→膵臓消化→膵島純化→培養からなり,それぞれの過程に工夫が加えられてきた10).膵島分離後に,レシピエント体重当たり5,000 IEQ/kg以上の膵島収量,純度30%以上,組織量10ml未満,viability 70%以上,エンドトキシン5 IU/kg未満,およびグラム染色陰性,といった基準を満たした場合に移植が行われる.膵島は,局所麻酔下で経皮経肝的に門脈内に留置したカテーテルから,移植用溶液に浮遊させた膵島を輸注することで移植される.全身麻酔や開腹術が不要で,短時間で移植術は終了する.
米国を除く諸外国では,膵島移植は移植医療の一つとして発展しているが,米国では,移植する膵島を生物製剤(Biologics License Application:BLA)として承認する方針となり,CIT-07というPhase 3試験が行われた.この試験では,ATGを導入免疫抑制療法に使用し,また移植早期に可溶性TNFαレセプター製剤を用いて移植時の炎症反応を抑制するプロトコールを採用した.維持免疫抑制療法は,CNIにmTOR阻害剤または代謝拮抗薬(ミコフェノール酸モフェチル)を組み合わせた.主要エンドポイントである「移植後1年における血糖コントロールの安定化(HbA1c 7.0%未満)かつ重症低血糖発作の消失」は87.5%で達成された11).また,腎移植後膵島移植においてもCIT-06というPhase 3試験が実施され,腎移植後膵島移植の有用性も確認されている12).その後,長い審査期間を要したが,米国ではBLAとしての膵島の承認に至った.世界で最多の症例を実施してきたアルバータ大学からの臨床成績の報告13)では,追跡期間中央値7.4年において,膵島グラフト生着期間中央値は5.9年で,70%のレシピエントにおいてグラフト生着の継続が確認された.グラフト生着が良好であった症例は,移植時点での1型糖尿病の罹患期間が長く,年齢も高く,インスリン必要量が少ない傾向が認められたことは今後の適応検討に重要な情報である.インスリン離脱は,1年後61%,5年後32%,10年後20%で,経時的に離脱率は低下するものの,長期に膵島グラフトの生着を維持することは可能で,血糖値の安定化や低血糖発作リスクの低減等が得られることが示されている.これらから,膵島移植の臨床効果については,全例にインスリン離脱が長期に得られる治療ではないものの,血糖変動を安定化させ,重症低血糖発作に苦しむ患者を救う,安全・低侵襲な治療法であると位置づけられている.
本邦では,2004年に国内初の臨床膵島移植が実施され,当初は各施設での臨床研究として実施されてきた.2004年から2007年までに本邦で実施された34回・18症例への膵島移植では,生着中の重症低血糖発作の消失は確認されたが,5年後の生着率が20%程度であり長期成績に課題があった14).海外での成績改善を受けて,膵島移植保険導入に向け多施設共同臨床試験が実施された.先進医療Bとして実施したこの試験では,免疫抑制導入時にATGを投与し,維持免疫抑制にはCNIとミコフェノール酸モフェチルの2剤を用いた.中間解析において,主要エンドポイントである,“初回移植から1年後にHbA1c値<7.4%であり,かつ初回移植後90日から移植後365日にかけて重症低血糖発作が消失した患者の割合”は75%であり,この試験の早期中止(有効中止)の基準を満たしたため,2019年10月に試験は終了となり総括報告がなされている.この試験の成績や海外の治療成績をふまえ,2020年4月に「同種死体膵島移植術」として保険収載されるに至った.現在当院では図3のような免疫抑制療法により膵島移植を実施している.膵島移植は,移植対象症例を20歳以上としており,内因性インスリン分泌低下の基準を随時血清C-ペプチド < 0.2 ng/mLとしている.一方,中等度以上の肥満や高度腎機能障害は適応除外することとなっている.その他の基準は表1に示す.


IV.糖尿病移植医療の今後の課題と展望
膵島移植が保険導入され糖尿病移植医療の選択肢が増えたものの,そのすみ分け,いわゆる“allocation”は確立されていない.膵臓移植は,臓器移植法を遵守して実施されるが,膵島移植は,「組織移植」の範疇で日本組織移植学会のガイドラインに則って実施され,また法律上は臓器移植法ではなく再生医療等安全性等確保法を遵守して実施されている.このような背景から,膵島移植に提供される膵臓は臓器移植である膵臓移植に医学的に適応がないとされるものに限られており,高齢または肥満ドナーといった場合が該当する.移植候補者の条件からは,移植の安全性や治療効果を考慮して,年齢やBMIによって膵臓移植か膵島移植かを判断するという提言がある15).本邦でも臨床的エビデンスをもとに移植医療の“allocation”の検討を進める必要がある.現時点での膵臓移植と膵島移植の比較を表2に示す.
移植医療の問題点は,ドナーの出現に依存しOn demandな治療としては提供できないこと,および本邦ではドナーの数が欧米に比して極めて少ないことが挙げられる.その解決策として,再生医療による治療法開発が進められている.多能性幹細胞由来のインスリン分泌細胞を用いた細胞移植は,すでに海外では臨床試験が実施されており,新たな治療法として確立しうる可能性を示している16).本邦でも,臨床グレードのiPS細胞由来膵島細胞が開発されており,臨床試験実施に向けた準備が進められている.移植医療と再生医療とが,それぞれの特徴を活かして開発,発展を続けることで,重症糖尿病治療にさらなる治療オプションをもたらすことが期待される.

V.おわりに
膵臓移植,膵島移植の現状と展望を報告した.膵・膵島移植医療の発展に加え,今後は再生医療による新たな移植の開発も進んでおり,いわゆる“β cell replacement therapy”の新たな展開が期待される.
利益相反:なし
文献
1) Rana A , Gruessner A , Agopian VG , et al.: Survival benefit of solid-organ transplant in the United States. JAMA Surg, 150(3): 252-259, 2015.
2) Esmeijer K , Hoogeveen EK , van den Boog PJM , et al.: Superior Long-term Survival for Simultaneous Pancreas-Kidney Transplantation as Renal Replacement Therapy:30-Year Follow-up of a Nationwide Cohort. Diabetes Care, 43(2): 321-328, 2020.
3) Tomimaru Y , Eguchi H , Doki Y , et al.: Current state of pancreas transplantation in Japan based on the nationwide registry. Ann Gastroenterol Surg, 5(4): 494-501, 2021.
4) Gruessner AC , Gruessner RWG : The 2022 International Pancreas Transplant Registry Report-A Review. Transplant Proc, 54(7): 1918-1943, 2022.
5) Weems P , Cooper M : Pancreas transplantation in type II diabetes mellitus. World J Transplant, 4(4): 216-221, 2014.
6) Shapiro AM , Lakey JR , Ryan EA , et al.: Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med, 343(4) : 230-238, 2000.
7) Shapiro A , Ricordi C , Hering B , et al.: International trial of the Edmonton protocol for islet transplantation. N Engl J Med, 355(13): 1318-1330, 2006.
8) Barton FB , Rickels MR , Alejandro R , et al.: Improvement in outcomes of clinical islet transplantation: 1999-2010. Diabetes Care, 35(7): 1436-1445, 2012.
9) Berney T , Andres A , Bellin MD , et al.: A Worldwide Survey of Activities and Practices in Clinical Islet of Langerhans Transplantation. Transpl Int, 35: 10507, 2022.
10) Anazawa T , Okajima H , Masui T , et al.: Current state and future evolution of pancreatic islet transplantation. Ann Gastroenterol Surg, 3(1): 34-42, 2019.
11) Hering BJ , Clarke WR , Bridges ND , et al.: Phase 3 Trial of Transplantation of Human Islets in Type 1 Diabetes Complicated by Severe Hypoglycemia. Diabetes Care, 39(7): 1230-1240, 2016.
12) Markmann JF , Rickels MR , Eggerman TL , et al.: Phase 3 Trial of Human Islet-after-Kidney Transplantation in Type 1 Diabetes. Am J Transplant, 21(4): 1477-1492, 2021.
13) Marfil-Garza BA , Imes S , Verhoeff K , et al.: Pancreatic islet transplantation in type 1 diabetes:20-year experience from a single-centre cohort in Canada. Lancet Diabetes Endocrinol, 10(7): 519-532, 2022.
14) Saito T , Gotoh M , Satomi S , et al.: Islet transplantation using donors after cardiac death: report of the Japan Islet Transplantation Registry. Transplantation, 90(7): 740-747, 2010.
15) Wojtusciszyn A , Branchereau J , Esposito L , et al.: Indications for islet or pancreatic transplantation:Statement of the TREPID working group on behalf of the Société francophone du diabète (SFD), Société francaise d’endocrinologie (SFE), Société francophone de transplantation (SFT) and Société française de néphrologie - dialyse - transplantation (SFNDT). Diabetes Metab, 45(3): 224-237, 2019.
16) Ramzy A , Thompson DM , Ward-Hartstonge KA , et al.: Implanted pluripotent stem-cell-derived pancreatic endoderm cells secrete glucose-responsive C-peptide in patients with type 1 diabetes. Cell Stem Cell, 28(12): 2047-2061.e5, 2021.
PDFを閲覧するためには Adobe Reader が必要です。